一株H1N1亚型猪流感病毒全基因克隆及遗传特性分析
孟慧芝,孙 涛,岳志芹,王文斌
(1.山东出入境检验检疫技术中心,山东青岛266000;2.山西农业大学,山西太谷030801)
猪流感(Swine influenza,SI)是由A 型流感病毒引起的一种急性、高度接触性的呼吸道传染病。根据表面糖蛋白血凝素(HA)和神经氨酸酶(NA)的抗原性差异,A 型流感分为18个H 亚型和11个N亚型[1-2]。目前,在猪体内分离到的流感亚型众多,广泛流行于我国猪群中的有H1N1、H3N2[3]等不同血清亚型。刘丽萍等[4]曾在2012年-2013年以类禽型H1N1(EAH1N1)和2009甲型H1N1(pdm/09 H1N1)抗原对我国大多数省份猪群抗体做了调查,发现猪流感 H1N1 抗体阳性率为55.52%和13.92%。虽然猪流感病毒(Swine influenza virus,SIV)在猪与猪的传播中有限,但均能引起猪的较高发病率,而且已经证实1918年古典SIV 和2009年新型SIV 都能感染并致人死亡,甚至在人与人之间传播[5-6],但在人类之间传播的分子机制目前未知,因此对猪流感的持续监测,不仅对畜牧业有重大的经济意义,其公共卫生意义更不容忽视。
本文拟利用自行设计的条形码引物,对2009年自山东猪场分离到的一株H1N1流感病毒进行全基因组快速扩增和测序,并与古典猪流感、禽源猪流感、人源猪流感比对,并对其遗传演化关系进行分析,从分子水平上探究该病毒来源,为进一步研究SIV 抗原变异和遗传演化关系积累数据。
1 材料与方法
1.1 材料
1.1.1 毒株及载体 猪源分离株:A/swine/Shandong/01/2009(H1N1)由山东出入境检验检疫实验室保存;9日龄~11日龄SPF 鸡胚由山东农业科学院家禽研究所提供;大肠埃希菌DH5α感受态细胞及pMD-18T 克隆载体为宝生物工程(大连)有限公司产品。
1.1.2 试剂 Rneasy Mini Kit是QIAGen公司产品;cDNA 反转录试剂盒、EX-Taq聚合酶、SolutionⅠ连接酶、Agarose Gel DNA Extration Kit试剂盒、Plasmid Purification Kit试剂盒均为宝生物工程(大连)有限公司产品;血凝抑制抗体,猪流感H1/H3亚型阳性血清,血凝抑制抗原,96 孔血凝板为哈尔滨维科生物技术开发公司产品。
1.2 方法
1.2.1 病毒的分离及血凝抑制试验
1.2.1.1 病毒分离 将该株病毒采用常规鸡胚尿囊腔接种培养,无菌传代3次,经培养收获的病毒用鸡红细胞进行血凝效价测定。
1.2.1.2 血凝试验(HA)和血凝抑制试验(HI)血凝试验采用常规微量法进行,取收获的培养物尿囊液进行血凝抑制试验,测定其对1 mL/L 公鸡红细胞的凝集活性;将有血凝活性的培养物,使用NDV 标准血清、H1N1 标准血清、H3N2 标准血清等进行血凝抑制试验。
1.2.2 病毒全基因的RT-PCR扩增
1.2.2.1 引物设计 根据Hsu M T 等[8]发现的流感病毒每个基因两端均有的共同分子结构,同时参考Hoffman E 等[9-10]所 设 计 条 码 引 物 序 列,利 用Primer 5.0软件设计合成11对引物,送Invitrogen公司合成(表1)。

表1 设计的引物和预期目的片段大小Table 1 Primers used and size of expected products
1.2.2.2 病毒RNA 提取 与cDNA 的合成 取500μL的鸡胚尿囊液,按QIAGen RNA 提取试剂盒操作步骤提取RNA,每份病毒RNA 样品溶解于50μL的RNase free水,12 000r/min离心2min,立即开始反转录,以U12 5′-AGCAAAAGCAGG-3′为引物,参照宝生物工程(大连)有限公司1st strand cDNA Synthesis Kit cDNA 试剂盒使用说明加入试剂,RT 反应条件为:30℃10 min,42℃40 min,70℃15min,冰上冷却。
1.2.2.3 毒株各个基因扩增条件 PCR 扩增程序:94℃4 min;94℃30s,聚合酶PB2-1、PB2-2、PB1-1、PB1-2、PA-1、PA-2 分 段 引 物 退 火 温 度 为50.5℃,72℃延伸1.5 min;其他引物57℃退火,72℃延伸7min,30个循环[9];72℃终延伸10min。取7μL PCR 产物在10g/L 琼脂糖凝胶上电泳检查结果。
1.2.3 连接与转化 PCR 产物的回收按Agarose Gel DNA Purification Kit说明书进行。将各自胶回收的PCR 产物与pMD-18T 载体1∶3比例16℃过夜连接后,取10μL加入200μL的感受态细胞悬液,42℃热激1.5min,冰上迅速冷却,加入1mL不含Amp LB液体培养基混匀,37℃振荡培养1h,取50μL菌液涂布于含氨苄的LB培养基上,37℃过夜培养,挑取生长状况良好的单个菌落,再接种于含氨苄的LB液体培养基中,37℃过夜培养。
1.2.4 测序及比对 经鉴定为阳性菌落挑克隆培养菌液送宝生物测序,拼接序列。利用 MEGA 5.05软件 将本株的8段基因与不同年份的猪流感、禽流感、人流感的代表株进行比对后,绘制基因进化树。
2 结果
2.1 血凝抑制试验
接种11日龄鸡胚,盲传至第3 代,48h 后收集尿囊液进行血凝试验,血凝效价为26~29,选择血凝效价为29的尿囊液稀释16倍进行血凝抑制试验。结果显示,NDV、H3为阴性,H1为阳性,血凝抑制效价为25。血凝抑制试验与核苷酸同源性比对结果一致,确认为是H1亚型。
2.2 RT-PCR 结果
RT-PCR 扩增出的11个目的片段与预期大小相符。测序后,利用MEGA5.05软件拼接,获得除3′和5′最末端引物设计区域以外的整个基因组的核苷酸序列。1 0g/L的凝胶电泳条带见图1。
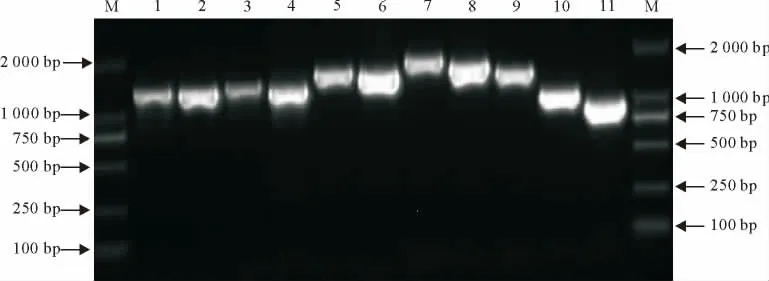
图1 8个基因RT-PCR扩增结果Fig.1 RT-PCR results of 8genes
2.3 测序结果与同源性比较
参考A 型流感病毒H1N1 亚型的8 个基因节段两端共有的分子结构序列,设计通用条码引物,扩增得到了包含8个节段的A 型流感病毒的全长cDNA。测序结果表明其全基因大小为13 136bp(GenBank 登录号为KM368310-KM368317)。纵观整个进化树,H1N1猪流感病毒年份不一,地区不同,或同一年份不同地区,隔一段时间就会监测到基因重组。祁贤等[11]研究发现,A/California/07/2009的PB2和PA 基因由禽传到猪群后已经进化了10年左右;而PB1在人群中进化了30年后,又在猪群中进化了约10年。而2009年新型猪流感独立的形成一个小分支,由系统进化图可知本株的8段基因与近5年在人和猪中流行的11株A 型流感相近,HA 的同源性为98.1%~99.7%,NA 基因的同源率达98.6%~99.8%,与美国疫苗株A/California/07/2009(H1N1)的8 个片段同源性结果比较:核苷酸同源性高达99.1%~99.6%,氨基酸同源性达97.6%~99.5%。Blast分析发现此毒株与2009年-2010 年 的200 条H1N1 毒 株 同 源 性 达99%以上,表明2009A(H1N1)流感毒株多,遗传变异低,范围广。近3年来,2009新型流感H1N1 偶尔发生漂移。
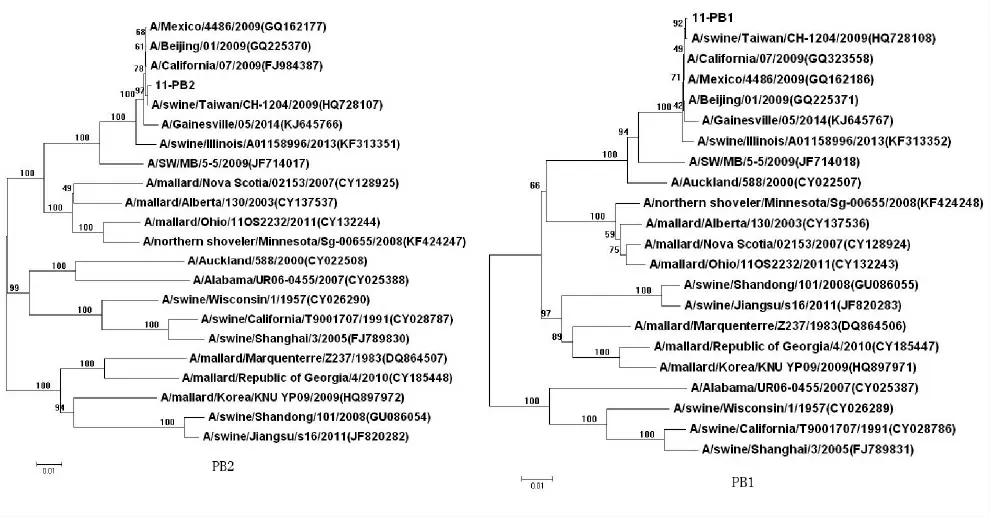
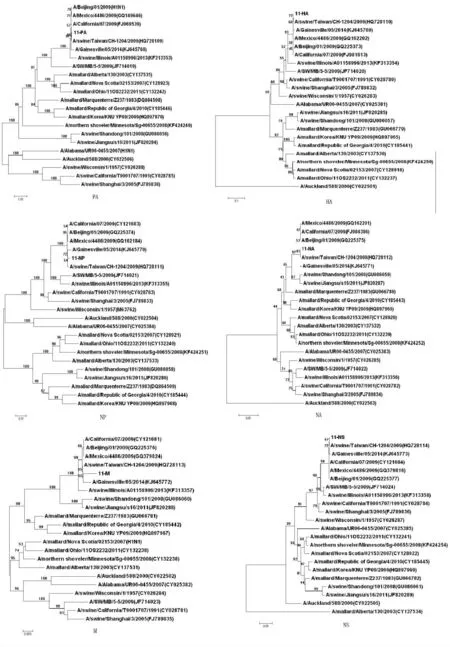
图2 SIV8个基因(PB2、PB1、PA、HA、Np、NA、M、NS)的系统进化树Fig.2 The phylogenetic tree of SIV 8genes(PB2,PB1,PA,HA,Np,NA,M,NS)
序列分析进化树表明:本株的HA、NP、NS 3个基因与4株猪流感聚在一起,其中包括古典猪流感代表株A/swine/Wisconsin/1/1957(H1N1),说明这3个基因来自古典猪流感,PB2、M、PA 和NA与多株禽流感毒株形成一个大的分支,PB1与人流感A/Auckland/588/2000(H3N2)聚到一起,这与Gavin[12]等推测2009年新型猪流感的基因来源一致。此外,在聚合酶基因进化树分析上,本株与新近流行的A/swine/Illinois/A01158996/2013相近,但M、NS基因与之有一定遗传距离。说明2009年以后并非新型猪流感完全取代了近代流行的猪流感,A/swine/Jiangsu/s16/2011即是一个很好的实例。
3 讨论
目前,很多学者[13-14]通常扩增部分序列,研究流感病毒的分型及流行病学特征。但全基因扩增测序对流感病毒分子进化研究以及准确追踪病毒起源仍具有重要意义。Hsu M T 等[8]发现,流感病毒每个基因片段的5′端前13个核苷酸,3′端前12个核苷酸均高度保守,且RNA 分子环化形成锅柄状结构。本研究即依据流感病毒各基因共有的分子结构,设计扩增条码引物,获得了13 136bp的全基因组序列。但聚合酶基因扩增时,PB2、PB1和PA 3种聚合酶基因因其长度较长,可能拥有较为复杂的二级结构,在57℃退火时很难完全变性,扩增成功率仅为40%~50%[15],因此本研究中对聚合酶基因采用分段扩增方式,拼接得到了3个聚合酶基因的全序列。
蛋白序列分析可见:本株A/swine/Shandong/01/2009(H1N1)的PB1-F2蛋白,12位都有一个终止密码子的存在,阻断氨基酸的翻译,NS1 蛋白由于660位的核苷酸G-A 出现终止密码子TGA 也被截断,这与Garten R J等[6,11]分析的毒株情况一致。但具体原因有待进一步的探索。金刚烷胺类药物对A 型流感病毒的M2蛋白具有阻碍功能作用,抑制病毒增殖[6],此流感病毒(M2)带有S31N 遗传标记,具有抗金刚烷胺的抗病毒药物的作用,对奥塞米韦和扎那米韦敏感。HA 切割位点处氨基酸序列为PSIQSR/GLF,无多个连续的碱性氨基酸,符合非致病性切割位点的特征。
特异位点研究发现,病毒宿主特异性受多基因的影响,HA 基因的226位成为影响病毒宿主特异性的主要因素,L226对唾液酸(SAα2,6gal)有较高的亲和力,主要感染猪和人类呼吸道上皮细胞,而病毒Q226 有较低的SAα2,6gal亲和力和低感染水平,倾向于特异性结合禽上皮细胞,而226为甲硫氨酸M,可同时结合禽流感和人流感受体。本株226位为Q[7],是2009 年新型流感病毒的一个典型特征。此外聚合酶在禽流感病毒适应哺乳动物起了关键作用,PB2基因的627位氨基酸残基是决定宿主特异性的主要因素[16],通常禽源流感病毒PB2基因627位是谷氨酸E,人流感病毒该位置为赖氨酸(K),蛋白分析发现本毒株为E,说明本株PB2基因来源于禽流感,这与进化树分析一致。PB1基因的375 位氨基酸涉及甲型流感病毒宿主范围的特异性[17],同 时,PB1 蛋 白 通 常 在 流 感 病 毒375 位 为 丝氨酸S时,毒株便具有潜在感染人的能力,其公共卫生防护不容忽视。
综上所述,本毒株A\swine\Shandong\01\2009(H1N1)序列完整,HA、NP、NS来源于古典猪流感谱系,PB2、M、PA 和NA 来源于禽流感谱系,PB1来源于人流感H3N2,是多种谱系的混合体,人类从未感染过此类病毒,可能缺乏免疫保护能力,从而显示出其较强的致病能力。
[1] Tong S X,Li Y,Zhang J.New world bats harbor diverse influenza A viruses[J].Bat Influenza Virus,2013,9(10):e1003657.
[2] Tong S X,Li Y,Rivailler P,et al.A distinct lineage of influenza A virus from bats[J].PNAS,2012;109(11):4269-4274.
[3] 黄维娟,成艳辉,李希妍,等.2011-2012年度中国H3N2亚型流感病毒病原学特征分析[J].病毒学报,2013,29(3):258-263.
[4] 刘丽萍,乔传玲,陈 艳,等.2012年-2013年我国养猪重点省份猪流感的血清学调查[J].中国预防兽医学报,2014,36(6):431-434.
[5] Worobey M,Han G Z,Andrew R.Genesis and pathogenesis of the 1918pandemic H1N1influenza A virus[J].PNAS,2014,111(22):8107-8112.
[6] Garten R J,Davis C T,Russell C A,et al.Antigenic and genetic characteristics of swine-origin 2009A(H1N1)influenza viruses circulating in humans[J].Science,2009,325(5937):197-201.
[7] Liu Y Z,Wang J,Ji J,et al.Phylogenetic diversity and genotypic complexity of H1N1subtype swine influenza viruses isolated in Mainland China[J].Virol J,2012,9(289):1-12.
[8] Hsu M T,Parvin J D,Gupta S,et al.Genomic RNAs of influenza viruses are held in a circular conformation in virions and in infected cells by terminal panhandle[J].Proc Nati Acad Sci USA,1987,84(22):8140-8144.
[9] Hoffmann E,StechJ,Guan Y,et al.Universal primer set for the full-length amplification of all influenzaA viruses[J].Arch Virol,2001,146:2275-2289.
[10] Li O T,Barr I,Leung C Y,et al.Reliable universal RT-PCR assays for studying influenza polymerase subunit gene sequences from all 16 haemagglutinin subtypes[J].J Virol Meth,2007,142:218-222.
[11] 祁 贤 汤奋扬,李 亮,等.新甲型H1N1(2009)流感病毒的早期分子特征[J].微生物学报,2010,50(1):82-90.
[12] Smith G J,Vijaykrishna D,Bahl J.Origins and evolutionary genomics of the 2009swine-origin H1N1influenza A epidemic[J].Nature,2009,459:1122-1125.
[13] Alvarez A C,Brunck M E,Boyd V.A broad spectrum,onestep reverse-transcription PCR amplification of the neuraminidase gene from multiple subtypes of influenza A virus[J].Virol J,2008,5(77):1-11.
[14] Phipps L P,Essen S C,Brown I H.Genetic subtyping of influenza A viruses using RT-PCR with a single set of primers based on conserved sequences within the HA2coding region[J].J Virol Meth,2004,122:119-122.
[15] Chan C H,Lin K L,Chan Y,et al.Amplification of the entire genome of influenza A virus H1N1and H3N2subtypes by reverse-transcription polymerase chain reaction[J].J Virol Meth,2006,136:38-43.
[16] Subbarao E K,London W,Murphy B R.A single amino acid in the PB2gene of influenza A virus is a determinant of host range[J].Virol J,1993,67(4):1761-1764.
[17] Kawaoka Y,Krauss S,Webster R G.Avian-to-human transmission of the PB1gene of influenza A viruses in the 1957and 1968pandemics[J].Virol J,1989,63(11):4603-4608.

