“三黄连”合剂抗炎作用研究
杨 剑,牛晓艺,谭红连,黄 明,梁万文,胡庭俊*
(1.广西大学动物科学技术学院,广西南宁530005;2.广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西南宁530021)
炎症是机体对于刺激的一种防御反应,表现为红、肿、热、痛和机能障碍。通常炎症是有益的,但更多时候对动物机体有害。炎症反应能够成为一些疾病的发病基础,严重时甚至可以危及生命。因此,对于抗炎药物的研究显得极其重要。糖皮质激素(如地塞米松),具有极强且迅速的抗炎作用,对于哮喘炎症、葡萄膜炎、肺炎以及手术后炎症反应均有良好的抗炎效果[1-3]。但是其不良反应的报道也逐渐增多,如精神异常、过敏性皮疹等症状[4]。
近年来,国内外研究发现许多中草药及其制剂也具有较好的抗炎作用,极具开发潜力。有文献表明,黄芩苷和盐酸小檗碱在体内外均表现出良好的抗炎作用[5-8]。“三黄连”合剂是由黄芩、黄连、连翘等按中兽医理论组方的中兽药新制剂,由广西大学动物科学技术学院兽医药理实验室自主研制,主要活性成分为黄芩苷、盐酸小檗碱、连翘苷等。本课题组前期研究表明,“三黄连”合剂对于海豚链球菌引起的罗非鱼链球菌病有一定的预防与治疗作用。研究其抗炎作用,可为开发中兽药新复方“三黄连”合剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞 昆明种小鼠,SPF级,体重为20g~25g,购自广西医科大学实验动物中心,试验前暂养7d。小鼠单核-巨噬细胞系RAW264.7细胞由广西大学动物科学技术学院兽医药理实验室保存。
1.1.2 药物、试剂与仪器 地塞米松磷酸钠注射液为郑州卓峰制药有限公司产品;黄芩、连翘等药材饮片购自广西壮族自治区南宁市山草堂中药材店;脂多糖LPS为美国Sigma公司产品;二甲基亚砜为北京索莱宝科技有限公司产品;胎牛血清、DMEM 高糖培养基为美国HyClone公司产品;TNF-α、IL-1β、IL-6、IL-8酶联免疫吸附试验ELISA 试剂盒为上海劲马生物科技有限公司产品;0114型打孔器为宁波得力公司产品;MCO-5AC二氧化碳培养箱为日本三洋株式会社产品;光学显微镜为日本尼康产品;超净工作台为苏净安泰公司产品;168-1130型酶标仪为美国BIO-RAD公司产品。
1.2 方法
1.2.1 “三黄连”合剂的制备 “三黄连”合剂(0.5 g/mL),广西大学动物科学技术学院药理实验室自制。制备方法:按照复方比例称取中药材共50g,加入500mL蒸馏水浸泡0.5h,后100 ℃水浴1h,过滤,保留滤液;滤渣再加入500mL蒸馏水继续水浴,过滤取滤液,重复2次;将3次过滤所得滤液合并,3 000r/min离心30min,取上清于旋转蒸发仪浓缩至300mL;加入950mL/L酒精使混合液中酒精浓度为800mL/L,静置24h,取上清液于旋转蒸发仪回收酒精,浓缩至100mL,为“三黄连”合剂;经0.22μm 微孔滤膜过滤除菌,4 ℃保存备用。使用前用细胞维持液稀释至所需浓度。
1.2.2 体内抗炎试验 取50只健康昆明系小鼠,雌雄各半,随机分为5组,每组10只。空白对照组灌胃30mL/kg生理盐水,“三黄连”合剂高、中、低剂量组分别灌服30、15、7.5mL/kg“三黄连”合剂,阳性对照组腹腔注射地塞米松磷酸钠注射液10ml/kg(换算为地塞米松的注射含量为25mg/kg)。各组均连续用药5d。根据参考文献方法[9],最后一次给药1h后,将0.04mL二甲苯均匀涂于小鼠右耳两面,左耳作为对照。致炎后20min将小鼠称重后脱颈椎法处死,沿耳廓线剪下两耳,用直径6mm 的打孔器分别在两耳的同一部位打下左右耳片,随即用电子天平称重,以两耳片重量之差作为炎性肿胀度,并计算耳肿胀率,公式如下:小鼠耳肿胀度=左耳重量-右耳重量;耳肿胀率=[(左耳重量-右耳重量)/右耳重量]×100%。同时摘取各小鼠的胸腺、脾脏、肝脏和肾脏,称重后计算小鼠的胸腺、脾脏、肝脏、肾脏指数。
1.2.3 体外抗炎试验
1.2.3.1 “三黄连”合剂的细胞毒性作用 采用MTT法对“三黄连”合剂的细胞毒性进行评价。取对数生长期RAW264.7细胞,采用台盼蓝拒染法调整浓度为4×105cells/mL,100μL/孔,接种于96孔培养板,37℃、体积分数为5%的CO2培养过夜。空白对照组加入100μL细胞维持液;LPS组中LPS终浓度为1μg/mL;高、中、低剂量药物组中“三黄连”合剂终浓度 分 别 为2.00 mg/mL、1.00 mg/mL 和0.50 mg/mL;药物处理1h后加入终浓度为1μg/mL LPS处理。培养20h后每孔加入10μL 5mg/mL MTT,继续培养4h。培养结束后,吸弃上清,加入100μL DMSO,避光反应10min后测定OD 490nm值。
1.2.3.2 NO 含 量 测 定 根 据“三 黄 连”合 剂 对RAW264.7细胞的毒性试验结果,判断“三黄连”合剂的安全剂量范围。取对数生长期RAW264.7细胞,台盼蓝染色法调整浓度为4×105cells/mL,96孔板培养,100μL/孔,于体积分数为5%CO2培养箱中37℃过夜。设置空白对照组、不同浓度药物组,每组5个重复。药物组各组中分别加入“三黄连”合剂,使终浓度分别为2.00、1.00、0.50mg/mL,药物作用1h后,以终浓度为1μg/mL LPS刺激,继续培养24h;培养结束后,吸取培养上清,加入等量的Griess试剂,测定OD 490nm值。
1.2.3.3 细胞因子的测定(TNF-α、IL-1β、IL-6、IL-8)
取对数生长期RAW264.7细胞,台盼蓝染色法将细胞浓度调整为4×105cells/mL,96 孔板培养,100 μL/孔,37℃、体积分数为5%的CO2培养箱中过夜。设置空白对照组、不同浓度药物组,每组5个重复。药物组各组中分别加入“三黄连”合剂,使终浓度分别为2.00、1.00、0.50 mg/mL,37 ℃、体积分数为5%CO2条件下作用1h后,以终浓度为1μg/mL LPS刺激,继续培养24h;培养结束后吸取上清,各指标测定方法参照ELISA试剂盒说明书,测定OD 450nm值。
1.2.4 数据分析处理 试验数据采用¯x±SD形式表示,数据采用SPSS18.0软件处理,Duncan法分析组间差异。
2 结果
2.1 体内抗炎试验结果
2.1.1 “三黄连”合剂对小鼠耳廓肿胀的影响 各组小鼠耳肿胀度及耳肿胀率结果如表1。阳性对照组及“三黄连”合剂高、中剂量组对小鼠的耳肿胀度和耳肿胀率均小于空白对照组,且差异极显著(P<0.01)。低剂量组小鼠的耳肿胀度和耳肿胀率均小于空白对照组,但差异不显著(P>0.05)。高剂量药物组小鼠的耳肿胀度及耳肿胀率均小于阳性对照组,但差异不显著(P>0.05)。
2.1.2 “三黄连”合剂对小鼠脏器指数的影响 肝脏指数:阳性对照组的肝脏指数极显著高于空白对照组(P<0.01),而“三黄连”合剂各个剂量组与空白对照组相比差异不显著(P>0.05)(图1)。
肾脏指数:各组的肾脏指数差异均不显著(P>0.05)(图2)。
脾脏指数:阳性对照组小鼠的脾脏指数小于空白对照组,且差异极显著(P<0.01),“三黄连”合剂各剂量组与空白对照组相比差异不显著(P>0.05)(图3)。
胸腺指数:阳性对照组小鼠的胸腺指数小于空白对照组,且差异极显著(P<0.01),“三黄连”合剂中剂量组小鼠胸腺指数大于空白对照组,且差异显著(P<0.05)。“三黄连”合剂高、低剂量组胸腺指数与空白对照组差异不显著(P>0.05)(图4)。
2.2 体外抗炎试验结果
2.2.1 “三黄连”合剂对RAW264.7细胞的毒性作用
各处理组OD 490nm值与空白对照组差异不显著(P>0.05),表明LPS对细胞活性没有影响,高、中、低浓度(2.00、1.00、0.50mg/mL)的“三黄连”合剂在24 h内对细胞无毒性,可以进行下一步试验(图5)。
2.2.2 “三黄连”合剂对RAW264.7细胞分泌NO 的影响 采用NaNO2制备不同浓度标准液并测定NO2-,根据浓度及OD 490nm值进行线性分析,得到标准曲线为:y=0.002 1x+0.058 2(R2=0.998 7)。Griess法检测待测样细胞培养上清的OD 490nm值,并根据标准曲线计算各组的NO 生成量(图6)。LPS组的NO生成量极显著高于空白对照组(P<0.01),各浓度药物组及药物+LPS组的NO 生成量与空白对照组相比差异不显著(P>0.05);空白对照组、各浓度药物组和药物+LPS组的NO 生成量均小于LPS组,且差异极显著(P<0.01)。高、中、低浓度组的NO生成量随着药物浓度的增加而降低,提示“三黄连”合剂在0.5 mg/mL~2.0 mg/mL 浓度范围内可抑制RAW264.7细胞NO生成,且呈浓度依赖关系。
2.2.3 “三黄连”合剂对RAW264.7细胞的细胞因子生成的影响
2.2.3.1 “三黄连”合剂对RAW264.7细胞TNF-α生成的影响 “三黄连”合剂对RAW264.7细胞分泌TNF-α的影响结果如图7。LPS组TNF-α的生成量升高,与空白对照组相比差异极显著(P<0.01),而各个浓度”三黄连”合剂组均抑制了TNF-α的产生,与LPS组相比均差异极显著(P<0.01),并且呈浓度依赖关系。

表1 “三黄连”合剂对二甲苯致小鼠耳廓肿胀的影响Table 1 Effects of Chinese herbal compound“San Huang Lian”on xylene-induced ear edema in mice
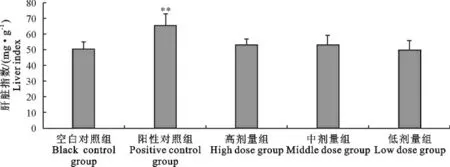
图1 “三黄连”合剂对小鼠肝脏指数的影响Fig.1 Effect of Chinese herbal compound“San Huang Lian”on liver index in mice
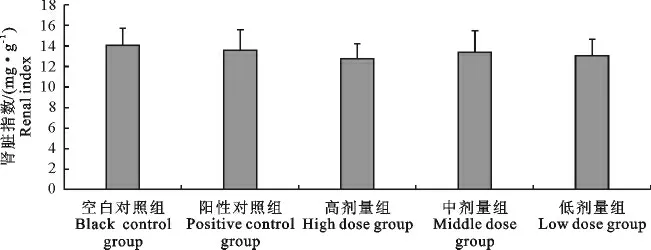
图2 “三黄连”合剂对小鼠肾脏指数的影响Fig.2 Effect of Chinese herbal compound“San Huang Lian”on renal index in mice
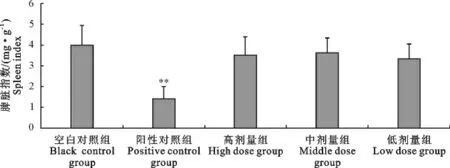
图3 “三黄连”合剂对小鼠脾脏指数的影响Fig.3 Effect of Chinese herbal compound“San Huang Lian”on spleen index in mice
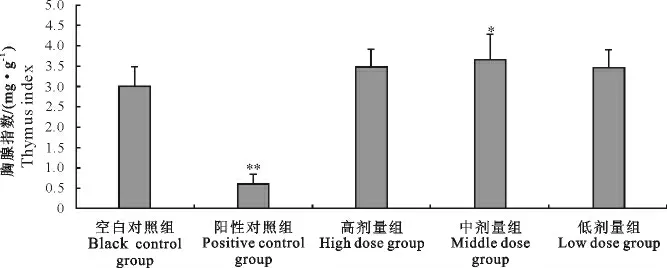
图4 “三黄连”合剂对小鼠胸腺指数的影响Fig.4 Effect of Chinese herbal compound“San Huang Lian”on thymus index in mice
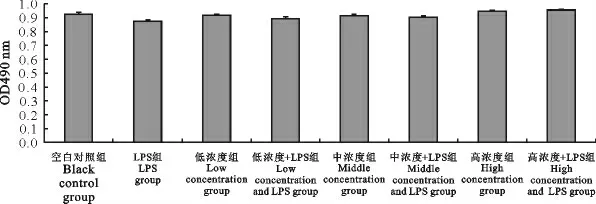
图5 “三黄连”合剂对RAW264.7细胞的毒性作用Fig.5 The toxic effects of Chinese herbal compound“San Huang Lian”on RAW264.7cells
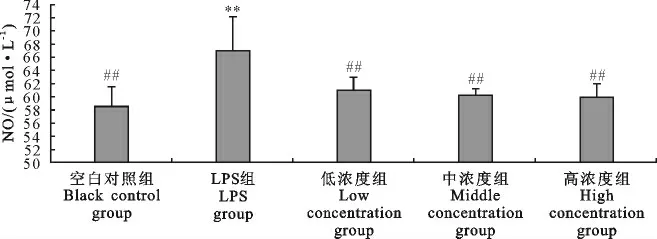
图6 “三黄连”合剂对RAW264.7细胞分泌NO的影响Fig.6 Effects of Chinese herbal compound“San Huang Lian”on NO secretion in RAW264.7cells
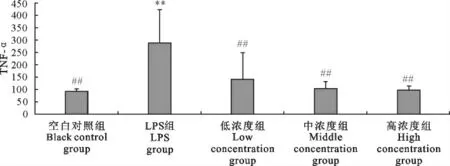
图7 “三黄连”合剂对RAW264.7细胞分泌TNF-α的影响Fig.7 Effects of Chinese herbal compound“San Huang Lian”on TNF-αsecretion in RAW264.7cells
2.2.3.2 “三黄连”合剂对RAW264.7细胞IL-8生成的影响 根据标准曲线对细胞样品的OD 450nm值进行统计分析,得到各个重复样本的IL-8浓度,各组比较结果见图8,LPS组细胞生成的IL-8浓度显著高于空白对照组(P<0.01),低浓度(0.5mg/mL)和中浓度(1.0mg/mL)组与空白对照组相比差异显著(P<0.05);空白对照组及各个浓度药物组IL-8浓度均小于LPS组,且差异极显著(P<0.01)。说明“三黄连”合剂在0.5 mg/mL~2.0 mg/mL 范围内对RAW264.7细胞的IL-8的生成具有抑制作用,且呈浓度依赖关系。
2.2.3.3 “三黄连”合剂对RAW264.7细胞IL-6生成的影响 根据标准曲线对待测样所测得的OD 450nm值进行运算,得到各个重复样本的IL-6浓度,各组比较结果见图9,LPS组的IL-6含量高于空白对照组,且差异极显著(P<0.01),而各个浓度药物组与空白对照组相比差异不显著(P>0.05);各个浓度药物组与LPS组相比差异显著(P<0.01或P<0.05)。提示“三黄连”合剂在0.5mg/mL~2.0mg/mL浓度范围内对RAW264.7细胞IL-6的生成具有抑制作用,且呈浓度依赖关系。
2.2.3.4 “三黄连”合剂对RAW264.7细胞IL-1β生成的影响 根据标准曲线对待测样的OD 450nm值进行运算,得到各个重复样本的IL-1β浓度,各组比较结果见图10,LPS组RAW264.7细胞生成的IL-1β量显著高于空白对照组(P<0.01),而低浓度组(0.5 mg/mL)IL-1β生成量也显著高于空白对照组(P<0.05);三个浓度”三黄连”合剂组IL-1β生成量虽小于LPS组,但差异不显著(P>0.05)。
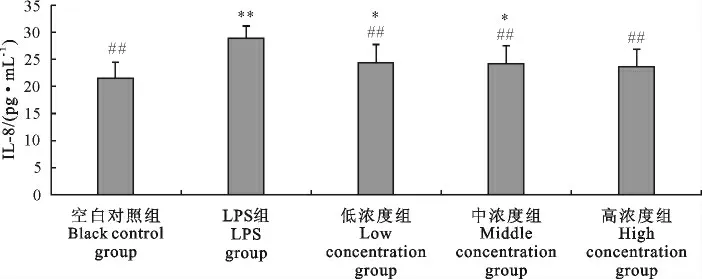
图8 “三黄连”合剂对RAW264.7细胞分泌IL-8的影响Fig.8 Effects of Chinese herbal compound“San Huang Lian”on IL-8secretion in RAW264.7cells
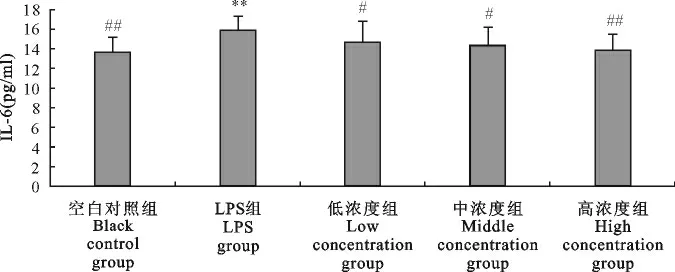
图9 “三黄连”合剂对RAW264.7细胞分泌IL-6的影响Fig.9 Effects of Chinese herbal compound“San Huang Lian”on IL-6secretion in RAW264.7cells
3 讨论
3.1 体内抗炎试验
二甲苯常用于小鼠耳廓肿胀模型的建立。将其涂抹于小鼠耳部,导致耳部毛细血管扩张、通透性增强,从而引起耳部水肿,诱发小鼠耳部炎症,是研究药物抗炎活性的常规方法之一。根据耳廓肿胀度及耳廓肿胀率可以判断出药物的抗炎效果。目前采用二甲苯致小鼠耳廓肿胀模型检测抗炎活性的药物以单味中药、中药生物活性成分及中药复方居多,现已有报道的有蒲公英提取物、新中兽药复方连藤、金银花、银翘药对、脑舒胶囊、黄芩苷等[10-13],均取得了良好的效果。在体内抗炎试验中,采用二甲苯致耳廓肿胀模型来检验“三黄连”的体内抗炎作用,“三黄连”合剂高、中剂量组小鼠的耳肿胀度和耳肿胀率均显著低于空白对照组(P<0.01),表现出极强的抗小鼠耳廓肿胀的作用,其中,高剂量组的抗炎效果甚至优于阳性对照药地塞米松的作用。
脏器指数是药理学和病理生理学研究的重要依据。脾脏和胸腺是机体的重要免疫器官,地塞米松可使小鼠的胸腺和脾脏萎缩,显著影响机体的免疫功能。对体内抗炎试验的小鼠进行剖检,小鼠的脏器均未见异常;统计分析肝脏、肾脏、脾脏和胸腺等脏器指数,结果表明,阳性对照组肝脏指数高于空白对照组,且差异极显著(P<0.01),表明地塞米松对肝脏有负面影响。而脾脏指数和胸腺指数则分别极显著或显著降低(P<0.01或P<0.05)。胸腺指数方面,除了中剂量组显著升高(P<0.05)外,其余各处理对胸腺指数均无显著差异(P>0.05)。地塞米松属于糖皮质激素类药物,具有极强的抗炎和免疫抑制作用,是临床非常常见的药物,但是长期大剂量使用又会引起不良反应,例如降低机体对病原体的抵抗力而诱发或加重感染、诱发皮质功能亢进综合征等[14],本试验中由于使用地塞米松剂量较大,甚至引起了小鼠胸腺和脾脏的萎缩。而“三黄连”合剂与地塞米松相比抗炎效果更好,不良反应少,对小鼠的免疫功能及肝、肾的解毒功能基本无影响。
3.2 体外抗炎试验
采用LPS刺激RAW264.7细胞作为炎症模型来研究“三黄连”合剂的体外抗炎作用。通过MTT 实验确定了“三黄连”合剂的安全浓度范围,即0.5 mg/mL~2.0mg/mL。NO 是机体重要的炎性介质,在炎症每个阶段都会产生并发挥重要的调节作用。研究表明[15],NO能够通过抑制NF-κB的激活从而发挥抗炎作用,而NO 在高浓度状态下可激活NF-κB,诱导促炎性细胞因子TNF-α和IL-1β的产生,并且这一过程还能形成正反馈,最终导致炎症反应愈加持久和剧烈,对机体造成严重的损伤,因此抑制NO 的合成能够使炎症症状得到改善。
TNF-α、IL-1β、IL-6和IL-8是炎症反应相关的细胞因子。TNF-α主要由LPS激活的单核-巨噬细胞分泌,在机体受到有害刺激最早期分泌,可反映炎症反应的强烈程度。有学者认为[16],TNF-α是急性胰腺炎(AP)炎症级联瀑布效应重要的始动环节,也可能是AP炎症过程中促使IL-6释放的重要因素。高浓度TNF-α可导致发热,放大炎症反应,引起组织损伤甚至致死性休克。在炎症、恶性肿瘤和创伤过程中TNF-α和IL-6的变化相似,都有显著增高的趋势,使得这三种疾病可能转换,加重炎症的发生[17]。IL-1β是由活化的巨噬细胞和其他多种组织细胞如树突状细胞、上皮细胞等产生的一种激素样多肽,在免疫调节和炎症反应中起到重要作用。它能够促进T 细胞和B细胞的增殖分化,对中性粒细胞、巨噬细胞、淋巴细胞有趋化和增强作用,还能够诱导IL-2、IL-6 和TNF等细胞因子的产生。IL-6是淋巴细胞和非淋巴细胞在刺激下产生的一种糖蛋白,通过诱导B淋巴细胞和T淋巴细胞增殖分化、刺激肝细胞产生急性期蛋白等方式参与炎症反应过程。IL-6水平过高或者持续时间过久对机体有害。研究表明IL-6能够通过增强中性粒细胞的功能和延长中性粒细胞的生命周期进而发挥炎症促进作用[18]。也有研究发现通过阻断IL-6信号传导可以有效治疗自身免疫性疾病和慢性炎症疾病例如炎性肠疾病模型、糖尿病和类风湿性关节炎等,因此“Anti-IL-6/Anti-IL-6R 治疗策略”成为目前治疗炎性疾病的新途径[19]。IL-8主要来源于单核细胞和内皮细胞,在炎症反应中能够趋化中性粒细胞、T淋巴细胞和嗜碱性粒细胞;中性粒细胞与IL-8接触后能够定位游走到反应部位并释放一系列活性产物,达到杀菌和损伤细胞的目的。体外试验表明[20],IL-8能与中性粒细胞结合,导致细胞的变形反应、呼吸暴发反应、释放溶酶体、形成超氧化物,从而促进炎症反应。
“三黄连”合剂主要由黄芩、连翘等组成,文献表明,这两种中药材及其主要活性成分在体外试验中表现出抑制炎症反应的作用。黄芩苷对LPS或者IFNγ刺激RAW264.7细胞产生的NO 水平升高具有抑制作用,其机制是通过抑制iNOS蛋白的表达,同时黄芩 苷 对 于LPS 刺 激 引 起RAW264.7 细 胞 中 的TNF-α升高具有抑制作用,且呈剂量依赖关系[21]。连翘能够降低LPS刺激下的细胞促炎性细胞因子的水平包括TNF-α、IL-1β和IL-6[22]。
体外抗炎试验中LPS刺激RAW264.7细胞产生NO量显著升高,而“三黄连”合剂处理后细胞生成的NO减少,表明“三黄连”合剂对炎症反应有抑制作用。LPS刺激RAW264.7细胞也使细胞中的促炎性细胞因子(TNF-α、IL-1β、IL-6和IL-8)水平极显著升高(P<0.01),“三黄连”合剂处理能够抑制这一过程,尤其是导致TNF-α、IL-6和IL-8水平极显著或显著的下降(P<0.01或P<0.05);虽然“三黄连”合剂处理后IL-1β水平下降,但与LPS组相比差异不显著(P>0.05),这可能跟“三黄连”合剂中连翘苷含量相对较少,未达到足够的浓度,而降低IL-1β的功能主要由连翘苷表现出来有关。
“三黄连”合剂(30、15、7.5mL/kg)对二甲苯致小鼠耳肿胀具有很好的抗炎作用,且对小鼠的脏器指数无影响。“三黄连”合剂在0.5mg/mL~2.0mg/mL浓度范围内对RAW264.7细胞无毒性,对LPS刺激的RAW264.7细胞中的NO、TNF-α、IL-6和IL-8的水平升高有抑制作用。“三黄连”合剂对于LPS诱导的RAW264.7细胞中的以上几种炎性介质和炎性细胞因子分泌的抑制作用可能与抑制其相应的基因表达有关,也可能是由于作用于上述炎症因子间的调节途径,阻断相关的通路,从而降低细胞培养上清液中的炎性介质和促炎性细胞因子的含量,减轻炎症反应。“三黄连”合剂成分复杂,抗炎机理还有待进一步研究,本研究结果为其应用于临床提供了参考。
[1] Chennamaneni S R,Mamalis C,Archer B,et al.Development of a novel bioerodible dexamethasone implant for uveitis and postoperative cataract inflammation[J].J Contro Rel,2013,167(1):53-59.
[2] Boskabady M H,Vahedi N,Amery S,et al.The effect of Nigellasativaalone,and in combination with dexamethasone,on tracheal muscle responsiveness and lung inflammation in sulfur mustard exposed guinea pigs[J].J Ethnopharmacol,2011,137(2):1028-1034.
[3] 林闽加,白建文,张斗霞,等.孟鲁司特和地塞米松对哮喘炎症的作用[J].上海交通大学学报:医学版,2008,28(1):61-65.
[4] 王 丽,徐 珽,唐 尧.199例地塞米松不良反应文献分析[J].中国医院药学杂志,2008,28(18):1623-1624.
[5] Yoon S B,Lee Y J,Park S K,et al.Anti-inflammatory effects of Scutellaria baicalensis water extract on LPS-activated RAW 264.7 macrophages[J].J Ethnopharmacol,2009,125(2):286-290.
[6] Li L,Bao H,Wu J,et al.Baicalin is anti-inflammatory in cigarette smoke-induced inflammatory modelsin vivoandin vitro:A possible role for HDAC2activity[J].Int Immunopharmacol,2012,13(1):15-22.
[7] Enk R,Ehehalt R,Graham J E,et al.Differential effect of Rhizoma coptidis and its main alkaloid compound berberine on TNF-αinduced NF-κB translocation in human keratinocytes[J].J Ethnopharmacol,2007,109(1):170-175.
[8] Choi Y Y,Kim M H,Cho I H,et al.Inhibitory effect of Coptis chinensis on inflammation in LPS-induced endotoxemia[J].J Ethnopharmacol,2013,149(2):506-512.
[9] 袁 健.致炎剂用量及保留时间与小鼠耳壳肿胀程度相关性研究[J].甘肃中医学院学报,2009,26(5):10-11.
[10] 质世伟,司宁宁,李 龙,等.连翘有效成分对炎症模型的作用[J].中兽医医药杂志,2012,31(1):16-19.
[11] 吴章怀,秦大莲,岳永花,等.脑舒胶囊对非特异性炎症模型的影响[J].泸州医学院学报,2009,32(4):353-355.
[12] 彭单伊,刘珠慧,程 晖,等.新鲜芦荟抗局部化学接触性皮肤炎症的作用[J].时珍国医国药,2011,22(1):189-191.
[13] 谢丽丽,赵灵颖,胡庭俊.中兽药复方“连藤”的抗炎作用及安全性评价[J].畜牧与饲料科学,2012(11):56-58.
[14] 成 兰.应用地塞米松的不良反应与注意事项[J].中原医刊,2002,29(11):48-49.
[15] 范精华,刘 康,刘保林.NO 在炎症及免疫应答中的调节作用[J].中外医疗,2009(25):163-163.
[16] 戴璩瑜,郑通标,许燕平.急性胰腺炎不同时期炎症因子的基因表达及意义[J].海南医学院学报,2012,18(9):1177-1180.
[17] 张喜平,程琪辉.恶性肿瘤,创伤及炎症患者血清TNF-α,IL-6和sIL-2R 含量的比较[J].陕西医学杂志,2002,31(1):19-21.
[18] 李 昕,刘佳佳.IL-6 对中性粒细胞在炎症中作用的影响[J].国外医学:免疫学分册,2006,28(5):277-280.
[19] Neurath M F,Finotto S.IL-6signaling in autoimmunity,chronic inflammation and inflammation-associated cancer[J].Cytokine Growth Factor Reviews,2011,22(2):83-89.
[20] 吴纪珍,齐 咏,马利军,等.IL-8和NF-κB在慢性阻塞性肺疾病缓解期气道炎症中的作用[J].中国实用内科杂志:临床前沿版,2006,26(5):752-754.
[21] Liu LL,Gong LK,Wang H,et al.Baicalin inhibits macrophage activation by lipopolysaccharide and protects mice from endotoxin shock[J].Biochem Pharmacol,2008,75(4):914-922.
[22] Zhong W T,Wu Y C,Xie X X,et al.Phillyrin attenuates LPS-induced pulmonary inflammation via suppression of MAPK and NF-κB activation in acute lung injury mice[J].Fitoterapia,2013,90:132-139.

