二氧化氯对草鱼池塘环境异养菌数量及区系组成的影响
郑宗林,王广军,郑曙明
(1.西南大学水产动物繁育和健康养殖研究中心,重庆荣昌402460;2.中国水产科学研究院珠江水产研究所,广东广州510380)
作为目前国际上公认的性能优越、效果良好、几 乎无残留的杀菌剂,二氧化氯(ClO2)已被世界卫生组织(WHO)列为了第4 代安全高效的消毒剂[1]。1983 年,美国的环保部门,食品药品管理部门(FDA)以及农林牧渔管理部门等先后批准二氧化氯可作为消毒剂在农业和畜牧业等领域使用[2]。目前,在国内水产养殖业中,二氧化氯作为治疗和预防疾病的消毒剂,因其对鱼、虾蟹、贝类等具有疗效好,毒性低,刺激性小,以及对水产动物致病菌以及芽胞等具有较强的杀灭能力等优点,已得到广泛应用[3]。相关报道主要集中于水产养殖经济动物疾病防治方面的探讨,如对鲢鱼、黄颡鱼鱼种、长薄鳅幼鱼、罗非鱼、黄鳝等的毒性试验,及对鲑科鱼类受精卵的影响等[2-5]。此外,还有对观赏鱼类,如锦鲤、血鹦鹉、孔雀鱼和月光鱼等报道[6-7]。然而,有关二氧化氯对草鱼疾病防治方面的研究鲜见深入报道[8]。有鉴于此,本文主要研究了二氧化氯在草鱼精养池中按不同剂量、不同方式施用后,探讨其对池塘中异养菌群的种类和数量变化情况方面的影响,以期为二氧化氯在水产养殖业中的大规模推广和应用提供科学的理论依据。
1 材料与方法
1.1 材料
1.1.1 试验用鱼及药品 试验用草鱼购自重庆市长寿区龙容宸水产养殖场,平均体重为(150.0g±2.6g),共计4 000尾。试验药品二氧化氯购买自山东兆冠药业有限公司,呈粉末状,稳定性二氧化氯含量维持在8%左右。
1.1.2 试验用饲料仪器 试验所用的饲料购自重庆市永川通威生产的全价沉性颗粒饲料,粗蛋白(CP)含量为28%。通用型采水器购自青岛聚创环保设备有限公司,底泥采集器为北京冠测精电仪器设备有限公司产品,VITEK-Ⅱ型全自动微生物分析系统购自上海枫岳商贸有限公司。
1.2 方法
1.2.1 试验设计 选择规格一致的草鱼共4 000尾,分别放入面积为1 000 m2的4口养殖池中,每口池塘放养1 000尾。水深维持在1.4m 左右,分别记为1#,2#,3#和4#。在1#池塘中中采用泼洒的方式添加3 750g/hm2的二氧化氯,在2#中采用挂带的方式添加3 750g/hm2的二氧化氯,在3#中采用泼洒的方式添加7 500g/hm2的二氧化氯,在4#中采用挂带的方式添加7 500g/hm2的二氧化氯。其中,泼洒为全池带水泼洒,挂袋为在食台和池塘四角使用纱布包裹悬挂水中30cm 水下,每10d施用1次;试验开始第1天,第10天和第20天共计施用3次。
1.2.2 试验周期及管理 试验从2014年6月22日开始,至2014年7月25日结束。试验开始前,先将草鱼暂养于池中3d后开展正式试验。试验持续时间共计30d。在试验期间每天早(8:00)、中(13:00)、晚(18:00)各投喂1次,每次的饲料投喂量占草鱼体重的4%~6%。
此外,在试验初(6月25日)、试验中(7月5日)和试验结束(7月25日)时,分别记录4个试验组的水质情况。直接测量每个鱼塘中的温度、溶氧。对带回实验室的水样,采用纳氏试剂比色法(GB 7479)测定水体中的氨氮情况。用碘量法(GB 7489)测定水中溶解氧的含量。采用N-(1-萘基)-乙二胺比色法(GB 13580.7)测定水体中的亚硝酸盐含量。采用酚二磺酸光度法(GB 7480)测定水体中硝酸盐氮的含量。水体中磷酸盐含量的测定使用离子色谱法(HJ669-2013)。
1.2.3 试验样品的采集和处理 水样采集的具体方法为:用通用型采水器在1#、2#、3#和4#池塘的3处不同位置分别采集表层水样,迅速放入已经灭菌的容量瓶中,盖好后带回实验室进行水样处理。用吸管从容量瓶中吸取1mL的水样,再加入9 mL的灭菌双蒸水进行稀释。再分别从4个试验组稀释后的水样中,吸取0.1mL,放置于培养基中进行涂布。其中,选择细菌数合适的稀释度平板,对水体中细菌数量进行观察和统计。
底泥采集的详细步骤:用底泥采集器在1#、2#、3#和4#池塘的3处不同位置分别采集底泥,迅速放入已灭菌的培养器皿中,并盖好带回实验室进行处理。用已消毒的刀片刮取约厚度为3cm 左右的底泥样,分别放入4个不同的研钵中磨碎。用天平量取1g左右的底泥样品,再加入9mL的灭菌双蒸水进行稀释。后续试验方案同水样处理方法。
1.2.4 试验用培养基的制备 本试验所采用培养基的详细配方为:硫酸镁0.05g,牛肉膏2.50g,氯化钠5.00g,磷酸氢二钾0.20g,葡萄糖1.00g,蛋白胨5.00g,酵母膏2.50g,琼脂粉15.00g。加水调至1 000mL,调pH 为7.2~7.4,在120℃高温灭菌30min即成。
1.2.5 细菌菌落的鉴定和计数
1.2.5.1 细菌菌落种类的鉴定 参照书籍《一般细菌常用鉴定方法》、《伯杰氏鉴定细菌学手册》制定需氧菌鉴定程序,按照鉴定程序进行鉴定;采用法国梅里埃公司VITEK-Ⅱ型全自动微生物分析系统和VITEK-ANA 厌氧菌鉴定板鉴定厌氧菌。
1.2.5.2 细菌菌落计数 细菌菌落的计数主要采用平板计数法。所用平板在27℃的恒温培养箱中培养48h。接着,对单克隆总数在30个~300个的平板进行有效计数,并以计数平板上的单克隆总数作为0.1mL稀释样品中的总活菌数。
1.2.5.3 细菌菌落多样性指数的计算 主要采用香农-威纳指数(Shannon-wiener index)用于细菌菌落多样性分析。以此来计算水体中细菌多样性指数,具体公式如下:
H=-∑PilnPi
其中,Pi为第i属细菌的种数与分离到的细菌总种数的比值,即Pi=ni/N;ni为第i 属细菌的种数;N 为分离到的细菌总数。
1.2.6 数据处理 采用SPSS 18.0for windows进行One-way ANOVA 分析和LSD 比较。结果以平均数±标准差(¯x±SD)表示。
2 结果
2.1 池塘水质理化因子和底泥总有机碳含量的测定
主要测定了水体中的温度、溶解氧(DO)、氨氮、硝态氮、亚硝态氮和磷酸盐含量,详细结果见表1。由于二氧化氯施用方式不同,1#~4#中,温度、溶解氧(DO)、氨氮、硝态氮、亚硝态氮和磷酸盐含量有显著的差异,各自呈现不同的变化趋势。其中,3#(二氧化氯的含量为7 500g/hm2,采用泼洒方式)的水体溶氧显著高于其余各组。氨氮、硝态氮、亚硝氮和磷酸盐指标均是3#最低,但氨氮、硝态氮、磷酸盐指标中3#与1#和4#相比均没有显著差异(P>0.05)。
2.2 草鱼精养池水体和底泥中总活菌数与气单胞菌的变化情况
2.2.1 草鱼精养池水体中总活菌数与气单胞菌的变化情况 草鱼精养池水体中细菌菌落总数的变化情况见图1,由图1可知,在整个试验周期过程中,由于二氧化氯浓度的不同以及不同泼洒方式的差异,池塘中水体菌落总数也存在较大差异。其中,2#的活菌总数在3次试验中均最高,但1#、3#和4#中异养菌数量差异不明显。水体中气单胞菌的数量变动趋势与总活菌数相似,呈现2#中气单胞菌数量最多。1#、3#和4#中气单胞菌数量低于2#,但彼此间差异不显著。

表1 试验塘水质理化因子及底泥总有机碳的含量Table 1 The physical and chemical factors of water and total organic carbon of sediment in test pond
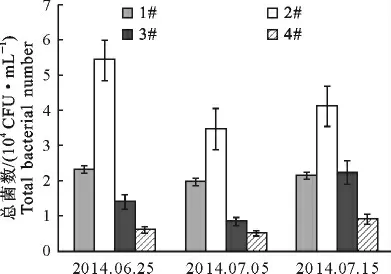
图1 二氧化氯对池塘水体活菌总数的影响Fig.1 Effects of chlorine dioxide on the total number of viable bacteria in the pond water
2.2.2 草鱼精养池底泥中总活菌数和气单胞菌属数量的变动 池塘底泥中总活菌数量的变动和气单胞菌属数量的变动分别见图3和图4。由图3和图4可知,底泥中总活菌数和气单胞菌的数量变动趋势和池塘中水体中总活菌数和气单胞菌的数量变化趋势类似。均表现为2#中气单胞菌数量最多。而1#、3#和4#中气单包菌数量低于2#,但彼此之间的差异仍不显著。

图2 二氧化氯对池塘水体气单胞菌菌数的影响Fig.2 Effects of chlorine dioxide on Aeromonas number in the pond water
2.3 草鱼精养池水体和底泥中异养菌的组成情况
草鱼精养池水体和底泥中异养菌细菌不同种类的组成情况见表3。由表3可知,在草鱼精养池水体中的主要异养菌主要有:气单胞菌属、黄单胞菌属、黄杆菌属、产碱杆菌属、假单胞菌属、肠杆菌属和变形菌属等。其中,假单胞菌、气单胞菌和肠杆菌是主要的优势菌种,而黄单胞菌属、黄杆菌属和产碱杆菌属等种类则出现较少。
在草鱼精养池底泥中的主要异养菌主要有:假单胞菌属、芽胞杆菌属、变形杆菌属、色杆菌属、黄杆菌属和肠杆菌属组成,其中芽胞杆菌和肠杆菌为池塘底泥中的优势异养菌。
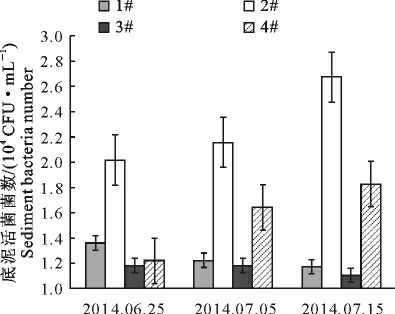
图3 二氧化氯对池塘底泥中总活菌菌数的影响Fig.3 Effects of chlorine dioxide on the total number of viable bacteria in the pond sediment
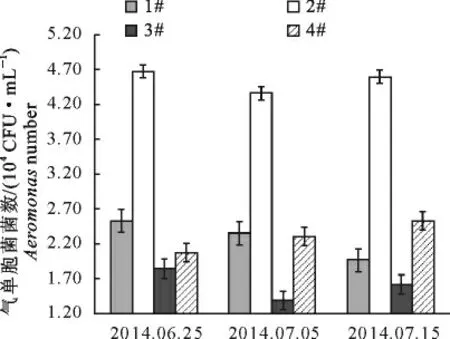
图4 二氧化氯对池塘底泥中气单胞菌菌数的影响Fig.4 Effects of chlorine dioxide on Aeromonas number in the pond sediment

表2 池塘中分离出细菌的种类和数量Table 2 Type and quantity of bacteria isolated from pond
2.4 草鱼精养塘中二氧化氯的不同使用方案对池塘水体和底泥中异养菌数量组成的影响
在草鱼精养池中添加不同剂量的二氧化氯后,水体中主要的菌群分别为气单胞菌、假单胞菌、肠杆菌和其他类型菌群。由图5可知在可辨别的细菌种类中,水体中气单胞菌的数量最多,其次为假单胞菌,肠杆菌的数量相对最少。其中,气单胞菌的比例维持在31%~38%之间,在2#中气单气单胞菌的数量最高,在4#中最低。假单胞菌在1#~4#中,含量均维持在20%左右,且各试验组见的差异不显著。肠杆菌的变化范围位于8%~17%之间。其中,在试验2#中的含量最低,为8%左右,而在3#中达到17%左右。
在草鱼精养池中添加二氧化氯后,底泥中主要的菌群为:芽胞杆菌和肠杆菌。具体变化趋势如图6所示。芽胞杆菌的含量位于35%~50%之间,其中,在2#中,芽胞杆菌含量达最低值,为35%左右,而在1#和3#中的含量相对较高,分别为49%和50%。肠杆菌的数量相对较低,位于10%~20%之间,在2#中肠杆菌含量最低,为10%左右,而在3#中含量最高,达20%。
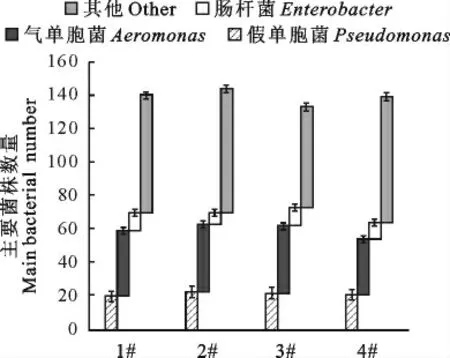
图5 二氧化氯对池塘水体菌株数量的影响Fig.5 Effects of chlorine dioxide on the number of strains in pond water
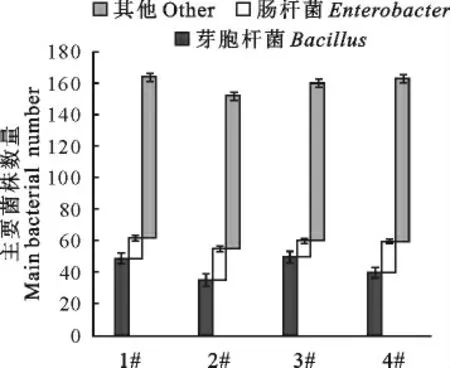
图6 二氧化氯对池塘底泥菌株数量的影响Fig.6 Effects of chlorine dioxide on the number of strains in sediment of pond
2.5 池塘水体和底泥中细菌群落多样性的分析
在草鱼精养池中添加不同剂量的二氧化氯后,池塘水体和底泥中细菌群落的多样性情况如图7所示。由图7可知,在4个二氧化氯的处理组中,试验2#无论是在水体中,还是底泥中的细菌群落多样性均最高,且底泥中细菌群落多样性显著高于水体(P<0.05)。而在其他试验组(1#、3#和4#)中,底泥中的群落多样性高于水体,但二者之间不存在显著性差异(P>0.05)。
3 讨论
3.1 二氧化氯对草鱼养殖水体中水质的影响
二氧化氯作为治疗和预防疾病的消毒剂,因其对鱼、虾蟹、贝类、蛙类等具有疗效好,毒性低,刺激性小,还可以改善水质状况,不伤害水体中浮游生物的丰度等特性,已在水产养殖生产中得到了广泛的应用[6-9]。在本试验中,3#(泼洒式添加,用量7 500 g/hm2)的水体溶氧显著高于其余各组,氨氮、硝态氮、亚硝氮和磷酸盐指标均是3#最低,表明在草鱼养殖水体中添加一定剂量的二氧化氯可增加水体中溶氧,降低水体中氨氮浓度,促进草鱼生长,究其原因在于二氧化氯是一种不稳定的化合物,在水中可分解成HClO2、Cl2和O2,增加养殖水体中氧气的浓度,澄清水体,沉淀悬浮物[10]。此外,还可对其中的藻类异养菌、铁细菌、硫酸盐还原菌等都有比较好的杀灭效果[11]。

图7 二氧化氯对池塘水体和底泥细菌多样性的影响Fig.7 Effects of chlorine dioxide on the pond water and sediment bacterial diversity
3.2 二氧化氯对草鱼养殖水体和底泥中异养菌数量变动的影响
二氧化氯作为第四代消毒杀菌剂相对于漂白粉、生石灰、高锰酸钾等传统消毒剂来说具有杀灭性强,使用剂量小,毒性消失快等优点[12]。在本试验中,无论是在养殖水体中,还是底泥中,1#(泼洒式添加,用量3 750g/hm2)和2#(挂袋式添加,用量3 750g/hm2)中异养菌的数量要高于3#(泼洒式添加,用量7 500g/hm2)和4#(挂袋式添加,用量7 500g/hm2),该结果表明,在草鱼养殖水体中,二氧化氯浓度的高低决定了水体中异养菌数量的多少。此外,挂袋式添加二氧化氯对养殖水体中异养菌数量的影响要小于泼洒式。这一结果与王丹生和朱庆红等的研究结果类似[13]。
3.3 二氧化氯对草鱼养殖水体和底泥中异养菌区系组成的影响
在本试验结果中,草鱼池塘水体中假单胞菌、气单胞菌和肠杆菌是主要优势菌,而其他的种类出现较少[14]。底泥异养菌中,芽胞杆菌和肠杆菌属优势菌。该结论与张峰峰等的研究结果类似[10]。此外,本研究中池塘水体和底泥中细菌群落多样性的分析结果显示,除4#外,水体中细菌群落的多样性指数显著低于底泥。而水体和底泥中细菌多样性指数在2#较高,原因在于二氧化氯分子外层具有一对未成对的活泼的自由电子,具有很强的氧化能力,能使微生物蛋白质中的氨基酸氧化分解,导致氨基酸链断链,蛋白质失去功能,从而使微生物死亡[2,13];抑制微生物蛋白质的合成,破坏微生物,达到迅速灭菌消毒作用[15]。而二氧化氯的在草鱼养殖水体中的最适添加量尚待深入探讨。
[1] 姚 琳,张守发,贾立军,等.猪附红细胞体有效消毒剂的体外初步筛选试验[J].动物医学进展,2011,32(9):122-125.
[2] Maranda L,Cox A M,Campbell R G,et al.Chlorine dioxide as a treatment for ballast water to control invasive species:Shipboard testing[J].Mar Pollut Bull,2013,75(1-2):76-89.
[3] 刘晓勇,张 颖,齐 茜,等.杂交鲟幼鱼对几种外用消毒药物敏感度的研究[J].水产学杂志,2011,24(3):10-15.
[4] 周 剑,杜 军,刘光迅,等.4种常用药物对长薄鳅幼鱼的急性毒性试验研究[J].西南农业学报,2012,25(5):1920-1924.
[5] 张铁奇,户 国,谷 伟,等.不同消毒剂对三种鲑科鱼受精卵成活率的影响[J].水产学杂志,2013,26(1):19-22.
[6] 朱庆红,李 莉,赵 昭.6种水产药物对金鱼苗的急性毒性试验[J].河南农业科学,2012,41(1):151-155.
[7] He S,Yin T,Zhen J,et al.Cross-linking of gelatin by chlorine dioxide steam[J].Food Hydrocolloids,2015,45(1):63-71.
[8] 李永刚,曾伟伟,王 庆,等.草鱼呼肠孤病毒分子生物学研究进展[J].动物医学进展,2013,34(4):97-103.
[9] Zeng Y,Fu X,Ren Z.The effects of residual chlorine on the behavioural responses of Daphnia magnain the early warning of drinking water accidental events[J].Procedia Environ Sci,2012,13(6):71-79.
[10] 张峰峰,谢凤行,周 可,等.常见水产药物对两种水产益生菌活性的影响[J].水产科学,2013,32(10):567-572.
[11] 李 华.水产养殖用水中氯含量测定条件的优化研究[J].中国水产,2013(2):67-69.
[12] 王丹生,李 娟,王 旭.6种常用渔药对团头鲂幼鱼的急性毒性试验[J].辽东学院学报:自然科学版,2011,18(2):145-149.
[13] Tanaka T,Shimoda M,Shionoiri N,et al.Electrochemical disinfection of fish pathogens in seawater without the production of a lethal concentration of chlorine using a flow reactor[J].J Biosci Bioeng,2013,116(4):480-484.
[14] 孔祥迪,陈 超,李炎璐,等.4种常用消毒药物对棕点石斑鱼(♀)×鞍带石斑鱼(♂)受精卵孵化的影响[J].渔业科学进展,2014,35(5):122-127.
[15] 季延滨,孙学亮,郭永军.3种渔药对血鹦鹉鱼苗的急性毒性效应[J].贵州农业科学,2014,42(5):154-157.

