牦牛Toll样受体8和9基因克隆及组织表达分析
黄 勇,兰道亮,陈亚冰,林宝山,黄 偲,李 键
(1.西南民族大学生命科学与技术学院,四川成都610041;2.西南民族大学青藏高原研究院,四川成都610041)
Janeway J C A 等[1]首次发现与果蝇同源的人的Toll蛋白,并命名为Toll 受体(Toll-like receptor,TLR),Toll样受体可识别广泛存在于病原体细胞表面的分子标志,即病原相关分子模式(pathogen associated molecular patterns,PAMPs),通过识别病原体及其产物,从而在病原体入侵机体的早期即启动天然免疫,提示其在抗感染中的重要作用。激活TLR 不仅可以诱导天然免疫应答,而且有利于特异性免疫反应的发生,在天然免疫与获得性免疫之间起桥梁作用。迄今为止,在哺乳动物已经发现了13种Toll样受体,即TLR1~13。
TLR9是哺乳动物细胞识别细菌和病毒DNA 中CpG(胞嘧啶-鸟嘌呤核苷酸)的主要受体,通过对CpG DNA的识别,最终引起Th1样炎症反应,从而诱导B细胞和树突状细胞(dendritic cells,DCs)功能性成熟,并刺激各种免疫细胞产生细胞因子和趋化因子[2]。TLR9不仅参与免疫系统“自己”与“非己”的识别,还与恶性肿瘤的发生和自身免疫紊乱相关[3]。TLR8主要识别单链RNA 和短链双股RNA,从而引起NF-κB介导的各种细胞因子释放,参与病毒感染[4-5]。Peng等研究发现,TLR8通过识别含聚鸟嘌呤的寡核苷酸或TLR的天然配体触发TLR8-MyD88-IRAK4 信号活化途径抑制Tregs 进而抑制肿瘤的发生与发展[6-7]。
目前,对牛、羊、猪、马等动物的TLR8、TLR9基因,已经有了比较深入的研究[8-10]。但是在牦牛上,对TLR8和TLR9两个基因的相关研究报道却很少,而牦牛作为高原特有古老物种,对高海拔地带低氧、缺草、严寒等恶劣条件具有良好适应能力,能够为牧民提供无可替代的生产资料以及生活资料,是高原畜牧业最重要的优势畜种。因此,本试验参考GenBank中牛TLR的CDS区序列设计特异性引物,用RT-PCR方法克隆牦牛TLR8、TLR9基因,并进行生物信息学分析,采用实时荧光定量PCR 技术构建这两个基因的组织表达谱,为进一步深入研究牦牛TLR8、9基因的功能提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物及取材 试验动物由成都市青白江区唐家寺向阳牛市屠宰场提供,属于麦洼牦牛(四川阿坝,海拔3 400m)。宰后立即采取心、肝、脾、肺、肾、胃、大肠、小肠、肌肉、卵巢、乳腺,均放入液氮中送回实验室,置-80℃保存备用。
1.1.2 主要试剂 Trizol购自Invitrogen公司;Taq DNA聚合酶购自天根公司;DNA片段回收纯化试剂盒购自AXYGEN 公司;PMD-19TVector、反转录试剂盒及SYBR Premix Ex TaqTMII试剂盒均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 RNA的提取和cDNA 合成 每100mg牦牛组织器官,加入1mL Trizol液氮研磨提取总RNA;采用Ferments公司的Revert AidTMFirst Strand cDNA Synthesis Kit进行反转录反应,采用20μL体系:Oligo dT181μL,5×Reaction buffer 4μL,RibolockTMRNase Inhibitor 1μL,10 mmol/L dNTP Mix 2μL,Reverse Transcriptase 1μL,模板2μg,最后用RNase Free dH2O补足20μL,按以下程序进行反转录反应:42 ℃60min;70℃5min,合成cDNA,置-20℃保存。
1.2.2 引物设计与合成 根据GenBank提供的野牦牛TLR8(登录号:XM-005891027.1)和牛TLR9(登录号:NM-183081.1)基因的CDS序列及与人、绵羊等相应序列的同源性比对结果,利用Primer Premier 5.0软件设计2对引物(A1、A2)对牦牛TLR8基因进行分段扩增,2对引物(B1、B2)对牦牛TLR9基因进行分段扩增。根据克隆所得序列再设计2对引物(A、B)分别用于TLR8和TLR9基因的荧光定量PCR 分析。内参引物根据β-actin序列设计(表1)。所有引物由上海Invitrogen公司合成。
1.2.3 目的基因的克隆 牦牛脾脏组织cDNA 为模板,进行PCR全长扩增。采用25μL反应体系,反应条件:95 ℃5min;94 ℃45s,56 ℃45s,72 ℃1.5 min,32个循环;72 ℃5min。PCR 产物经10g/L琼脂糖凝胶电泳查看扩增结果,Axygen凝胶回收试剂盒回收纯化目的产物。将PCR 产物连接pMD19-T载体,转化DH5α感受态细胞并在Amp+琼脂平板上涂板,37℃培养后挑选单菌落,菌液PCR 鉴定后,将阳性重组质粒送往Invitrogen(上海)公司进行测序。
1.2.4 目的基因的组织表达谱分析 采用实时荧光定量PCR法检测牦牛TLR8和TLR9 两个基因在不同组织的相对表达量。试验重复3次,反应体系为15μL:SYBR Premix Ex TaqTMII(TaKaRa 公司)7.5 μL,上、下游引物各0.5μL,cDNA 1μL,dH2O 5.5 μL。PCR反应条件:95℃30s;95℃5s,60℃30s,72℃20s,39个循环;反应在Bio-Rad公司荧光定量PCR仪上进行。以β-actin基因作为内参,采用2-ΔΔCt法计算目的基因的相对表达量。
1.2.5 生物信息学分析 PCR 扩增获得的TLR8、9基因序列,拼接获得cDNA 全长序列;蛋白质的基本二级结构及结构域分析采用SMART在线网站预测;并用DNA Star软件、MEGA5.0软件及一些在线软件对所得序列进行生物信息学的相关分析。

表1 本试验中用到的引物Table 1 Primers used in the study
2 结果
2.1 目的基因的克隆与鉴定
以牦牛脾脏组织总RNA 逆转录获得的cDNA为模板,以上引物均获得了特异性较好的PCR产物,大小和理论预期一致(图1)。PCR产物经克隆、测序和序列拼接后,分别获得了3 102bp(GenBank登录号为KM359140)和3 090bp(GenBank 登录号为KM359141)的cDNA序列。
2.2 序列分析
利用EXPASY服务器分析发现,TLR8蛋白理论分子质量为118.28ku,等电点为5.88,含有108个带负电荷的氨基酸(D和E),91个带正电荷的氨基酸(R和K),其不稳定系数为39.98;TLR9蛋白理论分子质量为115.45ku,等电点为9.04,其中带负电荷的氨基酸(D 和E)有82个,带正电荷的氨基酸(D 和E)101个,不稳定系数为44.17。利用在线分析程序SMART(http://smart.embl-heidelberg.de/)对 蛋 白保守结构域进行分析表明,牦牛TLR8具有1个跨膜结构域、多个LRRs功能域、1个LRRCT、1个胞内区TIR结构域、1个低复杂度区,TLR9具有多个胞外LRR域、1个胞内区TIR结构域、1个低复杂度区(图2)。
根据GenBank 公 布 的TLR8 和TLR9CDS 序列,利用DNAStar子程序MegAlign分别进行多序列同源性比对以及采用NJ法分别建立牦牛与其他动物的遗传进化树。发现牦牛TLR8基因的CDS区与野牦牛、黄牛和绵羊之间的CDS序列的同源性都很高,分别为99.9%、98.2%和97.6%;TLR9基因的CDS区与野牦牛、黄牛和绵羊的CDS序列同源性很高,分别是99.2%、99.2%和95.9%。进一步的进化树分析显示,牦牛TLR8、9与野牦牛的亲缘关系最近,与大鼠和小鼠较远(图3)。
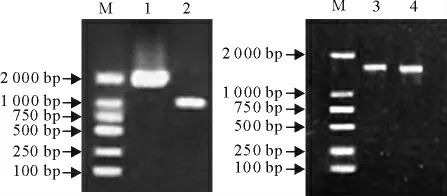
图1 TLR8、9基因的扩增产物电泳图Fig.1 Electrophoresis of PCR products of TLR8and TLR9genes
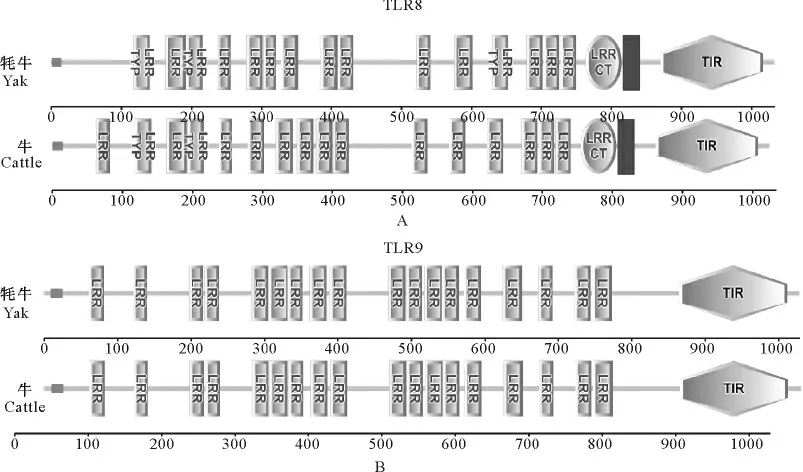
图2 牦牛与牛的TLR8(A)和TLR9(B)蛋白质分子结构分析与比较Fig.2 Analysis and comparison of the molecular structures of TLR8(A)and TLR9(B)proteins between yak and cattle
2.3 目的基因的组织表达谱
结果显示,2个基因在各组织中均有表达,均在肾中的表达量最高。然而两者也存在组织间表达差异,TLR8在肝、脾、肺、小肠、卵巢、乳腺等组织中也有较高表达,而在心、胃、大肠、肌肉中表达量较低;TLR9在心、肝、脾、肺、小肠、卵巢、乳腺中较高表达,在胃、大肠及肌肉中的表达量最低(图4)。
3 讨论
本研究以牦牛为试验材料,成功的克隆出牦牛TLR8、9两个基因cDNA 序列,其编码区序列长度分别为3 102bp和3 090bp,理论编码1 033和1 029个氨基酸。利用Expasy在线程序分析,根据分析结果TLR8与TLR9蛋白的GRAVY 值分别为-0.133、-0.011,预测两者均为亲水蛋白;根据不稳定系数推测,TLR8、TLR9蛋白结构均含有不稳定区域,这些不稳定区域可能与受体或配体的结合相关。构建核苷酸系统进化树分析可知,这两个基因的核苷酸系统发育树与生物进化的物种树及动物分类学观点基本一致,说明这两个基因编码区具有高度保守性。通过对蛋白结构域的预测可知,牦牛TLR8、9具有数个不同胞外LRRs。分别对比牦牛与牛的TLR8、TLR9蛋白功能结构域的排布方式(图2),可以看出,牦牛与牛的TLR9蛋白大小、结构域排列方式几乎一致,提示TLR9在机体天然免疫中具有重要作用,且在生物进化过程中很保守;而牦牛与牛的TLR8蛋白大小相近,结构域排布方式相似,但仍存在一定差异,这种分子结构的差异是否是造成牦牛与牛之间天然免疫能力不同的原因,还需进一步研究。

图3 TLR8(A)和TLR9(B)的核苷酸序列遗传进化树Fig.3 Phylogenetic tree of TLR8(A)and TLR9(B)gene sequences
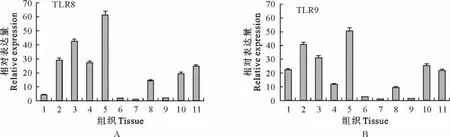
图4 牦牛TLR8(A)和TLR9(B)基因的组织表达谱Fig.4 The tissue expression profile of yak TLR8(A)and TLR9(B)at mRNA level
本试验采用SYBR GreenⅠ荧光嵌合染料方法检测了牦牛体内TLR 转录水平,并以内参基因β-actin作为校准,采用相对定量方法测定目的基因mRNA表达量,保证了数据的准确性又提高了试验效率。本试验结果显示,TLR8、9基因在牦牛所测组织中均有表达,均高表达于肝、脾、肺等组织,而在肾脏中表达最高,提示二者可能与肾脏免疫有密切联系。Kimura J等[11]研究发现,小鼠自身免疫性肾炎的肾小球中,Toll样受体(TLR1、2、7、8、9、和13)及其NF-κB途径下游因子(IL1β,IL-6,和TNFα)表达均上调。Liu L等[12]指出在多重感染脓毒症模型中肾细胞的凋亡与急性肾损伤都依赖于TLR9。另外,这两个基因在小肠、乳腺以及与生殖相关的卵巢中具有较高表达水平。Mantini Y 等[13]研究发现,在大鼠小肠内,由绒毛柱状上皮细胞的膜Toll样受体和腺上皮细胞的可溶性Toll样受体组成的细菌配体识别系统,可能有助于宿主防御机制选择性清除革兰阳性菌而不清除革兰阴性菌。Karki K 等[14]发现恶性乳腺癌患者血清中,TLR9的表达随着疾病进程较良性患者显著减少,而氧化应激标记物的表达成反比,说明TLR9可以作为氧化相关分子模式的传感器,和识别低分化肿瘤的生物标记物,TLR9还可能是炎症、氧化损伤和乳腺癌之间的关键连接点。Tadeuchi T 等[15]报道了小鼠阴道TLR8、9 与妊娠维持有关,在妊娠末期TLR9mRNA 表达显著下降,而TLR8几乎没有变化。以上报道说明TLR8、9基因很可能在牦牛常见的肠道疾病以及生殖系统疾病的发生发展过程中发挥重要作用,为进一步解决牦牛及高原动物腹泻,生殖疾病导致繁殖能力低下等难题提供了新的思路。
[1] Janeway J C A,Medzhitov R.Innate immune recognition[J].Annu Rev Immunol,2002,20:197-216.
[2] Klaschik S,Gursel I,Dennis M,Klinman.CpG-mediated changes in gene expression in murine spleen cells identified by micro-array analysis[J].Mol Immunol,2007,44:1095-1104.
[3] Barton G M,Kagan J C,Medzhitov R.Intracellular localization of Toll-like receptor 9prevents recognition of self DNA but facilitate access to vital DNA[J].Nature Immunol,2006,7:49-56.
[4] Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11:373-384.
[5] Thompson M R,Kaminski J J,Kurt-Jones E A,et al.Pattern recognition receptors and the innate immune response to viral infection[J].Viruses,2011,3(6):920-940.
[6] 李立辉.Toll样受体8及其免疫学功能研究进展[J].免疫学杂志,2010,26(10):913-915.
[7] Peng G Y,Guo Z,Kiniwa Y,et al.Toll-like receptor 8mediated reversal of CD4+regulatory T cell function[J].Science,2005,309(26):1380-1384.
[8] McGuire K,Jones M,Werling D,et al.Radiation hybrid mapping of all 10characterized bovine Toll-like receptors[J].Anim Genet,2006,37:47-50.
[9] Raja A,Vignesh A R,Mary B A,et al.Sequence analysis of Tolllike receptor genes 1-10of goat(Capra hircus)[J].Vet Immunol Immunopathol,2011,140(3-4):252-258.
[10] 王光华,马利青.Toll样受体在家畜繁殖性疾病中的作用[J].中国畜禽种业,2014,1:68-70.
[11] Kimura J,Ichii O,Miyazono K,et al.Overexpression of Tolllike receptor 8correlates with the progression of podocyte injury in murine autoimmune glomerulonephritis[J].Sci Rep,2014,4:7290.
[12] Liu L,Li Y,Hu Z,et al.Small interfering RNA targeting Tolllike receptor 9protects mice against polymicrobial septic acute kidney injury[J].Nephron Exp Nephrol,2012,122(1-2):51-61.
[13] Mantini Y,Yokoo Y,Kamezaki A,et al.Immunohistochemical detection of toll-like receptor-2,-4and-9in exocrine glands associated with rat alimentary tract[J].J Vet Med Sci,2012,74(11):1429-1438.
[14] Karki K,Pande D,Negi R,et al.Expression of serum toll-like receptor 9and oxidative damage markers in benign and malignant breast diseases[J].DNA Cell Biol,2014,33(9):630-636.
[15] Takeuchi T,Yoshida M,Shimizu T,et al.Differential expressions of toll-like receptor genes in the vagina of pregnant mice[J].J Vet Med Sci,2013,75(5):561-565.

