马流产沙门菌fimY 基因同源性分析及蛋白表达
王世民,王彩蝶,张艳楠,苏 艳(.新疆农业大学动物医学学院,新疆乌鲁木齐83005;.新疆农业大学食品科学与药学学院,新疆乌鲁木齐83005)
马流产沙门菌fimY 基因同源性分析及蛋白表达
王世民1,王彩蝶1,张艳楠2,苏艳1
(1.新疆农业大学动物医学学院,新疆乌鲁木齐830052;2.新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052)
摘 要:为对马群中沙门菌进行快速、准确检测,根据GenBank公布的沙门菌菌毛蛋白fimY基因为模板设计一对特异性引物,用PCR方法扩增fimY部分基因。将fimY目的基因亚克隆至PGEX-4T-2原核表达载体,转入BL21(DE3)感受态细胞后用IPTG进行诱导表达,并对目的蛋白进行反应性检测。结果表明,克隆fimY基因大小为490bp;成功构建fimY原核表达载体PGEX-fimY,经SDS-PAGE显示带有GST标签的目的蛋白大小为47ku,与预期相符;Western blot证明,目的蛋白fimY能够结合沙门菌标准阳性血清,为建立马流产沙门菌间接ELISA检测方法奠定了基础。
关键词:马流产沙门菌;fimY;抗原性;同源性
沙门菌血清型繁多,耐药性较为普遍,能够感染人和多种动物,对人类健康及畜牧业养殖造成很大危害[1-2]。但马流产沙门菌(Salmonella abortus equi)只感染马属动物,具有高度专嗜性,对其他动物无致病性[3]。马流产沙门菌主要危害孕马和幼驹,引起孕马流产、幼驹心肌炎等症状,马群感染后会迅速传播、流产率可达100%,对养马业造成很大的经济损失,严重阻碍了养马业的发展。目前对细菌性马流产的诊断标准依旧为传统血清凝集试验,该试验敏感性和准确性不高,试验周期长,结果判断有很大的主观性,已远远不能适应现代养马业的发展,需研究一种新方法来适应现代养马业的发展[4-7]。
到目前为止,还不能够在公开数据库检索到马流产沙门菌基因组序列等相关信息,这无疑给该菌检测方法的研究增添了困难。与马流产沙门菌相比较,食源性沙门菌和其他畜禽沙门菌检测方法研究的都较为深入。伍燕华等建立了双抗体夹心ELISA检测沙门菌方法[8],张艳红等总结食源性沙门菌诊断方法中提到沙门菌ELISA检测方法已逐步走向应用的趋势等[9],曹恬雪等对沙门菌相关毒力因子做了总结[10],其中,fimY基因为沙门菌菌毛亚单位的调控基因,对菌毛发育起到很重要的调节作用[11-12]。本试验通过已发表的鼠伤寒沙门菌fimY基因模板设计特异性引物“猎取”马流产沙门菌fimY部分基因,构建原核表达载体并对诱导蛋白进行抗原性分析,为建立马流产沙门菌间接ELISA检测方法奠定试验基础。
1 材料与方法
1.1材料
1.1.1菌株及培养基 马流产沙门菌(CVCC514)购自中国农业微生物菌种保藏管理中心;牛心汤培养基、氯化镁孔雀绿增菌液(MM)、缓冲蛋白胨水(BPW)、SS琼脂购自杭州天和微生物试剂有限公司。1.1.2 主要试剂及仪器 LA Taq DNA酶、BamHⅠ内切酶、XhoⅠ内切酶、T4DNA连接酶、DNA标准DL 2 000,蛋白质分子质量标准(低)均购自宝生物工程大连有限公司;PM Western Midview、DNA产物回收试剂盒均购自北京康为世纪生物科技有限公司;质粒提取试剂盒购自OMEGA公司;DH5α、BL21(DE3)感受态细胞菌购自天根生化科技(北京)有限公司;沙门菌标准阳性血清购自中国兽医药品监察所;辣根过氧化物酶标记的羊抗马二抗购自美国Proteintech公司;其他常规试剂为进口或国产分析纯产品。PCR仪为美国Bio-Rad Mycycler;电转仪为Bio-Rad Trams blot小型转印槽。
1.2方法
1.2.1引物设计 根据GenBank发表的鼠伤寒沙门菌fimY序列(GI:332986951),用Oligo 6.0设计特异性引物,并用生物软件DNA Man对引物进行评价,引物序列下划线部分分别为BamHⅠ和XhoⅠ酶切位点,fimY F:5′-AT GGATCCAGTCACTACTTATTTTCCGG-3′,fimY R:5′-TTCTCGAGAGAGGGTGATA-AGTTGTTTAAGCCG-3′,由上海生工生物工程技术服务有限公司合成。
1.2.2DNA模板的制备 用生理盐水重悬离心收集对数期细菌,反复3次,沸水浴10min,1 200r/min离心2min,收集上清,以该处理样品做为PCR模板。
1.2.3PCR扩增目的基因 PCR反应体系为25 μL:10×LA PCR buffer 2.5μL,2.5mmol dNTP 2.5 μL,上、下游引物各10nmol,菌液模板0.5μL,LA Taq酶0.2μL,灭菌去离子水17.3μL。PCR反应条件:95℃5min;95℃30s,55℃30s,72℃50s,35个循环;72℃5min。PCR产物经PCR纯化试剂盒进行纯化回收,纯化产物置-20℃保存待用。另送PCR样品由上海生工生物工程技术服务有限公司进行测序,并对测序结果进行对比分析。
1.2.4fimY部分基因原核表达载体构建 将PGEX-4T-2空载质粒和PCR产物纯化后分别进行BamHⅠ/XhoⅠ双酶切,37℃3h;酶切后对酶切产物进行20g/L琼脂糖凝胶电泳,并对目的条带进行胶回收。将PGEX4T-2空载及PCR回收产物按照摩尔数1∶3比例进行连接,16℃,过夜;连接产物转化DH5α感受态细胞,涂布于氨苄抗性的LB固体培养基上培养12h。对阳性克隆菌落提取质粒,经PCR方法鉴定阳性质粒由上海生工生物工程技术服务有限公司进行测序,测序正确后命名PGEX-fimY质粒。
1.2.5目的蛋白诱导表达 将PGEX-fimY转入BL21(DE3)后,筛选阳性克隆,方法同上。将PGEX-fimY阳性克隆接种于氨苄抗性的液体LB培养基中,37℃、200r/min培养过夜。将过夜培养的菌液按10 mL/L比例接种于新鲜氨苄抗性的LB液体培养基中,37℃、200r/min进行培养,待菌液OD600nm值达到0.6左右时,加入终浓度0.4mmol/L的IPTG进行诱导表达,继续培养6h后收集菌,同时设未经IPTG诱导的重组菌做对照组。
1.2.6SDS-PAGE电泳 对诱导及未诱导菌测量OD600nm值,两种菌各吸取1mL,1 200r/min离心2min,收集细菌。加入体积为(50×OD600nm)μL的PBS重悬,加入相应体积5×SDS loading buffer混匀,沸水浴15min后,8 000r/min离心2 min。取10μL各样品于150g/L聚丙烯酰胺凝胶中电泳,80V电压电泳30min后,120V电压电泳2h。配方见分子生物学试验指导。
1.2.7Western blot检测 配制150g/L聚丙烯酰胺凝胶,待胶凝固后,每孔加入20μL处理样品(方法同上),10μL PM Western Midview标准分子质量,电泳后将带有样品蛋白的凝胶电转至硝酸纤维素膜(NC膜)上,恒流0.3A,转移时间1h。将NC膜置于50g/L脱脂奶粉中4℃封闭过夜;将完成封闭的NC膜放入PBS稀释的标准阳性血清(1∶1 000稀释)中37℃孵育1h;用PBS对NC膜清洗5次,每次5min;用PBS稀释的酶标二抗(1∶2 000稀释)对NC膜进行第2次孵育,37℃,1h;用PBS 对NC膜清洗5次,每次5min;DAB显色液进行显色。
2 结果
2.1目的基因扩增结果
以稀释马流产沙门菌菌液作为PCR模板,其产物经15g/L的琼脂糖凝胶电泳,扩增出490bp左右的目的基因片段(图1)与预期大小相符。
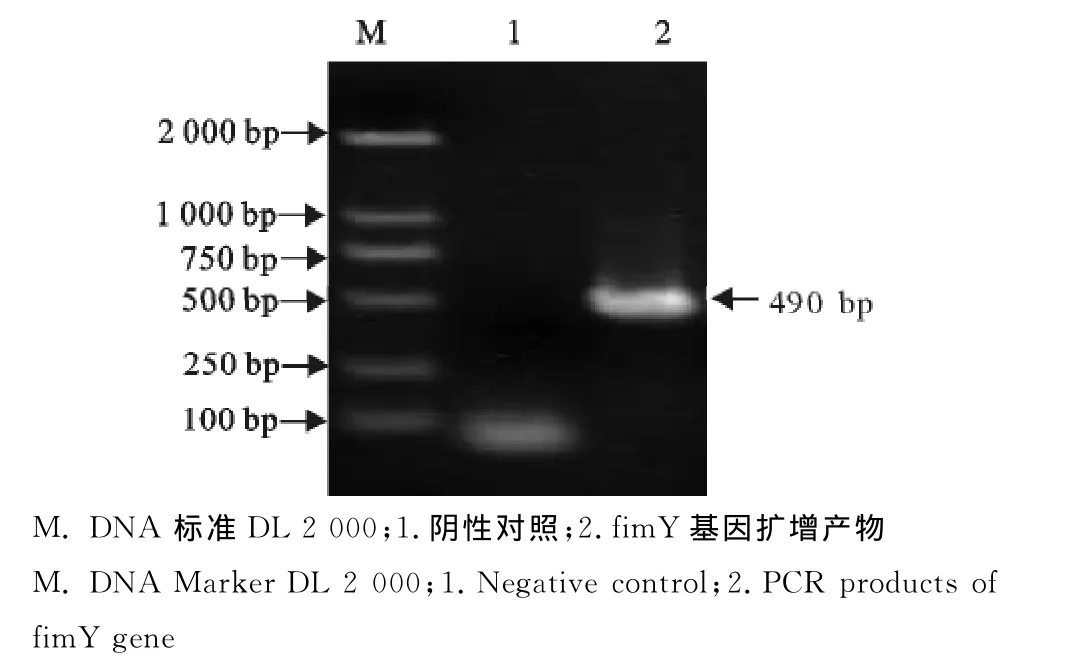
图1 fimY基因扩增结果Fig.1 Amplification result of fimY gene
2.2马流产沙门菌fimY基因测序结果PCR产物测序结果见图2。

图2 PCR产物测序结果Fig.2 Sequencing results of PCR product
2.3马流产沙门菌fimY基因序列分析结果
马流产沙门菌fimY序列Blast结果共得到39株沙门菌和一株枸橼酸杆菌,选择差异性较大的17株不同血清型菌株的fimY序列及枸橼酸杆菌基因进行同源性分析,分别为UK-1株(GI:332986951)、08-1736株(GI:523821078)、CFSAN000189株(GI:523811606)、CFSAN002069株(GI:523802116)、CT_02021853株(GI:197936256)、SL483株(GI:197211055)、CVM19633株(GI:194709404)、SL254株(GI:194400866)、SPB7株(GI:161361677)、ATCC 9150株(GI:56126533)、CFSAN002050株(GI:523815970)、CFSAN001992株(GI:151908558)、P125109株(GI:206707319)、CT18株(GI:30407157)2007-60-3289-1株(GI:320084732)、SC-B67(GI:62126203)、S06004株(GI:529190224),分析结果显示,马流产沙门菌fimY序列与17株其他沙门菌血清型fimY序列同源性为98.0%~99.8%;与枸橼酸杆菌ATCC BAA-895株(GI:157081501)同源性为64.4%(图3)。
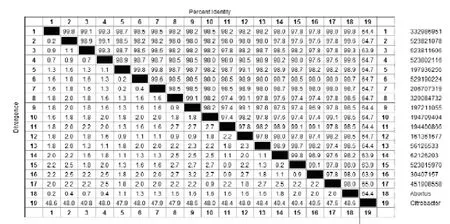
图3 马流产沙门菌fimY序列同源性分析结果Fig.3 Sequence homology analysis result of abortus equine SalmonellafimY
2.4PGEX-fimY质粒蛋白诱导表达结果
对诱导菌及对照菌处理后,用150g/L SDSPAGE分离胶进行电泳,与阴性对照相比,在47ku附近出现明显条带(图4)。
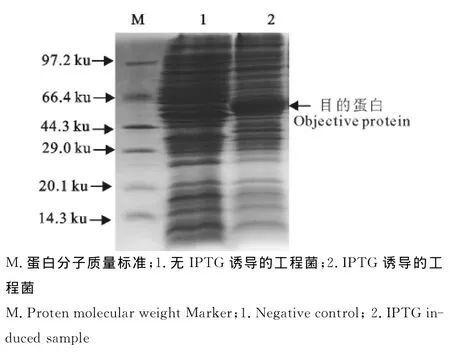
图4 诱导表达产物SDS-PAGE结果Fig.4 SDS-PAGE results of induced products
2.5Western blot检测结果
在Western blot结果中,在目的蛋白预期大小位置出现条带(图5)。证实标准马流产沙门菌阳性血清能够与fimY蛋白结合。
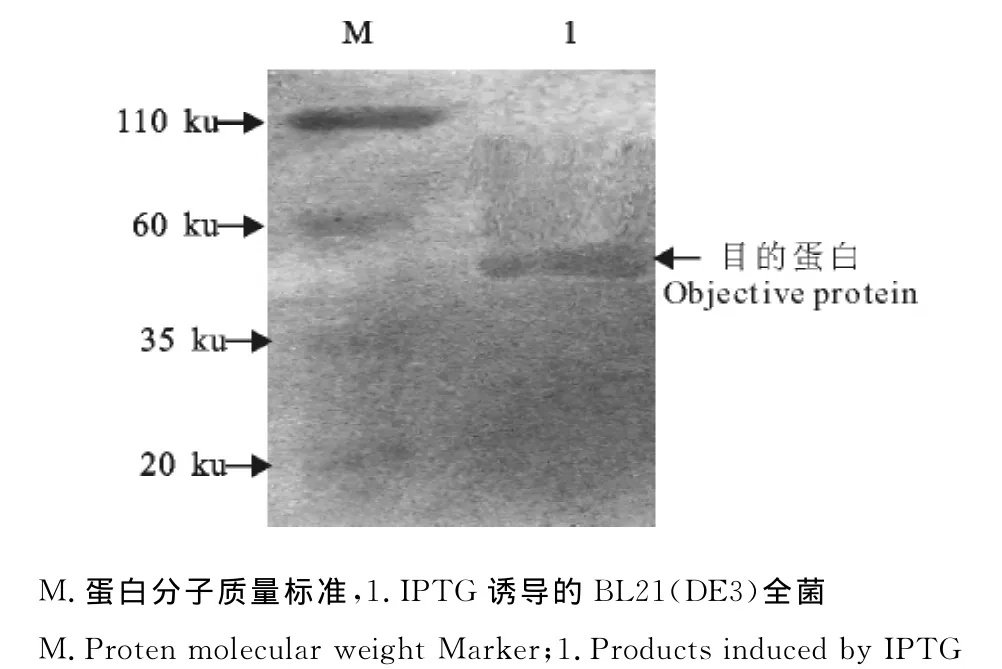
图5 fimY蛋白Western blot检测结果Fig.5 Western blot analysis of fimY protein
3 讨论
马流产对养马产业造成很大的经济损失,其中细菌性马流产危害较为严重。细菌性马流产主要由马流产沙门菌和鼠伤寒沙门菌引起。其中,马流产沙门菌为专嗜性沙门菌,只感染马属动物,对其他宿主动物无致病性;而鼠伤寒沙门菌宿主范围较广,致病性较强,是重要的人畜致病菌。能够造成马属动物流产的该两种菌血清型不同,传统凝集试验的检测结果很容易造成假阴性,试验结果具有一定的片面性。因此,亟需研究一种更准确、快速的诊断方法以适应目前我国养马业的持续发展所带来的挑战。
致病性沙门菌吸附和侵入宿主肠上皮细胞的过程中,菌毛起到重要作用[13-14]。fimY基因是沙门菌I型菌毛调控调控基因,具有很好的保守性[15]。本试验克隆的马流产沙门菌fimY基因通过序列对比分析发现与已公布的其他血清型沙门菌同源性高于98%,从而证实了马流产沙门菌fimY基因也具有很好的保守性;与其他非沙门菌同源性低于64.4%(同源性最高的非沙门菌是枸橼酸杆菌),说明马流产沙门菌fimY基因具有较强种属特异性;通过Westetn blot试验表明该蛋白能够结合标准马流产沙门菌阳性血清,说明该蛋白具有良好的反应原性。本试验为马流产沙门菌ELISA方法的建立奠定了基础。
参考文献:
[1] 李兰波,张秀峰,李 艳,等.沙门氏菌耐药性及耐药性消除研究进展[J].山东畜牧兽医,2013(11):72-74.
[2] 佘 容,刘耀敏,杜雪莉,等.饲料及其原料中沙门氏菌的分离鉴定和耐药分析[J].中国畜牧兽医,2013(12):204-207.
[3] 邢 涛.家畜常见的沙门氏菌简介[J].养殖与饲料,2009(1):20-21.
[4] 李佳桐,王 楠,金贞爱,等.沙门氏菌LAMP检测方法的建立[J].中国畜牧兽医,2014(3):91-94.
[5] 李 超,陈晓珑,李 莹,等.沙门氏菌快速检测显色培养基的研制[J].河南工业大学学报:自然科学版,2014(1):60-63.
[6] 房 芳,敬思群,李锦丰,等.一种沙门氏菌化学发光酶免疫分析方法的建立[J].食品科技,2014(8):281-286.
[7] 郑秋月,赵彤彤,袁慕云,等.实时荧光PCR检测食品中丙型副伤寒沙门氏菌和猪霍乱沙门氏菌[J].食品科技,2014(2):297-301.
[8] 伍燕华,牛瑞江,赖卫华,等.双抗夹心酶联免疫吸附法检测沙门氏菌[J].食品工业科技,2014(10):62-65.
[9] 张艳红,吴延功,杜元钊,等.沙门氏菌快速检测方法研究进展[J].动物医学进展,2001,22(2):39-41,48.
[10] 曹恬雪,蒋文灿,何文成,等.沙门氏菌毒力因子的研究进展[J].中国预防兽医学报,2014(4):331-334.
[11] 焦新安,刘秀梵.沙门氏菌柔毛研究进展[J].动物医学进展,1998,19(2):7-10.
[12] 陈小玲,李永清,孙慧玲.沙门氏菌fimY基因的原核表达及禽沙门氏菌抗体检测ELISA研究[J].中国家禽,2012,34 (13):18-22.
[13] Baxter A,Jone B.The fimYZ genes regulate Salmonella enterica serovar typhimuriuminvasion in addition to type 1 fimbrial expression and bacterial motility[J].Infect Immun,2005(5):1377-1385.
[14] 段小丽,董立伟,张江英,等.肠炎沙门氏菌SEF14菌毛单克隆抗体的制备及初步应用[J].上海畜牧兽医通讯,2013(1):2-6.
[15] Saini S,Pearl J A .Role of fimW,fimY,and fimZ in regulating the expression of type I fimbriae in Salmonella enterica serovar typhimurium[J].Bacteriology,2009,(5):3003-3010.
Homology Analysis and Expression of Gene fimY of Salmonella abortus equine
WANG Shi-min1,WANG Cai-die1,ZHANG Yan-nan2,SU Yan1
(1.College of Veterinary Medicine,Xinjiang Agricultural University,Urumqi,Xinjiang,830052,China;2.College of Food Science and Pharmacy,Xinjiang Agricultural University,Urumqi,Xinjiang,830052,China)
Abstract:To survey Salmonellainfection in horse herd quickly and accurately,apair of specific primers were designed according to published fimY sequence of Salmonellain GenBank,and the gene coding partial fimY was amplified by PCR.The gene was subcloned into the prokaryotic expression vector PGEX-4T-2to construct the plasmid and then transfected it into BL21(DE3)competent cells.The positive clone was induced by IPTG to express objective protein.The reactogenicity of objective protein was also detected by Western blot.The results showed that fimY gene coding 490bp was cloned;the prokaryotic expression vector PGEX-fimY was constructed successfully,the molecular weight of GST-tagged objective protein detected by SDS-PAGE was 47ku,and agreed with expectation;the protein can react with standard Salmonella positive serum,which was clarified by Western blot.The study laid the foundation for establishment of an indirect ELISA for detecting Salmonellainfection in equines.
Key words:Salmonella abortus equi;fimY;antigenicity;homology
作者简介:王世民(1986-),男,河北衡水人,硕士,讲师,主要从事兽医微生物学及免疫学研究。
基金项目:新疆农业大学前期资助项目(XJAU201214)
收稿日期:2014-12-04
中图分类号:S852.612
文献标识码:A
文章编号:1007-5038(2015)06-0039-04
——麦芽糖复合物抗原性的影响

