聚乙二醇修饰对牛乳β-乳球蛋白抗原性的影响
蔡小飞,钟俊桢,刘成梅*,刘 伟,徐雨佳,罗舜菁
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
聚乙二醇修饰对牛乳β-乳球蛋白抗原性的影响
蔡小飞,钟俊桢,刘成梅*,刘 伟,徐雨佳,罗舜菁
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
通过不同修饰反应物质的量比、修饰反应时间、pH值,用单甲氧基聚乙二醇琥珀酰亚胺酯(SC-mPEG)对牛乳β-乳球蛋白(β-LG)进行修饰,研究其抗原性的变化。利用间接竞争ELISA检测结合产物的抗原性,结果显示不同条件下PEG修饰后的β-乳球蛋白的抗原性最高降低率,反应8h时为70.2%。三硝基苯磺酸(TNBS)法测定不同条件反应后样品修饰度,反应8h时最高修饰度为39.1%。结果表明修饰反应时间为SC-mPEG修饰β-LG后其抗原性降低的主要因素。
β-乳球蛋白;聚乙二醇;ELISA;抗原性
β-乳球蛋白(β-LG)是乳清蛋白中的主要蛋白质,约占乳清蛋白总量的43.6%~50%,分子质量约为18kD[1]。β-LG含有人体多种必需氨基酸,具有结合视黄醇及部分脂肪酸等功能[2],是一种优质蛋白质。然而,它又是牛乳中最主要的过敏源之一,82%的牛乳过敏患者对牛乳β-LG产生过敏反应[3]。目前用于消除β-LG抗原性的方法有热处理[4]、酶水解[5]、高压结合热处理[6]、糖基化[7]等。
近年来采用聚乙二醇(PEG)修饰蛋白质改性已被广泛使用。胰蛋白酶[8]、脂肪酶[9-10]以及过氧化物酶[11]经PEG修饰后热稳定性显著增强;Zhang等[12]报道胰蛋白酶经硝基苯甲酸酯活化的聚乙二醇修饰后更加稳定;Kazan等[13]报道大肠杆菌青霉素酰化酶经PEG修饰后其活性增强20倍。Abuchowski等[14]研究PEG修饰牛血清白蛋白发现,其消除或降低抗原性效果明显。目前已获美国食品和药物管理局(FDA)批准上市的PEG修饰的多种蛋白质类药物被用于生物医药领域,用来降低蛋白质类药物的免疫原性、降低毒副作用、延长血浆半衰期等[15]。此外,PEG本身免疫原性极弱,通常在PEG修饰物免疫的动物血清中检测不到特异性的抗PEG抗体[16],因而避免引入新的过敏源。
本研究以PEG修饰β-LG,应用间接竞争ELISA法测定其抗原性的变化,为开发有效的、切实可行的降低β-LG抗原性方法提供依据。
1 材料与方法
1.1 材料与试剂
日本大白兔,8周龄,雄性,体质量约为3kg,饲养于江西省实验动物质量检测站。
牛乳β-乳球蛋白、猪源的明胶、羊抗兔酶标二抗、三硝基苯磺酸(TNBS) 美国Sigma公司;弗氏完全佐剂、弗氏不完全佐剂 上海生工生物工程技术服务有限公司;单甲氧基聚乙二醇琥珀酰亚胺酯(SC-mPEG,纯度95%,20kD) 北京四环科技开发有限公司;酶标板 美国Corning公司;其余试剂均为分析纯。
1.2 仪器与设备
Multiskan MK3酶标仪 美国Thermo公司;AR224CN电子天平 上海奥豪斯仪器有限公司;DELTA 320 pH计 瑞士Mettler公司;DU640紫外分光光度计美国Beckman公司。
1.3 方法
1.3.1 多抗的制备与效价检测
1.3.1.1 抗体的制备
选取2只日本大白兔,分别编号为1和2,所选白兔喂养的食物中确保不含牛乳蛋白。喂养一周无异常后,采血制备阴性血清。然后开始免疫,用牛乳β-乳球蛋白纯品免疫。免疫动物所用的佐剂为弗氏完全佐剂和弗氏不完全佐剂,采用的免疫途径为皮下多点注射方式,抗原免疫所需剂量为每只兔子1mg/mL,每两周免疫一次,共免疫4次[17]。
每隔二周实时检测抗体效价。动脉取血后,将采集的血清先倾斜置于室温放置0.5h,让其凝血,然后4℃冰箱放置过夜。翌日,4000r/min离心3min,分离血清,分装后,ˉ2 0℃冻存备用。
1.3.1.2 间接ELISA法测定抗体效价
根据李欣等[18]的方法,具体操作步骤如下:1)包被:采用96孔酶标板,每孔加入的2.5μg/mL包被抗原100μL,4℃过夜。2)洗涤:恢复至室温,倾去包被液,每孔加PBST 300μL洗涤3次,每次5min,扣干。3)封阻:每孔加250μL 1%的明胶作为封阻液,37℃保温保湿1h,恢复至室温,倾去封阻液,PBST满孔洗涤3次,每次5min,扣干。4)加待测血清:每孔加入100μL用PBS倍比稀释的抗血清和阴性血清,同时设置空白对照(加PBS),37℃保温保湿1h后,用PBST洗涤3次,扣干。5)加酶标二抗:每孔加入100μL 1:50 00稀释的辣根过氧化物酶(HRP)标记羊抗兔IgG酶标二抗,37℃保温保湿1h后,以PBST洗涤3次,扣干。6)显色:每孔加入反应底物100μL,37℃保温避光反应15min。7)终止反应:每孔加入50μL 2mol/L的H2SO4终止反应。8)比色:450nm波长处测吸光度。以P/N>2,且P>0.2时抗血清的最大稀释倍数为抗血清效价,其中P为阳性血清的OD450nm,N为阴性血清的OD450nm。
1.3.2 SC-mPEG修饰β-LG[19]
1.3.2.1 反应溶液的pH值对修饰产物的影响
4℃于β-LG溶液中按物质的量比1: 4加入SC-mPEG,反应pH值分别为6.0、7.0、7.5、8.0,反应12h后,8%冰醋酸终止反应,分别取样测定抗原性与修饰度。
1.3.2.2 反应时间对修饰产物的影响
pH6.0、4℃于β-LG溶液中按物质的量比1:4加入SC-mPEG,反应时间分别为4、8、12、16、24h,8%冰醋酸终止反应,分别取样测定抗原性与修饰度。
1.3.2.3 物质的量比对修饰产物的影响
β-LG和SC-mPEG的物质的量比分别设为1: 2、1: 3、1:4、1:5、1:6,反应溶液的pH6.0,反应温度为4℃。反应12h后,用8%冰醋酸终止反应,分别取样测定抗原性与修饰度。
1.3.3 间接竞争ELISA测定SC-mPEG修饰β-LG产物的抗原性
采用Kleber等[20]的方法,经包被、洗涤、封阻、加多抗与竞争抗原、加酶标二抗、显色、终止反应、比色的步骤。其中加多抗与竞争抗原为:竞争抗原(即检测样:修饰后样品与β-LG)50μL与50μL稀释的抗血清加入包被有抗原的孔板内反应12h后,设置无竞争对照孔(PBS代替竞争抗原)。按照公式(1)计算抗原性降低率[21]。

式中:A为被测物用酶标仪在450nm波长处所测吸光度。
1.3.4 TNBS法测定修饰度
采用三硝基苯磺酸法[22],取0.25mL样品、2mL pH8.0磷酸缓冲溶液与2mL 0.1% TNBS溶液混合,在50℃暗室中反应60min。反应完毕后,用4mL 0.1mol/L HCl终止反应。室温下放置30min后,于340nm波长处测其吸光度。按照β-LG的标准曲线计算未修饰蛋白含量。按着公式(2)计算修饰度。

2 结果与分析
2.1 免疫反应的效价变化
采用间接ELISA法测定免疫动物抗体效价的变化。由图1可知,多克隆抗体的制备方案可以得到高效价特异性抗体,当免疫到第7周时抗体的效价都有明显上升。由于实验动物自身的免疫能力差异,兔1的抗体效价要高于兔2的。兔1的效价最高,约达1:2×105以上,符合实验需要,本实验均采用兔1的抗体。

图1 免疫过程中抗血清效价的变化Fig.1 Change in antiserum titer during immunization
2.2 修饰条件对修饰度的影响
TNBS法得到β-LG修饰度的标准曲线,线性回归方程为y=0.1151x+0.0127(R2=0.9931),式中y为340nm波长处所测吸光度,x为β-LG的浓度。将所测样品的吸光度代入标准曲线方程进行计算,得到未修饰蛋白含量,总蛋白含量为PEG修饰前β-LG含量,再按照公式(2)计算得到修饰度如图2所示。
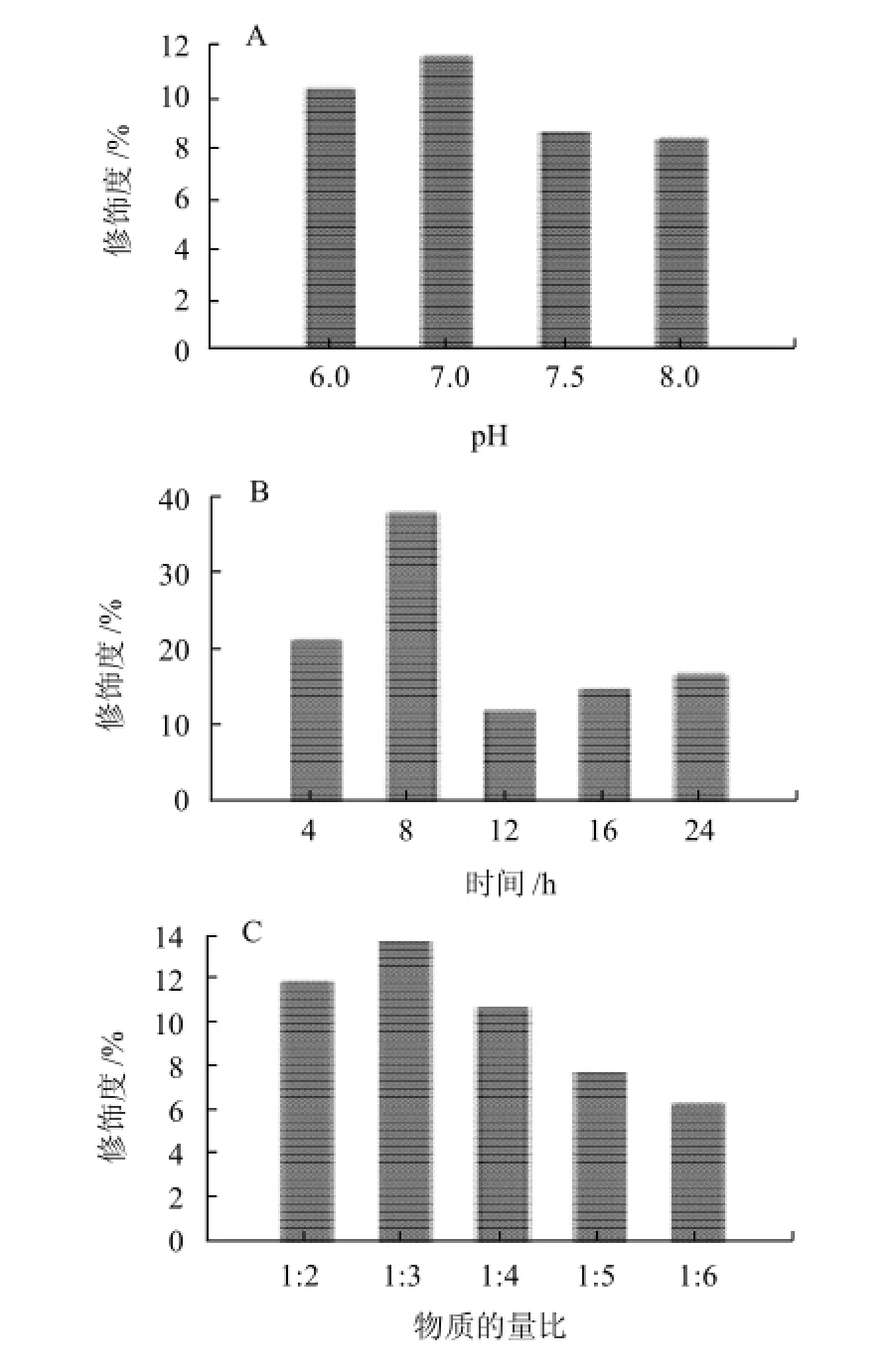
图2 不同反应条件对β-LG修饰度的影响Fig.2 Effects of different conditions on the modification degree of β-LG
修饰度是PEG修饰蛋白质研究中的一项重要指标。由图2可知,在其他条件相同的情况下,pH值对修饰度的影响不大,其中pH7.0时修饰度为最大11.5%;时间对修饰度的影响非常明显,8h达最大值38%;物质的量比对修饰度的影响不大,β-LG与SC-mPEG物质的量比1:3时,修饰度最大,达到13.7%。因此,在PEG修饰β-LG中,时间对修饰度的影响效果最为明显。
2.3 反应条件对对修饰产物抗原性的影响
2.3.1 反应pH值对修饰产物抗原性的影响
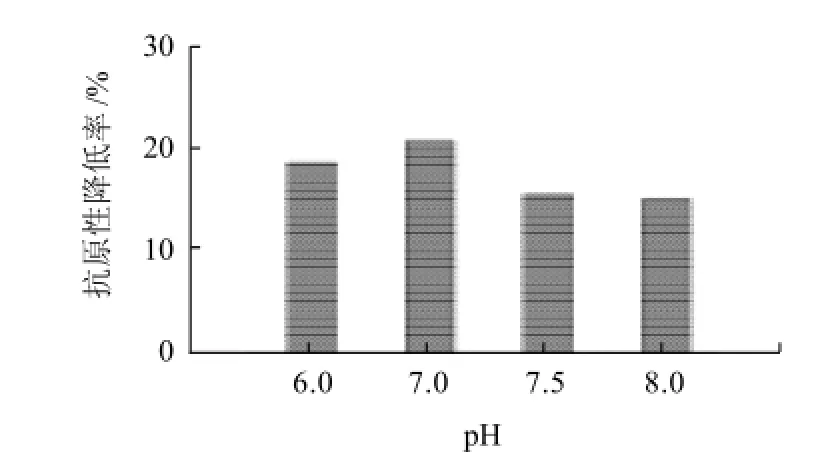
图3 反应pH值对修饰产物抗原性的影响Fig.3 Effect of reaction pH on the antigenicity of PEG-modified products
由图3可知,在其他条件相同的情况下,反应pH值对修饰产物抗原性有一定的影响,但变化范围不大,随着反应pH值的增加,修饰产物抗原性降低率呈现先增大后减小的趋势,在pH7.0时抗原性降低率最高为20.6%,此时的修饰度最大为11.5%。
2.3.2 反应时间对修饰产物抗原性的影响

图4 反应时间对修饰产物抗原性的影响Fig.4 Effect of reaction time on the antigenicity of PEG-modified products
由图4可知,在其他条件相同的情况下,反应时间对修饰产物抗原性影响非常明显,随着反应时间的延长,修饰产物抗原性降低率呈现先增大后减小再增大的趋势,在8h时抗原性降低率(68.3%)为最高,而此时的修饰度为38.0%,因而修饰度越高的条件下抗原性降低率也越高。PEG修饰过程中可能对赖氨酸等氨基酸的修饰将部分或全部地掩盖表面抗原决定簇,从而降低免疫原性。
2.3.3 物质的量比对修饰产物抗原性的影响
由图5可知,在其他条件相同的情况下,修饰反应物质的量比对修饰产物的抗原性有一定的影响,随着反应中PEG的增加,修饰产物抗原性降低率呈现先增大后减小的趋势。在β-LG和SC-mPEG物质的量比为1:3时抗原性降低率为最高24.7%,此时修饰度为最大13.7%,说明物质的量比为1:3时可能掩盖β-LG表面抗原决定簇部分最多而导致抗原性降低率最高。随着PEG的增加,β-LG抗原性降低率下降,可能是PEG增加蛋白的溶解性[23],蛋白质发生交联反应,使得隐藏在分子内部的抗原表位暴露出来,而交联反应的β-LG阻止了PEG与其进行反应,修饰度也随着降低。
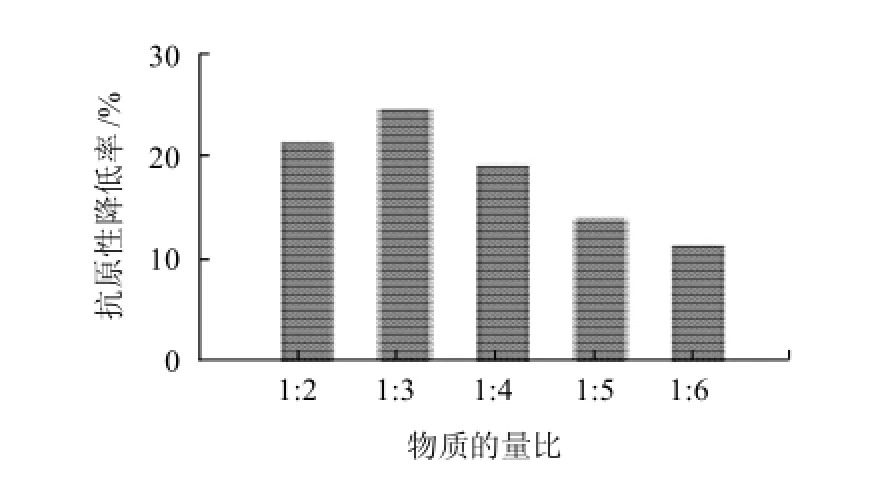
图5 物质的量比对修饰产物抗原性的影响Fig.5 Effect of molar ratio on the antigenicity of PEG-modified products
综上,可以得出PEG修饰β-LG的最佳反应条件为pH7.0、反应时间8h、β-LG与SC-mPEG物质的量比1:3。通过实验可以得到此时的抗原性降低率为70.2%,修饰度为39.1%。
3 结 论
PEG修饰β-LG反应中,体系修饰中物质的量比、反应时间、pH值是影响修饰度和抗原性的重要因素,而时间对抗原性降低率的影响效果最大。最佳反应条件即pH7.0、反应时间8h、β-LG与SC-mPEG物质的量比1:3时的抗原性降低率为70.2%,修饰度为39.1%。
[1]章玉涛. 牛奶中β-乳球蛋白的生物学活性及其影响因素[J]. 中国奶牛, 2010(2): 43-45.
[2]HATTORI M, NUMAMOTO K, KOBAYASHI K, et al. Functional changes in beta-lactoglobulin by conjugation with cationic saccharides [J]. J Agric Food Chem, 2000, 48(6): 2050-2056.
[3]AOKI T, ISKANDAR S, YOSHIDA T, et al. Reduced immunogenicity of beta-lactoglobulin by conjugating with chitosan[J]. Biosci Biotechnol Biochem, 2006, 70(10): 2349-2356.
[4]FOEGEDING E A, DAVIS J P, DOUCET D. Advances in modifying and understanding whey protein functionality[J]. Food Science & Technology, 2002, 13(5): 151-159.
[5]WROBLEWSKA B, KARAMACM, AMAROWICZ R, et al. Immunoreactive properties of peptide fractions of cow whey milk proteins after enzymatic hydrolysis[J]. International Journal of Food Science and Technology, 2004, 39(8): 839-850.
[6]ZHONG Junzhen, LIU Chengmei, LIU Wei, et al. Effect of dynamic high-pressure microfluidization at different temperatures on the antigenic response of bovine β-lactoglobulin[J]. Eur Food Res Technol, 2011, doi: 10.1007/s00217-011-1500-2.
[7]HATTORI M, MIYAKAWA S, OHAMA Y. Reduced immunogenicity of beta-lactoglobulin by conjugation with acidic oligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2004, 52(14): 4546-4553.
[8]GAERTNER H F, PUIGSERVER A J. Increased activity and stability of poly(ethylene glycol)- modified trypsin[J]. Enzyme Microb Technol, 1992, 14(2): 150-155.
[9]ROCHA J M S, GIL M H, GARCIA F A P. Effect of additives on the activity of a covalently immobilised lipase in organic media[J]. J Biotechnol, 1998, 66(1): 61-67.
[10]HERNAIZ M J, SANCHEZ-MONTERO J M, SINISTERRA J V. Modification of purified lipases from Candida rugosa with polyethylene glycol: a systematic study[J]. Enzyme Microb Technol, 1999, 24(3): 181-190.
[11]GARCIA D, ORTEGA F, MARTY J L. Kinetics of thermal inactivation of horseradish peroxidase: stabilizing effect of methoxypoly (ethylene glycol)[J]. Biotechnol Appl Biochem, 1998, 27: 49-54.
[12]ZHANG Ziding, HE Zhimin, GUAN Guoqiang. Thermal stability and thermodynamic analysis of native and methoxypolyethylene glycol modified trypsin[J]. Biotech Tech, 1999, 13(11): 781-786.
[13]KAZAN D, ERARSLAN A. Stabilization of Escherichia coli penicillin G acylaseby polyethylene glycols against thermal inactivation[J]. Appl Biochem Biotechnol, 1997, 62(1): 1-13.
[14]ABUCHOWSKI A, van ES T, PALCZUK N C, et al. Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol[J]. J Biol Chem, 1977, 252(11): 3578-3581.
[15]徐静. 聚乙二醇修饰蛋白质类药物的研究现状及展望[J]. 国外医学:预防诊断治疗用生物制品分册, 2004, 27(2): 75-78.
[16]ABUCHOWSKI A, MCCOY J R, PALCUK N C, et al. Effect of covalent attachment of polyethylene glycol on immunogenicity and circulating life of bovine liver catalase[J]. Biological Chem, 1977, 252 (11): 3582-3586.
[17]ADDOU B S, TOME D, KHEROUA O, et al. Parenteral immunization to beta-lactoglobulin modifies the intestinal structure and mucosal electrical parameters in rabbite[J]. Int Immunopharmacol, 2004, 4(12): 1559-1563.
[18]李欣, 文学方, 武涌, 等. 食物过敏源水牛乳β-乳球蛋白的交叉反应研究[J]. 食品工业科技, 2010, 31(8): 149-153.
[19]孙居锋, 李洪娟, 菅晓娟. 聚乙二醇修饰牛血红蛋白作为红细胞代用品的条件优化和产物检测[J]. 中国药房, 2008, 19(31): 2419-2422.
[20]KLEBER N, KRAUSE I, ILLGNER S, et al. The antigenic response of β-lactoglobulin is modulated by thermally induced aggregation[J]. Eur Food Res Technol, 2004, 219(2): 105-110.
[21]沈小琴, 郑海, 罗永康. 酶解对乳清蛋白抗原性影响的研究[J]. 中国乳品工业, 2006, 34(6): 12-15.
[22]SPELLMAN D, MCEOVY E, CUINN G O, el al. Proteinase and exopeptidase hydrolysis of whey protein:comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis[J]. International Dairy Journal, 2003, 13: 447-453.
[23]黄河. PEG修饰蛋白质等高分子[J]. 化学推进剂与高分子材料, 2004, 2(5): 18-22.
Effect of PEG Modification on Antigenicity of β-Lactoglobulin
CAI Xiao-fei,ZHONG Jun-zhen,LIU Cheng-mei*,LIU Wei,XU Yu-jia,LUO Shun-jing
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
β-Lactoglobulin (β-LG) was modified by suecinimidyl carbonate methoxy polyethlene glycol (SC-mPEG) under different conditions of molar ratio, reaction time and pH. The change of its antigenicity was also studied. Indirect competitive ELISA was used to detect the antigenicity of the SC-mPEG-β-LG mixture. The results indicated that the highest reduction rate of antigenicity for modified products under different conditions was 70.2% at the reaction time of 8 h and at the same time, the highest modification degree detected by TNBS was 39.1%. Meanwhile, reaction time was the major factor affecting antigenicity reduction of β-LG modified by SC-mPEG.
β-lactoglobulin;polyethylene glycol;ELISA; antigenicity
Q816
A
1002-6630(2011)17-0234-04
2011-06-20
国家自然科学基金项目(31071573);教育部博士点基金项目(20103601110002);国家重点实验室目标导向项目(SKLF-MB-201004)
蔡小飞(1985—),男,硕士研究生,研究方向为食品卫生与安全。E-mail:feishh@yahoo.com.cn
*通信作者:刘成梅(1963—),男,教授,博士,研究方向为食品高新技术。E-mail:chengmeiliu@yahoo.com.cn

