罗非鱼皮Ⅰ型胶原蛋白 的抗原反应特性分析
张静怡,吴文惠,王南平,何 兰,Elango JEEVITHAN,包 斌,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 2013 06;3.上海市水产研究所,上海 200433)
罗非鱼皮Ⅰ型胶原蛋白 的抗原反应特性分析
张静怡1,吴文惠2,王南平3,何 兰3,Elango JEEVITHAN1,包 斌1,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 2013 06;3.上海市水产研究所,上海 200433)
摘 要:目的:确定罗非鱼皮Ⅰ型胶原蛋白的抗原性,为进一步研究罗非鱼皮Ⅰ型胶原蛋白生物相容性提供依据。方法:采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)对分离提取的罗非鱼皮胶原蛋白进行鉴定,共免疫ICR小鼠3 次。采用酶联免疫吸附反应(enzyme linked immune sorbent assay,ELISA)分别于每次免疫后第7天测定小鼠产生的总胶原蛋白抗体,并在第21天测定小鼠血清中内免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(IgA)和免疫球蛋白M(IgM)的含量。结果:罗非鱼皮胶原蛋白样品是Ⅰ型胶原蛋白。所有经罗非鱼皮Ⅰ型胶原蛋白免疫的小鼠体内均产生抗体,3 次免疫后罗非鱼皮Ⅰ型胶原蛋白抗体质量浓度范围为160.50~164.25 μg/L,小鼠IgG、IgA和IgM的质量浓度范围分别为424.81~437.59 ng/mL、46.86~49.53 μg/mL、1.81~1.89 ng/mL。结论:罗非鱼皮Ⅰ型胶原蛋白对ICR小鼠呈现较弱的抗原性。
关键词:胶原蛋白;免疫;酶联免疫吸附反应;抗原性
胶原蛋白作为哺乳动物体内含量最丰富的蛋白质,约占体内蛋白总量的25%~33%,并且在组成细胞间质过程中起重要作用[1-2]。胶原蛋白广泛存在于动物的皮、骨、软骨、牙齿、肌腱、韧带和血管中,具有支撑器官、保护机体的重要作用[3]。胶原蛋白三螺旋结构,由2 条α1多肽链和1 条α2多肽链组成,3 条α肽链交互缠绕形成了绳索状的超螺旋结构[4]。每一条胶原链都是左手螺旋构型,3 条左手螺旋链相互缠绕成右手螺旋结构,形成胶原蛋白独特的三重螺旋结构,使其分子结构非常稳定[5]。胶原蛋白具有良好的生物相容性、可生物降解性和生物活性[6]。因此,胶原蛋白在食品、医药、组织工程、化妆品等领域获得广泛的关注,胶原蛋白的生产与开发具有很好的前景[7]。
长期以来,人们都是使用猪、牛的皮和骨提取胶原蛋白和明胶。但疯牛病、口蹄疫等疾病的爆发,对牲畜胶原制品的安全性产生了影响[8-10]。另外,有些地区由于其他人文原因不能使用牲畜胶原蛋白制品。由此,鱼类胶原蛋白逐渐成为了研究热点[11]。我国水产资源丰富,鱼类胶原蛋白属天然生物再生资源,可以作为一种新型的生物医学材料广泛应用[6,12-13]。与陆生动物胶原蛋白相比,鱼类胶原蛋白具有许多独特优势。而罗非鱼是一种分布广泛、产量较高的鱼类品种,被认为是未来动物性蛋白的主要来源之一,近年来逐步受到重视。
然而,鱼类胶原蛋白的安全性仍然是关键问题。抗体是在宿主对抗原刺激的免疫应答过程中,由淋巴细胞产生的一类能够特异性识别 并中和相应抗原的具有免疫功能的球蛋白。抗原性是抗 原刺激机体产生免疫应答的能力。抗原性作为生物材料安全性的关键因素,其强弱与抗原分子的大小、化学成分、抗原决定簇的结构、抗原与被免疫动物亲缘关系的远近等有密切关系。胶原蛋白的分子质量较大,在应用于生物材料过程中可能会产生抗原性问题。胶原蛋白对于宿主是异物,在体内必定会产生某种应答或出现排异现象[14-15]。如果要成功植入胶原蛋白,至少要使发生的免疫反应被宿主接受,不产生有害作用。而被免疫的动物会通过特异 性和非特异性的免疫防御机制来维持机体的正常功能及自身内环境的稳定。因此,进行罗非 鱼皮Ⅰ型胶原蛋白抗原性的检测是十分必要的。通过测定被免疫动物血清中的抗体含量,评价其免疫状况,对判断罗非鱼皮Ⅰ型胶原蛋白生物相容性具有重要意义。
Song等[16]为了研究水母胶原蛋白是否会产生类似牛胶原蛋白或明胶引起的炎症反应,进行了体内植入实验,测定了促炎细胞因子和抗体分泌物的表达并检测了免疫细胞的数量变化情况。结果显示水母胶原蛋白可以引起与牛胶原蛋白和明胶类似的免疫反应。本实验以ICR小鼠作为动物模型,采用酶联免疫吸附反应分析测定罗非鱼皮Ⅰ型胶原蛋白诱导小鼠产生抗体的特性及其相关指标的变化特点[17],从而确定罗非鱼皮Ⅰ型胶原蛋白的抗原性强弱,以便为该种胶原蛋白材料在生物工程领域的应用提供基础。
1 材料与方法
1.1动物、材料与试剂
SPF级ICR雌性小鼠,购自上海西普尔-必凯实验动物有限公司,动物生产许可证号:SCXK(沪)2008-0016。小鼠饲养在相对湿度60%~70%、温度20~25 ℃、自然昼夜温差的环境内,每日定时饲喂常规饲料,每日更换垫料。
罗非鱼皮Ⅰ型胶原蛋白由上海水产研究所提供。所有提取Ⅰ型胶原蛋白的实验操作均在4 ℃条件下进行。罗非鱼鱼皮经浸提、离心、透析和冷冻干燥等步骤获得干燥的罗非鱼酶溶性胶原蛋白(tilapia pepsin soluble collagen,TPSC)。
三羟甲基氨基甲烷(t r i s h y d r o x y m e t h y l aminomethane,Tris)(分析纯) 瑞典LKB公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵(ammonium persulphate,AP)、甘氨酸、四甲基乙二胺、氯化铝、氢氧化钠 国药集团化学试剂有限公司;考马斯亮蓝R250 上海标本模型厂;小鼠抗Ⅰ型胶原蛋白抗体酶联免疫吸附反应(enzyme linked immune sorbent assay,ELISA)试剂盒、小鼠免疫球蛋白G (immunoglobulin G,IgG)ELISA试剂盒、IgA ELISA试剂盒、IgM ELISA试剂盒 上海抚生实业有限公司;0.25 μm孔径亲水PTFE针式滤器 上海安谱科学仪器有限公司。
1.2仪器与设备
DYY-2c型电泳仪 北京六一仪器厂;SH-1000型酶标仪 上海天美仪器有限公司;CR21G型高速冷冻离心机 日本Hitachi公司;电泳凝胶成像分体系统 美国UVP公司。
1.3方法
1.3.1 十二烷基硫酸钠-聚丙烯酰胺电泳(sodium dodecyl su lfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析
采用SDS-PAGE测定罗非鱼皮胶原蛋白分子质量,主要参照Laemmli[18]的方法进行。浓缩胶质量分数为5%,分离胶质量分数为7.5%,250 V电压电泳约1 h至终点。固定液固定1 h,考马斯亮蓝R250染色0.5 h,脱色过夜,凝胶成像系统分析成像。
1.3.2 免疫材料的制备
取44 mL 0.6 mol/L氯化铝溶液加热至60 ℃,再取42 mL 1 mol/L氢氧化钠溶液加热至60 ℃,在60 ℃水浴锅中将氢氧化钠溶液缓慢加入氯化铝溶液中,不断搅拌1 h。用氢氧化钠溶液调整混合液的pH值达7.0时为终点,再继续搅拌10 min,配制得到的氢氧化铝溶胶佐剂装入瓶内,121 ℃高压蒸汽灭菌15 min,室温保存[19-20]。
取罗非鱼皮Ⅰ型胶原蛋白0.012 5 g,加入0.1 mol/L乙酸100 mL。注射前经0.25 μm孔径亲水PTFE针式滤器过滤,作为抗原样品。
虾类是人类优质的食用蛋白资源之一,也是公认的易引起过敏的食物之一。虾蛋白作为一种异体蛋白进入体内时,机体易产生免疫反应将其中和及消灭掉。因此本实验中选用虾蛋白作为阳性对照[21]。选取10 g斑节对虾的肌肉在研钵中匀浆,加入0.1 mol/L乙酸100 mL,4 ℃浸提16 h后10 000 r/min、4 ℃离心20 min取上清液,即为虾总蛋白提取液[22]。经0.25 μm孔径亲水PTFE针式滤器过滤后,虾总蛋白提取液与氢氧化铝溶胶佐剂等体积混匀[19-20],作为阳性对照抗原。
1.3.3 动物分组及免疫
取30 只体质量为20 g左右的雌性ICR小鼠,腹腔注射罗非鱼皮Ⅰ型胶原蛋白溶液,进行剂量筛选预实验。结果表明0.1 mL/d为最佳剂量,因此采用该剂量进行后续实验。
30 只雌性ICR小鼠随机分为6 组,每组5只:低剂量处理组、中剂量处理组、高剂量处理组、对照组、胶原蛋白阳性对照组和虾蛋白阳性对照组,注射量为0.1 mL。各剂量处理组小鼠分别注射罗非鱼皮Ⅰ型胶原蛋白5、50、500 μg/kg(以体质量计,下同);对照组小鼠注射0.1 mol/L乙酸;胶原蛋白阳性对照组和虾蛋白阳性对照组用氢氧化铝溶胶佐剂0.05 mL分别与罗非鱼皮Ⅰ型胶原蛋白及虾蛋白0.05 mL混合,注入小鼠体内,以便更有效地刺激免疫系统,增大免疫应答效应[23]。
每隔一周腹腔注射一次,共注射3 次。期间观察小鼠注射后的症状,每次注射后7 d眼眶取血,抗凝条件为柠檬酸钠3.8%、生理盐水0.85%。5 000 r/min离心5 min取上清液,-20 ℃贮存备用。提取血清进行ELISA分析。
1.3.4 抗体含量检测方法
分别于每次免疫后7 d取血,采用小鼠抗罗非鱼皮Ⅰ型胶原蛋白抗体ELISA试剂盒,利用具有高灵敏度竞争性ELISA的替代工具双抗原夹心法,测定小鼠血清中Ⅰ型胶原蛋白抗体(collagen type I antibody,COL-Ⅰ Ab)水平[24]。在已包被的酶标板上,标准孔准确加入标准品50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。37 ℃温育30 min后弃去液体,每孔加满洗涤液,静置30 s后弃去,重复5 次。每孔加入酶标试剂50 μL(空白孔除外),37 ℃温育30 min,同上洗涤。经过彻底洗涤后加底物3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色,37 ℃避光显色10 min,TMB在辣根过氧化物酶(horseradish peroxidase,HRP)的催化下转化成蓝色。每孔加终止液50 μL终止反应,TMB在酸的作用下转化成最终的黄色。颜色的深浅和样品中Ⅰ型胶原蛋白抗体(COL-Ⅰ Ab)含量呈正相关。以空白孔调零,在4 50 nm波长处测定每组小鼠抗体的绝对吸光度。以标准曲线的公式计算小鼠Ⅰ型胶原蛋白抗体含量[25]。
2 结果与分析
2.1SDS-PAGE结果分析

图1 罗非鱼皮胶原蛋白样品SDS-PAGE图Fig.1 SDS-PAGE of tilapia skin collagen
如图1所示,罗非鱼皮胶原蛋白含两条α链和它们的聚合链β,所得条带与陈申如等[26-27]的研究结果相似。与Nagai等[28]对3 种鱼皮胶原蛋 白的研究结果对比发现,所提取的罗非鱼皮胶原蛋白是Ⅰ型胶原蛋白成分。两条α肽链分子质量约为130 kD,β肽链分子质量约为116 kD[29]。由3 条α链所组成的未变性胶原蛋白分子质量为300 kD,所以β肽链可能是α肽链通过架桥结合所形成的成分[26]。进行SDS-PAGE时,对加了巯基乙醇和未加巯基乙醇的样品进行对照(结果未给出),电泳结果没有区别,推测罗非鱼皮胶原蛋白样 品中没有包含二硫键。
2.2罗非鱼皮Ⅰ型胶原蛋白的抗原免疫原性测定结果
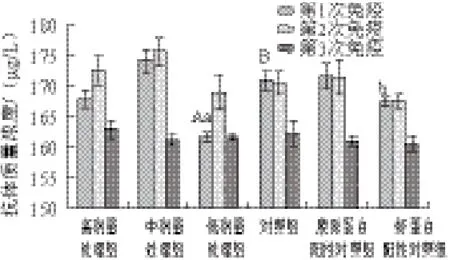
图2 罗非鱼皮Ⅰ型胶原蛋白免疫小鼠的抗体质量浓度Fig.2 Antibody concentrations against tilapia skin type I collagen in mice
在以罗非鱼皮Ⅰ型胶原蛋白为抗原的免疫实验中,所有的小鼠体内均产生抗体。如图2所示,前两次免疫分析结果显示,处理组间比较,中剂量处理组的抗体质量浓度最高,其次为高剂量处理组,最低为低剂量处理组。第3次免疫后高剂量处理组的抗体质量浓度最高,其次为低剂量处理组,最低为中剂量处理组。对比胶原蛋白阳性对照组和虾蛋白阳性对照组的抗体质量浓度可以发现,前两次免疫后胶原蛋白阳性对照组产生的抗体质量浓度要高于虾蛋白阳性对照组,这表明小鼠在接受注射后14 d内对罗非鱼皮Ⅰ型胶原蛋白的免疫强度较虾蛋白强。21 d后这种差异性变得不再明显,这可能是因为21 d后小 鼠对胶原蛋白产生了免疫适应性,导致免疫系统接受胶原蛋白的刺激能力变弱并使免疫循环趋于稳定变化。第3次免疫后所有注射组的抗体质量浓度均降低到最低值,维持在160~163 μg/L的水平。其中,中剂量处理组在第3次免疫后抗体质量浓度明显降低。
由以上结果可以看出,50 μg/kg的罗非鱼皮Ⅰ型胶原蛋白注射量会在小鼠体内产生较高的抗体质量浓度。5 μg/kg的注射量在前7 d时产生的抗体质量浓度较低,与对照组相比差异极显著(P<0.01),与虾蛋白阳性对照组相比差异显著(P<0.05)。罗非鱼皮Ⅰ型胶原蛋白首次免疫小鼠产生的抗体量较少,第2次免疫后产生抗体质量浓度有所升高,至第3次免疫产生的抗体质量浓度又显著降低。这表明低剂量的罗非鱼皮Ⅰ型胶原蛋白是一种低抗原性的蛋白质。随着免疫次数的增加,免疫反应强度进一步降低。原因可能是持续的免疫反应使小鼠适应罗非鱼皮胶原蛋白的能力得到提升,从而使罗非鱼皮Ⅰ型胶原蛋白免疫刺激能力下降。该结果与何创龙等[30]的研究结果相似:运用ELISA间接法检测植入一种骨胶原材料后兔血清的抗体含量,确定该材料的抗原特性从而得出该材料可引起较低的免疫反应。以上结果表明,罗非鱼皮胶原Ⅰ型蛋白可以作为一种蛋白质材料在一定时间内存在于生物体内而不发生严重的免疫反应。
2.3罗非鱼皮Ⅰ型胶原蛋白免疫小鼠产生的IgG、IgA、IgM含量
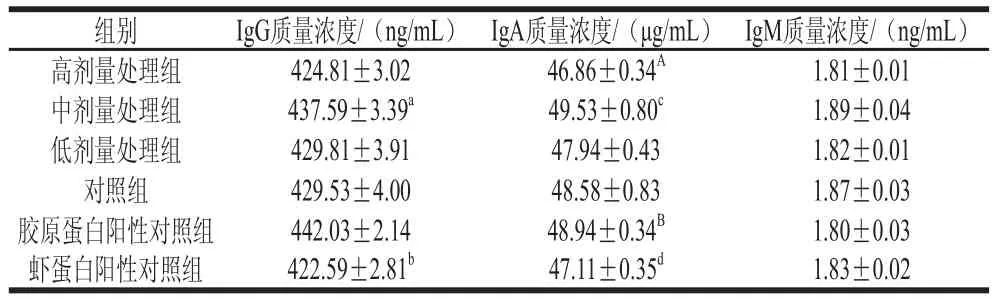
表1 罗非鱼皮Ⅰ型胶原蛋白免疫小鼠的IgG、IgA、IgM质量浓度Table 1 IgG, IgA and IgM concentrations in tilapia skin type Ⅰcollagen-immunized mice
3 次免疫反应后对小鼠体内的IgG、IgA、IgM含量进行酶联免疫分析法测定。由表 1可知,中剂量处理组的IgG质量浓度显著高于虾蛋白阳性对照组(P<0.05),低、高剂量处理组和对照组在小鼠体内的免疫反应没有发现显著差异(P>0.05)。这说明中剂量的罗非鱼皮Ⅰ型胶原蛋白可以刺激小鼠免疫系统产生高质量浓度的IgG。其原因可能是低剂量条件下胶原蛋白活泼基团的暴露量较少,IgG在蛋白分子上的吸附量较低,致免作用较弱。当胶原蛋白剂量逐渐增大时,伴随着胶原蛋白活泼羟基群含量的提升,补体活化作用显著增强,并刺激小鼠免疫系统产生大量的IgG。而高剂量的胶原蛋白抗原含量较高,会较快地与新产生的IgG免疫球蛋白结合并被吞噬细胞吞噬,从而造成IgG检测量偏低。对比处理组和阳性对照组,中剂量处理组罗非鱼皮Ⅰ型胶原蛋白产生的IgG质量浓度要高于同剂量添加佐剂的虾蛋白阳性对照组,这表明罗非鱼皮Ⅰ型胶原蛋白在小鼠体内的免疫反应强于虾蛋白粗提取液。添加佐剂的罗非鱼皮Ⅰ型胶原蛋白(胶原蛋白阳性对照组)产生的IgG质量浓度最高,这表明佐剂的存在会增强IgG的质量浓度水平从而产生更有效的保护性免疫。在IgA质量浓度测定中,罗非鱼皮Ⅰ型胶原蛋白各剂量处理组的IgA质量浓度测定结果与IgG相似,高剂量处理组的IgA质量浓度极显著低于胶原蛋白阳性对照组(P<0.01)。中剂量处理组的IgA质量浓度高于高、低剂量处理组。这种情况在IgM的测定结果中更为明显。胶原蛋白阳性对照组IgM质量浓度低于虾蛋白阳性对照组,这表明罗非鱼皮Ⅰ型胶原蛋白对IgM产生的影响小于斑节对虾虾蛋白。
作为体液免疫系统中重要的免疫效应分子,免疫球蛋白IgG、IgA和IgM在生物体内的含量可以直接体现免疫反应的发生情况[31-32]。侯小萍等[33]研究了Ⅲ型猪胶原蛋白膜免疫实验兔后IgG、IgM和IgA抗体含量,从而确定其免疫特性,作为鉴定该材料是否可以用于鼓膜移植材料的一个依据。孙泽威等[34]也用类似方法对犊牛血清中大豆抗原特异性抗体IgG的含量进行了ELISA检测。IgG是体液免疫最重要的一个生物反应指标,它是血清主要的抗体成分,约占血清免疫球蛋白含量的75%。其主要功能是在机体免疫中起保护作用,如抗菌、抗病毒,应对麻疹、甲型肝炎等,能有效地预防相应的感染性疾病。本实验中罗非鱼皮Ⅰ型胶原蛋白引起小鼠体内IgG的变化进一步验证了罗非鱼皮Ⅰ型胶原蛋白具有一定的抗原性[29]。IgA在正常人血清中的含量仅次于IgG,占血清免疫球蛋白含量的10%~20%,也常与其他免疫球蛋白抗体一起作为抗原反应特性的依据。血清检出IgM 提示新近发生感染,可用于早期感染的诊断依据,因此本实验也对其进行了测定[32]。胶原蛋白阳性对照组的IgA质量浓度高于虾蛋白阳性对照组,表明罗非鱼皮Ⅰ型胶原蛋白的抗原性强于斑节对虾蛋白。并且小鼠体内初次遭遇蛋白质抗原后最早回应出现的循环抗体为IgM, 但IgM在血液中的含量会因清除作用而迅速下降。因此罗非鱼皮Ⅰ型胶原蛋白IgM质量浓度较斑节对虾蛋白低,也证明其抗原性高于后者,应作进一步的检测以确定其影响强度。
3 结 论
本实验中罗非鱼皮Ⅰ型胶原蛋白在SDS-PAGE图中显示由α链和β链构成。罗非鱼皮Ⅰ型胶原蛋白免疫稳定后ICR小鼠产生的Ⅰ型胶原蛋白抗体质量浓度范围为160.50~164.25 μg/L,不同剂量处理组间显示出较小的差别,仅为2%,该结果也显示出罗非鱼皮Ⅰ型胶原蛋白的低抗原性。用不同剂量的罗非鱼皮Ⅰ型胶原蛋白免疫ICR小鼠后,IgG、IgA、IgM作为特征性免疫球蛋白,在各剂量处理组之间差异不大,其质量浓度范围分别是424.81~437.59 ng/mL、46.86~49.53 μg/mL、1.81~1.89 ng/mL。IgG、IgA、IgM的检测结果也显示罗非鱼皮Ⅰ型胶原蛋白的低抗原性。与Song等[16]的研究结果比较,罗非鱼皮Ⅰ型胶原蛋白和水母胶原蛋 白同样可以引起较弱的免疫反应,可知结果的有效性。罗非鱼皮Ⅰ型胶原蛋白低抗原性的结论暗示罗非鱼Ⅰ型胶原蛋白作为食品的安全性及其作为生物材料的可能性。
参考文献:
[1]FLECK C A, SIMMAN R. Modern collagen wound dressings: function and purpose[J]. The Journal of the American College of Certifi ed Wound Specialists, 2010, 2(3): 50-54.
[2]CHEN J L, LI Q L, CHEN J Y, et al. Improvin g blood-compatibility of titanium by coating collagen: heparin multilayers[J]. Applied Surface Science, 2009, 255(15): 6894-6900.
[3]沈同, 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 1981: 157.
[4]BROWN E M. 胶原的结构: 天然胶原和改性胶原的网络结构[J]. 皮革科学与工程, 2005, 15(1): 26-30.
[5]张达江, 王亮. Ⅰ型胶原蛋白的结构, 功能及其应用研究的现状与前景[J]. 生物技术通讯, 2006, 17(2): 265-269.
[6]PATI F, DHARA S, ADHIKARI B. Fish collagen: a potential material for biomedical application[C]//Students’ Technology Symposium (TechSym), 2010 IEEE. IEEE, 2010: 34-38.
[7]李贺, 郑庚修, 王秋芬, 等. 生物医学材料胶原蛋白的研究进展(Ⅱ):胶原的性质及其在生物医学领域的应用[J]. 中国皮革, 2006, 35(3): 27-31.
[8]GIRAUD-GUILLE M M, BESSEAU L, CHOPIN C, et al. Structural aspects of fish skin collagen which forms ordered arrays via liquid crystalline states[J]. Biomaterials, 2000, 21(9): 899-906.
[9]LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69.
[10]SADOWSKA M, KOŁODZIEJSKA I, NIECIKOWSKA C. Isolation of collagen from the skins of Baltic cod (Gadus morhua)[J]. Food Chemistry, 2003, 81(2): 257-262.
[11]KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576.
[12]GÓMEZ-GUILLÉN M C, TURNAY J, FERNÁNDEZ-DIAZ M D, et al. Structural and physical properties of gelatin extracted from different marine species: a comparative study[J]. Food Hydrocolloids, 2002, 16(1): 25-34.
[13]LEE C H, SINGLA A, LEE Y. Biomedical applications of collagen[J]. International Journal of Pharmaceutics, 2001, 221(1): 1-22.
[14]LYNN A K, YANNAS I V, BONFIELD W. Antigenicity and immunogenicity of collagen[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2004, 71(2): 343-354.
[15]LOTT J M, SEHRA S, MEHROTRA P, et al. Type V collagen-induced tolerance prevents airway hyperresponsiveness[J]. American Journal of Respiratory and Critical Care Medicine, 2013, 187(4): 454-457.
[16]SONG E, YEON KIM S, CHUN T, et al. Collagen scaffolds derived from a marine source and their biocompatibility[J]. Biomaterials, 2006, 27(15): 2951-2961.
[17]SARMA N J, TIRIVEEDHI V, MOHANAKUMAR T. Detection of antibodies to self-antigens (K-alpha 1 tubulin, collagen Ⅰ, Ⅱ, Ⅳ, and Ⅴ, myosin, and vime ntin) by enzyme-linked immunosorbent assay (ELISA)[M]//ZACHARY A A, LEFFELL M S. Transplantation immunology. New Jersey: Humana Press, 2013: 335-341.
[18]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[19]李德娟, 何巍, 张睿, 等. 氢氧化铝佐剂配制工艺的优化[J]. 中国生物制品学杂志, 2010, 23(10): 1135-1137.
[20]BURRELL L S, LINDBLAD E B, WHITE J L, et al. Stability of aluminium-containing adjuvants to autoclaving[J]. Vaccine, 1999, 17(20): 2599-2603.
[21]ADACHI A, TANAKA A, CHINUKI Y. Identification of 70 kDa shrimp protein as a possible new allergen for shrimp allergy[J]. Arerugi, 2013, 62(8): 960-967.
[22]DAUL C B, SLATTERY M, REESE G, et al. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin[J]. International Archives of Allergy and Immunology, 1994, 105(1): 49-55.
[23]HOGENESCH H, DUNHAM A, HANSEN B, et al. Formulation of a killed whole cell pneumococcus vaccine-effect of aluminum adjuvants on the antibody and IL-17 response[J]. Journal of Immune Based Therapies and Vaccines, 2011, 9(1): 5. doi: 10.1186/1476-8518-9-5.
[24]DENG Lijuan, XU Yan, HUANG Jian. Developing a double-antigen sandwich ELISA for effective detection of human hepatitis B core antibody[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2008, 31(6): 515-526.
[25]HU Weiping, LU Yang, PRECIOSO N A, et al. Double-antigen enzyme-linked immunosorbent assay for detection of hepatitis E virusspecific antibodies in human or swine sera[J]. Clinical and Vaccine Immunology, 2008, 15(8): 1151-1157.
[26]陈申如, 蔡扬鹏, 周琼, 等. 鲨鱼鱼皮、鱼骨胶原蛋白的纯化及其特性的初步研究[J]. 中国食品学报, 2006, 6(1): 173-178.
[27]陈申如, 蔡扬鹏, 周琼, 等. 鱼骨胶原蛋白的纯化及其特性的初步研究[J]. 食品科学, 2006, 27(11): 177-181.
[28]NAGAI T, SUZUKI N. Isolation of collagen from fi sh waste material: skin, bone and fi ns[J]. Food Chemistry, 2000, 68(3): 277-281.
[29]潘冰青. 鱼类胶原蛋白的分离纯化及其过敏原性研究[D]. 厦门: 集美大学, 2011.
[30]何创 龙, 王远亮, 黄争鸣, 等. 无细胞骨胶原基质的理化性能和组织相容性研究[J]. 生物医学工程学杂志, 2007, 24(3): 538-543.
[31]UNDERDOWN B J, SCHIFF J M. Immunoglobulin A: strategic defense initiative at the mucosal surface[J]. Annual Review of Immunology, 1986, 4(1): 389-417.
[32]GEISBERGER R, LAMERS M, ACHATZ G. The riddle of the dual expression of IgM and IgD[J]. Immunology, 2006, 118(4): 429-437.
[33]侯小萍, 江德胜, 李兆基, 等. 异种胶原生物膜鼓膜移植的生物相容性研究[J]. 山东医大基础医学院学报, 2001, 15(3): 135-137.
[34]孙泽威, 秦贵信, 张庆华, 等. 蒸汽热处理对全脂大豆中主要抗原蛋白免疫原性的影响[J]. 营养学报, 2006, 28(6): 522-525.
Antigen Response Properties of Tilapia Skin Type I Collagen
ZHANG Jingyi1, WU Wenhui2, WANG Nanping3, HE Lan3, Elango JEEVITHAN1, BAO Bin1,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation, Shanghai 201306, China; 3. Shanghai Fisheries Research Institute, Shanghai 200433, China)
Abstract:Objective: To investigate the antigenicity of type I collagen isolated from tilapia skin and evaluate its biocompatibility. Methods: The purity of tilapia skin collagen was confirmed by SDS-PAGE, and the antigenicity was evaluated by measuring the changes in serum IgG, IgA and IgM induced by tilapia skin type I collagen in ICR mouse model using ELISA. Results: The tilapia skin type I collagen was pure. The antibody concentrations of tilapia skin collagenimmunized mice were 160.50–164.25 μg/L, and the concentrations of IgG, IgA and IgM were 424.81–437.59 ng/mL, 46.86–49.53 μg/mL and 1.81–1.89 ng/mL, respectively. Conclusion: Tilapia skin type I collagen has weak antigenicity responsitivty and proved to have superior biocompatibility for biomedical applications.
Key words:collagen; immunization; enzyme-linked immune sorbent assay (ELISA); antigenicity
doi:10.7506/spkx1002-6630-201507015
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)07-0079-05
*通信作者:包斌(1965—),女,副教授,硕士,研究方向为海洋天然产物化学。E-mail:bbao@shou.edu.cn
作者简介:张静怡(1988—),女,硕士研究生,研究方向为海洋药物。E-mail:zhangjyj@163.com
基金项目:国家自然科学基金委员会主任基金项目(81341082);国家高技术研究发展计划(863计划)项目(2011AA09070109)
收稿日期:2014-05-06

