抗菌肽CGA-N46对皮肤感染克柔念珠菌小鼠的治疗作用
张 琳,李瑞芳,张慧茹,钟升威,黄 亮(河南工业大学生物工程学院,河南郑州450001)
抗菌肽CGA-N46对皮肤感染克柔念珠菌小鼠的治疗作用
张琳,李瑞芳*,张慧茹,钟升威,黄亮
(河南工业大学生物工程学院,河南郑州450001)
摘 要:为研究抗菌肽CGA-N46对皮肤感染克柔念珠菌小鼠的治疗效果,用克柔念珠菌感染免疫抑制小鼠制备感染模型,采取皮肤病变观察、皮下脓疱液和痂皮分离真菌,确定建模是否成功。对克柔念珠菌感染小鼠模型分别涂抹4mg/mL和8mg/mL CGA-N46进行治疗,以成活率、有效率和组织病理变化判断CGA-N46治疗效果。结果表明,以2×108CFU/mL克柔念珠菌菌悬液感染表皮可建立感染模型;4mg/ mL和8mg/mL CGA-N46均能提高克柔念珠菌感染小鼠成活率,对克柔念珠菌皮肤感染有缓解作用,其中8mg/mL CGA-N46治疗效果更好。结果证实,CGA-N46对克柔念珠菌临床感染有治疗效果,具有开发成新型抗真菌药物的潜力。
关键词:抗菌肽;CGA-N46;克柔念珠菌;皮肤真菌感染;治疗作用
浅部真菌病(Superficial mycoses)是指皮肤最外层、毛发和指甲的真菌感染,主要包括皮肤癣菌病、浅表念珠菌病和花斑癣。研究表明,浅部真菌病在全球范围内的患病率已达20%~25%,其发病率仍呈逐年上升趋势[1]。临床主要致病真菌以皮肤癣菌为主,但近年来由念珠菌引起的感染明显增多[2]。而且,有些念珠菌由于先天或后天产生耐药使其感染很难治愈[3]。对氟康唑天然耐药的克柔念珠菌,在念珠菌感染中的发病率虽低(2%~5%),但引起的病死率却很高(30%~60%)[4]。克柔念珠菌感染治疗面临着很大困难,对其应该引起重视。
嗜铬粒蛋白A(chromograninA,CGA)是分布于神经细胞和内分泌细胞嗜铬颗粒中的一种可溶性蛋白[5]。研究表明,CGA及其衍生肽段具有多种生物学活性[6]。通过测定CGA不同衍生片段的抗菌活性,发现CGA N端31-76位氨基酸组成的CGAN46具有很强的抗真菌活性[7];抗菌谱试验表明CGA-N46能够抑制多种致病性念珠菌的增殖,尤其对克柔念珠菌抑菌活性最强[8]。
本试验在前期研究的基础上,将CGA-N46用于治疗克柔念珠菌皮肤感染,观察治疗效果,为将其开发成安全、高效、不易产生耐药性的新型抗真菌药物提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物和菌种 SPF级昆明小鼠购自河南省实验动物中心,许可证号:SCXK(豫)2010-0002,共160只小鼠,雌雄各半,体重20g±2g。采用常规饲养方法,自由摄食、饮水,环境温度16℃~22℃,自然光照;克柔念珠菌:菌种编号API-600010,来自北京大学附属医院血液科。
1.1.2药品 CGA-N46由河南工业大学微生物与生化药学实验室制备;盐酸特比奈芬(兰美抒)片剂为北京诺华制药有限公司产品;注射用环磷酰胺为江苏恒瑞医药股份有限公司产品;醋酸曲安奈德注射液为上海通用药业股份有限公司产品;以上药品均用PBS(pH7.0,20mmol/L)配制成所需浓度。
1.2方法
1.2.1试验菌液的制备 取克柔念珠菌接种于SDA(沙保氏培养基:40g/L葡萄糖、10g/L蛋白胨、20g/L琼脂粉)平板上,28℃培养48h,连续活化2次,使克柔念珠菌活力增强。新鲜菌液3 000r/min离心10min得到菌体沉淀,用PBS (pH7.0,20mmol/L)稀释混匀,经血球计数板计数后,调整菌液浓度为2×107、2×108、2×109CFU/mL。同时,以SDA平板稀释培养菌落计数法对菌悬液浓度进行验证。
1.2.2克柔念珠菌皮肤感染小鼠模型的建立 随机挑选9只小鼠,每天以300mg/kg剂量腹腔注射环磷酰胺1次,以20mg/kg剂量股部肌肉注射醋酸曲安奈德2次,连续注射3d,建立免疫抑制小鼠。第4天,用剃须刀刮去小鼠背部约2cm×3cm面积的被毛,再用无菌砂纸摩擦出现渗血点,取方法1.2.1中制备的菌液200μL分3次分别涂抹于小鼠皮肤损伤区,晾干后,放入笼中饲养,并观察皮肤损伤处感染情况。
感染5d后,若皮损部位出现红斑(附有鳞屑)、红色丘疹、丘疱疹或小脓疱、脓肿、糜烂、灰褐色或黑褐色蛎壳样痂皮等症状;以接种针分别挑取脓疱液和痂皮在含卡那霉素(10μg/mL)的SDA平板或液体培养基中培养,获得克柔念珠菌菌落,判断克柔念珠菌皮肤感染小鼠模型建立成功[9],并判断皮肤感染所需最低菌悬液浓度。
1.2.3CGA-N46治疗试验 取150只小鼠,随机分为5组,每组30只,Ⅰ组为正常对照组,Ⅱ组为感染对照组,Ⅲ组为4mg/mL CGA-N46治疗组,Ⅳ组为8mg/mL CGA-N46治疗组,Ⅴ组为特比萘芬治疗对照组。按皮肤感染模型制备方法对Ⅱ组~Ⅴ组小鼠制备皮肤感染模型,自感染当天开始治疗,感染对照组涂抹生理盐水,CGA-N46治疗组分别涂抹相应浓度的CGA-N46,特比萘芬对照组涂抹50μg/ mL特比萘芬(按说明书要求),连续涂抹14d,每日2次,并观察皮损部位变化。正常对照组仅损伤皮肤不接种克柔念珠菌。
1.2.4治疗效果判断
1.2.4.1完全缓解率和部分缓解率比较 如果感染小鼠在给药治疗后食欲、精神恢复正常,全身皮肤无结痂、红肿,毛囊无炎症,皮损处长出新毛发,且镜检皮损处皮屑、毛发未见菌丝孢子,称为完全缓解;如果感染小鼠皮损处无新的病状,有毛发复生,红痒未完全消失,镜检皮损处皮屑有菌丝孢子,称为部分缓解;如果感染小鼠临床症状仍然存在,或又有新症状出现,称为无效[10]。完全缓解率(%)=完全缓解只数/总只数×100%,部分缓解率(%)=部分缓解只数/总只数×100%。
1.2.4.2病原菌检测 采取用药后各组小鼠皮损处的鳞屑、毛发等进行培养,观察病原菌的生长状况。
1.2.4.3组织切片观察 治疗14d后,各试验组随机挑选3只存活的小鼠,脱颈处死,取皮损部位全层皮肤组织,中性甲醛固定,制作石蜡切片,HE染色[11],观察皮肤病理变化。
2 结果
2.1克柔念珠菌皮肤感染小鼠模型
小鼠损伤皮肤感染克柔念珠菌后,感染部位出现红斑(附有鳞屑)、红色丘疹、丘疱疹或小脓疱、脓肿、糜烂、灰褐色或黑褐色蛎壳样痂皮等(图1A)。取皮下脓疱液划线培养,有菌落生长(图1B)。痂皮培养物涂板培养,也有菌落形成(图1C)。菌落较小呈乳白色,表面扁平湿润,边缘较粗糙,显微镜观察可见成群革兰阳性酵母样真菌和假菌丝(图1D、图1E)。病料分离株与克柔念珠菌标准株的菌落形态、菌丝形态和孢子性状特征(图1F)均完全相同。因此,判定克柔念珠菌浅部感染小鼠模型成立,感染克柔念珠菌最低浓度为2×108CFU/mL。
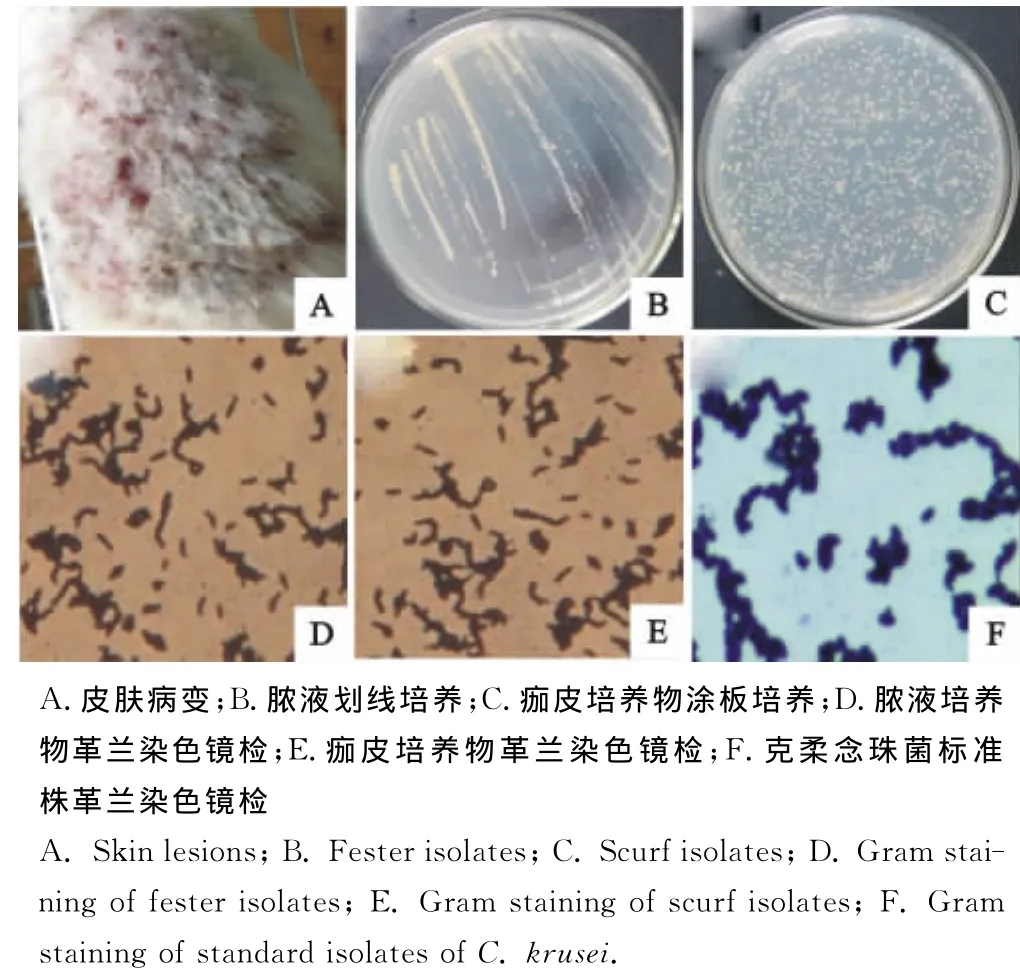
图1 小鼠克柔念珠菌感染皮肤病变及病灶培养镜检Fig.1 Skin lesions of mice infected with C.krusei and C.krusei isolates cultured from lesions
2.2治疗效果
2.2.1成活率 在克柔念珠菌感染模型的治疗过程中,各试验组小鼠均有死亡,各组成活率见表1。
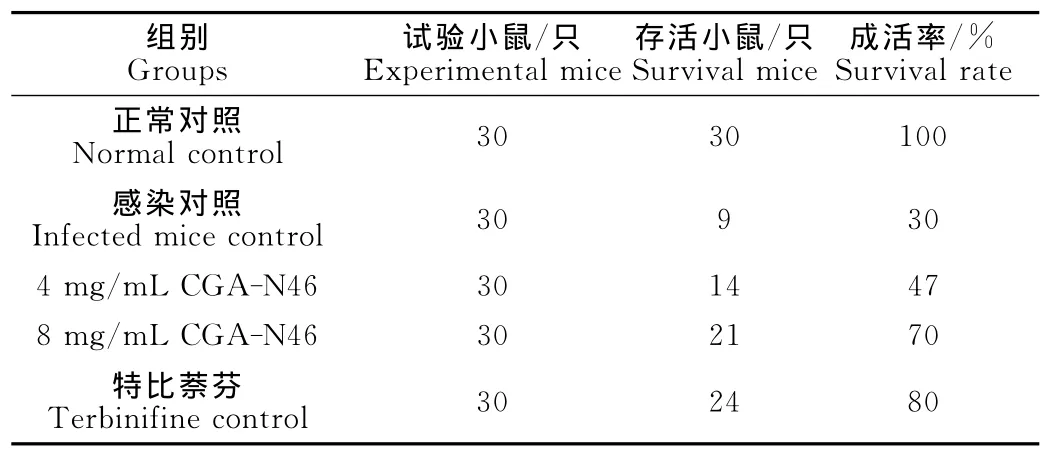
表1 克柔念珠菌皮肤感染小鼠治疗14d后成活率Table 1 Survival rate of mice infected with C.krusei at day 14post-treatment of CGA-N46
在治疗的第14天,8mg/mL CGA-N46治疗组成活率为70%,为感染对照组成活率的2.3倍,稍低于特比萘芬治疗对照组(80%)。
2.2.2病原菌 治疗14d后,分别取各组治愈小鼠毛发和皮屑进行分离培养,均未分离出克柔念珠菌。
2.2.3临床症状 治疗前,感染小鼠体形消瘦,精神萎靡,饮食量降低;治疗14d后,小鼠精神好转,食欲增加。
各感染组小鼠治疗14d后,临床症状见图2。感染对照组小鼠,皮损处仍有红斑、脓肿、结痂及严重脱毛现象;4mg/mL CGA-N46治疗组小鼠皮损处也存在红斑、鳞屑和结痂等现象,但面积、数量较感染对照组减少;8mg/mL CGA-N46治疗组小鼠,皮损处的红斑、鳞屑、脓肿、结痂进一步减少,脱毛现象也明显改善,且有新绒毛长出;特比萘芬治疗对照组小鼠,克柔念珠菌感染引起的皮肤病变基本恢复正常。

图2 治疗14d后克柔念珠菌皮肤感染小鼠临床症状Fig.2 Clinical symptoms of mice infected with C.krusei at day 14post-treatment of CGA-N46
2.2.4完全缓解率和部分缓解率 感染小鼠经治疗后表皮病变有明显改善,统计的完全缓解率和部分缓解率见表2。
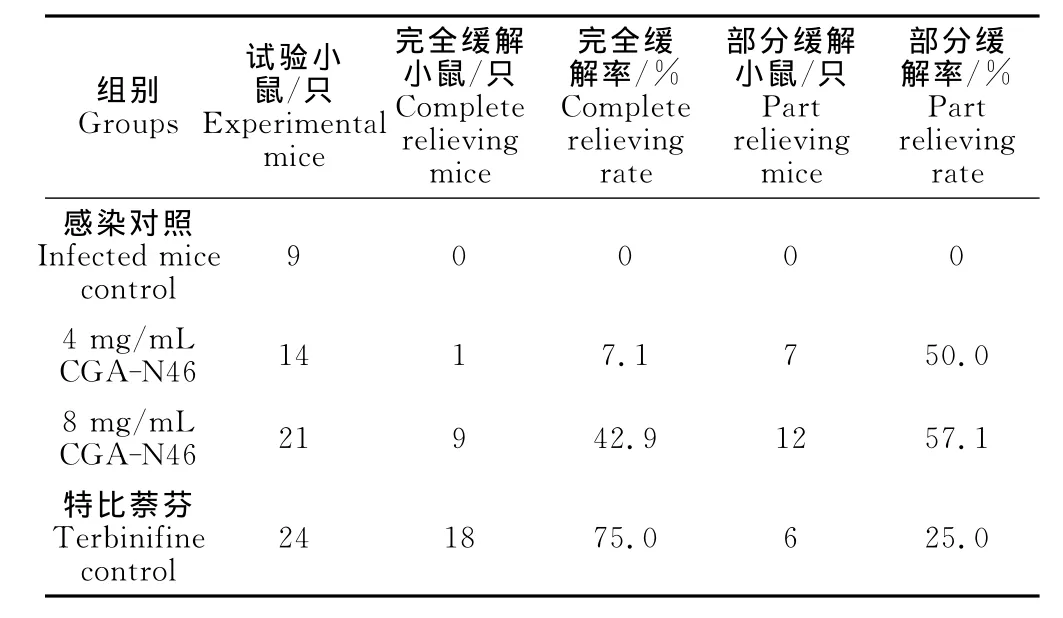
表2 CGA-N46治疗14d后克柔念珠菌皮肤感染小鼠完全缓解率和部分缓解率Table 2 Complete relieving rate and part relieving rate of mice infected with C.krusei at day 14post-treatment of CGA-N46
8mg/mL CGA-N46治疗组完全缓解率和部分缓解率分别为42.9%和57.1%,与特比萘芬治疗对照组相比,虽部分缓解率高,但完全缓解率低,因此,CGA-N46药效低于特比萘芬。
2.2.5皮肤组织病理切片观察 对克柔念珠菌皮肤感染小鼠进行14d治疗后,观察小鼠皮肤病理切片,结果见图3。正常组小鼠皮肤组织结构完整,分层清晰,表皮未见角化过度或角化不全、棘层肥厚、表皮细胞空泡化,毛囊结构清晰可见,未见炎性细胞浸润,真皮层也未见血管扩张充血或水肿。感染对照组小鼠表皮广泛角化过度,表皮明显增厚,可见脓肿小泡,部分表皮细胞空泡化,毛囊结构较少,真皮层内血管扩张,有大量炎性细胞浸润;4mg/mL CGA-N46治疗组小鼠表皮增厚明显,皮突延长并形成波浪状起伏,棘层增厚,毛囊结构少见,真皮层内血管扩张,有少量炎性细胞浸润。8mg/mL CGAN46治疗组小鼠皮损处表皮增厚,角化过度,皮突延长等现象得到明显改善,毛囊结构清晰,且有新的毛发生成,未见炎性细胞浸润现象。特比萘芬治疗组小鼠皮损处,毛囊结构增多,且有新的毛发生成,但皮突延长改善不明显。
3 讨论
克柔念珠菌感染在念珠菌感染病例中比例低,因此,目前对克柔念珠菌研究较少,而建立克柔念珠菌浅部感染模型并进行治疗的研究更少;随着唑类药物在临床真菌感染性疾病治疗中的广泛应用,耐药克柔念珠菌发病率呈逐年上升趋势[4]。因此,成功建立克柔念珠菌动物感染模型具有重要意义。本试验通过人工感染方法建立克柔念珠菌皮肤感染小鼠模型,通过临床症状观察,并结合病料真菌培养综合判断模型是否建立成功。观察发现,模型感染第8天~第10天皮损最为严重,在第14天后逐渐好转,20d左右基本自愈,因此确定感染后的临床观察指标和最佳感染剂量、对皮损的疗效观察最好控制在14d内[12]。
研究CGA-N46对患病小鼠治疗作用时,设特比萘酚作为对照。按照特比萘酚使用说明书将特比萘酚溶于PBS(pH 7.0,20 mmol/L)中,制备成50μg/mL浓度。因此,在进行CGA-N46治疗时,也采用PBS(pH7.0,20mmol/L)进行溶解。根据研究小组前期研究结果,CGA-N46对克柔念珠菌的最小抑菌浓度(MIC)为0.5mg/mL,8mg/mL仅轻微溶血[8],本研究设计了4mg/mL和8mg/mL 2个CGA-N46浓度水平,进行克柔念珠菌皮肤感染治疗。将CGAN46溶解于20mmol/L PBS(pH 7.0)中,对克柔念珠菌感染小鼠模型病患部位涂抹治疗。结果表明,CGA-N46对克柔念珠菌浅部感染有一定的治疗作用。连续治疗14d后,对完全缓解的小鼠皮损处的皮屑和毛发进行培养,未见菌落形成,证实CGAN46具有明显的抗菌作用。根据皮损部位组织病理学观察,多肽CGA-N46对克柔念珠菌引起的表皮增厚、角化过度、角化不全及毛囊损伤等具有缓解和消除效果,且呈现浓度依赖性,进一步确证了多肽CGA-N46的治疗效果。对克柔念珠菌表皮感染的治疗作用,8mg/mL CGA-N46效果明显。
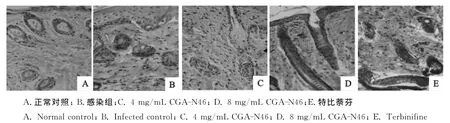
图3 治疗14d后克柔念珠菌皮肤感染小鼠皮损处病理变化(HE染色,400×)Fig.3 Pathological lesions of C.krusei-infected mice at day 14post-treatment of CGA-N46(HE staining,400×)
目前,对抗菌肽体外抗菌活性、抗菌机制的研究较多[13],对抗菌肽动物体抗菌作用的研究还未见报道,因此缺乏参考标准。本文采用CGA-N46最大安全剂量研究其治疗效果,研究结果为抗菌肽临床前研究提供了参考,同时,研究结果也表明CGA-N46对治疗皮肤真菌感染具有开发潜力,是一种新型的抗真菌先导物,值得进一步深入研究。
参考文献:
[1] Pemán J,Cantón E,Quindós G.Epidemiology,species distribution and in vitro antifungal susceptibility of fungaemia in a Spanish multicentre prospective survey[J].J Antimicrob Chemother,2012,67:1181-1187.
[2] Schweigert M,Dubecz A,Beron M,et al.Pulmonary infections imitating lung cancer:clinical presentation and therapeutical approach[J].Ir J Med Sci,2013,182:73-80.
[3] Oliveira V K P,Ruiz L S,Oliveira N A J,et al.Fungemia caused by Candidaspecies in a children's public hospital in the city of Sao Paulo,Brazil:study in the period 2007-2010[J]. Rev Inst Med Trop Sao Paulo,2014,56(4):301-305.
[4] Scorzoni L,De Lucas M P,Mesa-Arango A C,et al.Antifungal efficacy during Candida krusei infection in non-conventional models correlates with the yeast in vitro susceptibility profile [J].PLoS One,2013,8:e60047.
[5] 李瑞芳,卢研博,陈士华,等.动物内源性多肽CGA-N46生物信息学分析[J].动物医学进展,2013,34(4):43-46.
[6] Ghia J E,Crenner F,Metz-Boutigue M H,et al.Effects of a chromogranin-derived peptide(CgA47-66)in the writhing nociceptive response induced by acetic acid in rats[J].Regulatory Peptides,2004,119(3):199-207.
[7] 李瑞芳,张添元,罗进贤,等.嗜铬粒蛋白N区抗真菌活性片段研究[J].中山大学学报,2006,45(2):4055-4059.
[8] 卢亚丽,张慧茹,李瑞芳,等.动物内源性多肽CGA-N46抗菌谱及对动物细胞的作用[J].中国病原生物学杂志,2014,9(1):37-39,47.
[9] De Pauw B,Walsh T J,Donnelly J P,et al.Revised definitions of invasive fungal disease from the European orgianzation for research and treatment of cancer/invasive fungal infections cooperative group and the national institute of allergy and infectious diseases mycoses study group(EORTC/MSG)consensus group[J].Clin Infect Dis,2008,46(12):1813-1821.
[10] 戴 莎,杨蓉娅.盐酸伐昔洛韦片和阿昔洛韦注射液治疗带状疱疹的临床疗效比较[J].现代药物与临床,2014,29(12):1369-1371.
[11] 胡彦卿,杨 英.蓝刺头水提物对糖尿病小鼠胰腺组织的影响[J].动物医学进展,2014,35(6):90-95.
[12] 李 曼,殷中琼,魏 琴,等.姜射桅提取物涂膜剂对家兔人工感染真菌皮癣病的疗效观察[J].中国兽医科学,2014,44 (3):313-319.
[13] Vila-Farres X,Garcia De La Maria C,López-Rojas R,et al. In vitro activity of several antimicrobial peptides against colistin-susceptible and colistin-resistant Acinetobacter baumannii [J].Clin Microbiol Infect,2012,18:383-387.
Curative Effect of Antifungal Peptide CGA-N46 on the Skin of Mice Infected with Candida krusei
ZHANG Lin,LI Rui-fang,ZHANG Hui-ru,ZHONG Sheng-wei,HUANG Liang
(College of Biological Engineering,Henan University of Technology,Zhengzhou,Henan,450001,China)
Abstract:CGA-N46is a novel antifungal peptide derived from human chromogranin A.The study was designed to evaluate its curative effect on the skin infection of mice.The skin infection model of mice infected with Candida krusei was set up successfully after being checked by skin symptom and C.krusei isolated from scurf and coats.The CGA-N46at two different concentrations,4mg/mL and 8mg/mL CGA-N46,were applied for treatment respectively.The survival rate and the relieving rates were calculated,and the skin pathological lesions with HE staining were observed.The results showed that the lowest concentration of infection with Candida krusei was 2×108CFU/mL;CGA-N46could increase the survival rate of C.krusei-infected mice,and relieve the infection symptoms at a dose-dependent pattern.In conclusion,CGA-N46had commendable curative effect on clinical infection of C.krusei and had potency to be a novel antifungal drugs.
Key words:antifungal peptide;CGA-N46;Candida krusei;skin fungal infection;curative effect
作者简介:张 琳(1988-),女,河南息县人,硕士研究生,主要从事微生物与生化药学研究。*通讯作者
基金项目:国家自然科学基金项目(31071922)
收稿日期:2015-01-09
中图分类号:S852.661
文献标识码:A
文章编号:1007-5038(2015)06-0111-05

