蜜蜂残翼病病毒PCR检测及5′-UTR 基因序列分析
郑 言,宋战昀,杨 倩,王向辉,隋佳辰,张 健,王振国,李敏思(.吉林农业大学,吉林长春08;.吉林出入境检验检疫局,吉林长春006;.甘肃农业大学,甘肃兰州70070)
蜜蜂残翼病病毒PCR检测及5′-UTR 基因序列分析
郑言1,宋战昀2*,杨倩1,王向辉1,隋佳辰1,张健1,王振国2,李敏思3
(1.吉林农业大学,吉林长春130118;2.吉林出入境检验检疫局,吉林长春130062;3.甘肃农业大学,甘肃兰州730070)
摘 要:从吉林省某蜂场疑似蜜蜂残翼病病料中分离到一株蜜蜂残翼病病毒(DWV),命名为DWVJL1,提取该分离株的总RNA,采用RT-PCR技术扩增其基因组的5′-UTR并测序。测序结果与GenBank公布道的DWV 5′-UTR序列同源性在95%~99%之间。将测序结果与GenBank上公布的9个相关序列进行系统遗传进化树分析,证实其与JX878304同源性最近,而与GU109335、KJ437447同源性最远。
关键词:蜜蜂残翼病病毒;5′-UTR;克隆和测序分析
蜜蜂残翼病病毒(Deformed wing virus,DWV)为正股小RNA病毒,能引起蜜蜂翅膀的残缺以及成年蜜蜂的死亡。DWV感染一般呈隐性过程[1]。已经证明DWV可感染蜂王的卵巢和雄蜂的储精囊,使蜂王产下带病毒的卵,将病毒从亲代传给子代[2]。DWV如果只寄生在蜜蜂的胸部和腹部,一般不会出现任何症状,但病毒若进入蜜蜂的头部并大量复制,就会出现畸翅症状。DWV最初于20世纪80年代从日本分离得到,现已分布广泛,在欧洲、北美、南美、非洲、亚洲和中东均有发现。DWV能够以低浓度隐性感染方式长期传播于蜂群中,被瓦螨激活后,在宿主体内迅速复制,表现出较强的感染性,最终导致蜂群衰落[3]。因此,加快对DWV致病机制的研究,有助于蜜蜂残翼病的防控,降低养蜂业的经济损失。
DWV属于传染性软化病病毒科(Iflaviridae)、传染性软腐病病毒属(Iflavirus),为单股、正链RNA病毒,基因组为单顺反子,病毒直径约为30 nm,形状为二十面体。基因组结构包括一个大的、连续的开放阅读框(open reading frame,ORF),5′端有一个长的非翻译区域(5′-UTR)。由于DWV基因组5′端没有帽子结构,影响核糖体对mRNA的识别,但5′-UTR有一个内部核糖体进入位点(internal ribosome entry site,IRES),能够启动翻译,因此5′-UTR对基因组的翻译和复制调节起到关键作用[4-5]。本研究采用RT-PCR,成功从疑似蜜蜂残翼病病料中扩增出DWV的5′-UTR基因并对该基因片段进行了分析。
1 材料与方法
1.1材料
1.1.1病料 采自吉林地区蜂场疑似DWV感染的蜜蜂。
1.1.2试剂 Taq DNA聚合酶(Taq DNA polymerase)、dNTPs、10×buffer缓冲液、NA Marker DL 2 000,pMD18-T载体,大肠埃希菌DH5α,cDNA Sythesis Kit,宝生物工程(大连)有限公司产品;PCR引物,上海生工生物工程技术服务有限公司合成;AxyPrep DNA凝胶回收试剂盒、AxyPrep质粒DNA小量试剂盒,康宁生命科学(吴江)有限公司产品;胰蛋白胨,酵母浸出物为Oxoid公司产品。
1.1.3仪器 3K30高速冷冻离心机,德国Sigma公司产品;Gene SpecV核酸蛋白分析仪,日本Hitachi NaKa instruments Co.,Ltd.公司产品;Biometra Tgradient-96PCR扩增仪,德国Biometra公司产品;PS500A电泳仪,美国Sacant公司产品;生化恒温培养箱、0.1μL~1 000μL微量移液器,芬兰Biohit公司产品。
1.2方法
1.2.1RT-PCR扩增 将疑似DWV感染的蜜蜂病料加入适量PBS充分研磨,取上250μL上清液加入DEPC处理的1.5mL EP管,再添加750μL氯仿,剧烈摇晃20 s后室温静止10 min;12 000r/min、4℃离心10min;吸取600μL上清转移至另一新的DEPC处理过的1.5mL离心管,加入事先预冷的异丙醇溶液300μL,-20℃放置
30min;12 000r/min、4℃离心10 min;弃掉上清液,加入1mL 750mL/L的冰乙醇溶液吹打混匀;7 500r/min、4℃离心5min,弃掉上清液,室温干燥5min;加入20μL DEPC水溶解沉淀,最终得到的即为总RNA。
以获得的病毒总RNA为模版,用RTase cDNA Sythesis Kit合成cDNA,保存于-70℃备用。参照GenBank中公布的DWV Korea-1毒株mRNA序列,利用Primer 5.0软件设计一对引物,预期扩增片段大小为910bp,上游引物P1:5′-AGCGAATTACGGTGCAACTAACAAT-3′,下游引物P2:5′-GCCATCGTCTGGGCTATGAGACATT-3′。
以P1(上游引物)、P2(下游引物)、cDNA为模板进行PCR扩增。具体体系为2.5μL 10×PCR buffer,2.0μL dNTP,1.0μL P1,1.0μL P2,0.5 μL Ex Taq酶,1.0μL cDNA,17μL RNase free H2O。扩增条件为:95℃3min;95℃1min,55℃1min,72℃1min,30个循环;72℃延伸10min。PCR产物采用10g/L琼脂糖凝胶电泳检测。
1.2.2RT-PCR扩增产物的克隆及鉴定 按试剂盒说明书用AxyPrep DNA凝胶回收试剂盒回收扩增产物。将回收产物连接到pMD18-T载体后转入大肠埃希菌DH5α,涂在LB培养板上过夜培养,挑取单个白色菌落,放入含5 mL LB培养液的试管中,150r/min摇床培养16h,培养液混浊后采用AxyPrep质粒DNA小量提取试剂盒提取质粒。将采用EcoRⅠ和SalⅠ双酶切鉴定为阳性克隆的送至上海生工生物工程技术服务有限公司测序。测序正确的重组质粒命名为pT-5′-UTR。
1.2.3RT-PCR扩增产物测序及基因系统遗传进化树分析 用Mega5分析软件中的Clustal W程序进行多重序列对齐分析,使用邻接法(Neighborjoining method)的Kimura′s 2-parameter model方法重复1 000次构建进化树。
2 结果
2.1RT-PCR扩增结果
利用设计的特异性引物,从病毒总RNA中采用RT-PCR方法成功扩增到一段长约900bp的片段(图1),其大小与预期大小一致。
2.2克隆质粒酶切鉴定结果
重组质粒经EcoRⅠ和SalⅠ双酶切鉴定,证实重组克隆质粒pT-5′-UTR构建成功(图2)。
2.3RT-PCR扩增产物测序及基因系统遗传进化树分析结果
将重组质粒pT-5′-UTR送上海生工生物工程技术服务有限公司测序,结果显示该片段大小为916bp,序列如图3所示,将测序结果在NCBI上进行Blast比对,该核苷酸序列与搜索到的其他DWV 5′-UTR基因同源性在95%~97%之间,因此证实了得到的序列为DWV 5′-UTR核苷酸序列。将上述测序结果与GenBank上公布的9个DWV全基因组进行比较,9个毒株的GenBank序列号分别为NC004830、AJ489744、JQ413340、AY292384、GU109335、KJ437447、AB070959、JX878304、JX878305。用Mega5分析软件中的Clustal W程序进行多重序列对齐分析使用邻接法(Neighbor-joining method)的Kimura′s 2-parameter model方法重复1 000次构建进化树如图4所示。从图中可以看出该基因核苷酸序列与JX878304株同源性最近,而与GU109335、KJ437447同源性最低。
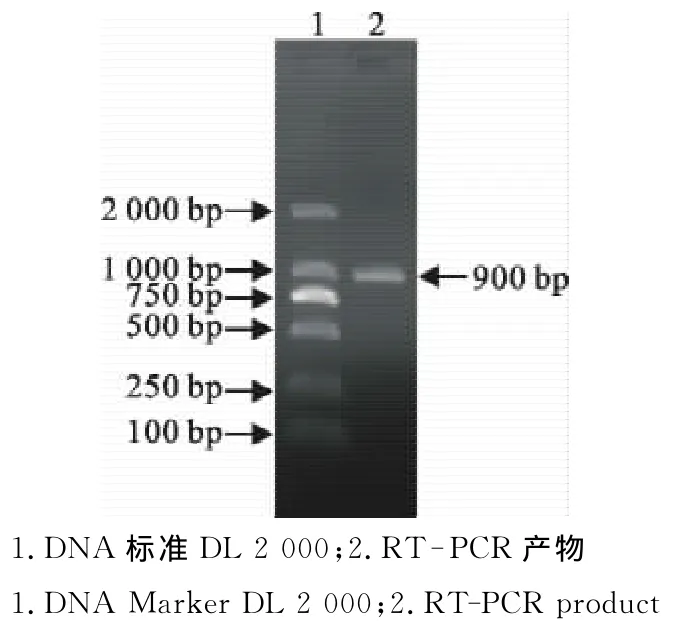
图1 DWV基因cDNA PCR产物Fig.1 PCR products of DWV cDNA
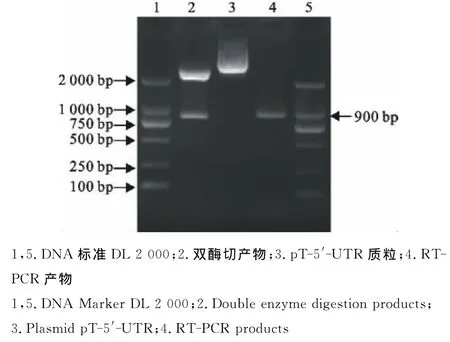
图2 DWV基因克隆质粒双酶切鉴定结果Fig.2 Identification results of DWV cloning plasmid by enzyme digestion

图3 DWV-JL1分离株的核苷酸序列Fig.3 Nucleotide sequence of 5′-UTR gene of DWV-JL1
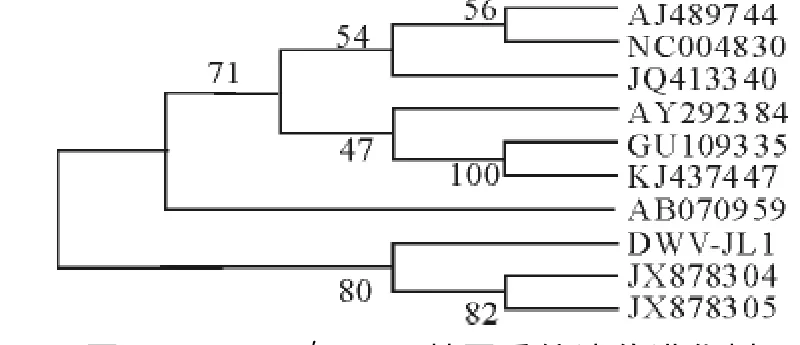
图4 DWV 5′-UTR基因系统遗传进化树Fig.4 Phylogenetic tree of 5′-UTR gene of DWV-JL1
3 讨论
DWV可侵染各发育阶段的蜜蜂,在蛹期危害不明显,羽化后出现翅膀残缺并迅速死亡;成年蜜蜂发病后翅膀畸形、腹部萎缩和褪色。呈隐性感染的蜜蜂虽然无明显临床症状但其寿命也会缩短[6]。临床发现在瓦螨暴发的蜂群中DWV的滴度最高,而在无瓦螨或少量瓦螨存在的蜂群中DWV的滴度较低,因此DWV与传播媒介瓦螨间关系备受关注[7]。近年来的研究表明DWV是引发“蜂群崩溃失调症”(Colony collapse disorder,CCD)的主要病毒之一,DWV在全球范围的流行已成为蜜蜂蜂群非正常消失的一个重要原因[8-10]。
本研究从吉林地区分离到一株DWV毒株,经RT-PCR得到DWV 5′-UTR基因序列,并与Gen-Bank上报道的DWV序列进行遗传进化树分析。通过对吉林地区DWV分离株的5′-UTR研究表明,5′-UTR有一个内部核糖体进入位点(IRES),IRES能够在细胞内的一些反式作用因子的辅助下招募核糖体小亚基对mRNA进行翻译,因此,5′-UTR对基因组翻译和复制调节非常重要。IRES不仅存在于RNA病毒中,在很多DNA病毒中也频繁出现,且在哺乳动物、植物以及酵母中均发现了IRES序列存在。尽管IRES的结构仍未阐明,但其基本组成已经被认定分布在ORF前300个核苷酸内[1],其他传染性软腐病病毒属、微小核糖核酸病毒(Picornaviruses)和双顺反子病毒(Dicistroviruses)的5′-UTR也被证实存在IRES。通过对5′-UTR的研究有助于了解DWV基因组翻译和复制调节机制,对DWV的防控有一定的积极意义。
参考文献:
[1] de Miranda J R,Genersch E.Deformed wing virus[J].J Invertebr Pathol,2010(103):48-61.
[2] 张 炫,陈彦平,和绍禹.蜜蜂病毒学研究进展[J].应用昆虫学报,2012,49(5):1095-1116.
[3] Annoscia D,Del Piccolo F,Nazzi F.How does the mite Varroa destructor kill the honeybee Apis mellifera?Alteration of cuticular hydrcarbons and water loss in infested honeybees[J].J Insect Physiol,2012(58):1548-1555.
[4] Reddy K E,Noh J H,Yoo M S,et al.Molecular characterization and phylogenetic analysis of deformed wing viruses isolated from South Korea[J].Vet Microbiol,2013(18):195-201.
[5] Roberts L O,Groppelli E.An atypical IRES within the 5′-UTR of a dicistrovirus genome[J].Virus Res,2009,139:157-165.
[6] Dainat B,Evans J D,Chen Y P,et al.Dead or alive:Deformed wing virus and Varroa destructor reduce the life span of winter honeybees[J].Appl Environ Microbiol,2012(78):981-987.
[7] Ryabov E V,Wood G R,Fannon J M,et al.A virulent strain of deformed wing virus(DWV)of honeybees(Apis mellifera)prevails after Varroa destructor-mediated,or in vitro,transmission[J].PloS Pathog,2014,10(6):e1004230.
[8] Francis R M,Nielsen S L,Kryger P.Varroa-virus interaction in collapsing honey bee colonies[J].PLoS One,2013,8(3):e57540.
[9] Schroeder D C,Martin S J.Deformed wing virus:the main suspect in unexplained honeybee deaths worldwide[J].Virulence,2012,3(7):589-600.
[10] 吴艳艳,周 婷,王 强,等.蜂群衰竭失调现象研究进展[J].动物医学进展,2013,34(5):95-99.
PCR Detection of Deformed Wing Virus and Sequence Analysis of 5′-UTR Gene
ZHENG Yan1,SONG Zhan-yun2,YANG Qian1,WANG Xiang-hui1,SUI Jia-chen1,ZHANG Jian1,WANG Zhen-guo2,LI Min-si3
(1.Jilin Agricultural University,Changchun,Jilin,130118,China;2.Jilin Entry-Exit Inspection and Quarantine Bureau,Changchun,Jilin,130062,China;3.Gansu Agricultural University,Lanzhou,Gansu,730070,China)
Abstract:A strain of deformed wing virus was isolated from suspected deformed wing virus disease materials in an apiary of Jilin and was named DWV-JL1.Total RNA was extracted from the isolate and a fragment of 5′-UTR gene was amplified by RT-PCR.The sequencing results showed that 5′-UTR had high homology about 95%-99%compared with the report in GenBank.According to the phylogenetic tree based on 5′-UTR,we confirmed that it had the highest homology with JX878304and the lowest homologies with GU109335and KJ437447.
Key words:Deformed wing virus;5′-UTR;cloning and sequence analysis
通讯作者
作者简介:郑 言(1988-),男,吉林人,硕士研究生,主要从事蜜蜂病毒研究。*
基金项目:国家自然科学 (31001065);质检总局科技项目(2013IK033)
收稿日期:2014-08-29
中图分类号:S895.9
文献标识码:A
文章编号:1007-5038(2015)05-0052-04

