短期应用仙灵骨葆联合柳氮磺胺吡啶维持治疗强直性脊柱炎的疗效
郑 宇, 党建军, 金鸿宾, 程宏毅,
李 强2, 齐 磊2, 王 雷2, 王建武2
(1. 天津中医药大学 研究生院, 天津, 300193; 2. 陕西省中医医院 骨伤一科, 陕西 西安710032;
3. 天津市天津医院 骨科, 天津, 300211)
短期应用仙灵骨葆联合柳氮磺胺吡啶维持治疗强直性脊柱炎的疗效
郑宇1,2, 党建军2, 金鸿宾3, 程宏毅2,
李强2, 齐磊2, 王雷2, 王建武2
(1. 天津中医药大学 研究生院, 天津, 300193; 2. 陕西省中医医院 骨伤一科, 陕西 西安710032;
3. 天津市天津医院 骨科, 天津, 300211)
摘要:目的探讨短期应用仙灵骨葆联合柳氮磺胺吡啶(SSZ)治疗强直性脊柱炎(AS)的临床疗效。方法60例AS患者分成实验组和对照组各30例。实验组口服仙灵骨葆胶囊及SSZ连续12个周,对照组口服SSZ治疗12个周。于第1、3、6、12 周评价患者的强直性脊柱炎病情活动指数(BASDAI)、巴氏强直性脊柱炎功能指数(BASFI)、BASDAI和BASFI改善百分比、血沉(ESR)、C反应蛋白(CRP)、AS20%、AS50%。结果第1个周后,2组BASDAI评分相比有显著差异。治疗第3个周后, 2组BASFI评分相比有显著差异。治疗第6、12个周后,2组BASDAI评分及BASFI评分相比均有显著差异。实验组ESR、CRP在治疗1周后即出现持续下降,而对照组3个周后呈持续下降。2组治疗过程中均无严重不良反应。结论应用仙灵骨葆胶囊联合SSZ治疗AS患者的效果优于单用SSZ。
关键词:短期治疗; 强直性脊柱炎; 临床疗效
强直性脊柱炎(AS)是一种以中轴关节、周围关节(最常见于骶髂关节)的无菌性炎症为特点的免疫系统疾病,与HLA-B27呈强关联[1]。腰背疼痛、晨起关节僵硬、腰椎活动受限和胸廓活动度降低为其最主要临床表现。传统医学把AS纳入“痹证”范畴,有“历节病”、“竹节风”、“龟背风”等疾病名称。对于强直性脊柱炎,尤其是中轴关节受累的治疗,传统改善病情药物(DMARD)远期效果不理想,不良反应多。生物制剂近年来虽取得突破性进展[2-3],但价格昂贵,患者接受度低,国内难以广泛推广应用。本研究通过对仙灵骨葆联合SSZ与单用SSZ治疗AS的临床疗效进行观察,评估两种药物联用治疗强直性脊柱炎的有效性和安全性,现报告如下。
1资料与方法
1.1 一般资料
选取2012年1月—2014年1月AS患者60例,其中男56例,女4例,HLA-B27阳性率为89.6%,年龄16~53岁,平均(33.1±7.2)岁,病程5.1~36月,平均(13±6) 月,BASDAI评分为5.2~8.4分,平均(5.4±1.2)分,BASFI评分为5.7~9.0分,平均(7.6±1.3)分。分为实验组和对照组,每组30例。所有患者均以脊柱中轴关节受累为主,其中12例患者同时有髋关节受累,3例患者伴有外周关节受累。2组患者年龄、病程比较差异无统计学意义(P>0.05),具有可比性,见表1。纳入标准: ① 严格按照美国风湿协会在1984年修订的AS纽约标准进行诊断筛选; ② 病情在活动期,即满足下列3项中任意一项即可:晨僵时间不少于30 min; 血沉(ESR)和(或)C反应蛋白(CRP)高于正常;全身疼痛或脊柱疼痛李克特评分≥2分; ③ 实验取得患者知情同意并签字,且能按实验规定定期随访者; ④ 告知患者完成此实验时间要求(能接受和坚持治疗12周者)。本研究获得陕西省中医药研究院(陕西省中医医院)伦理委员会批准,每位患者或其亲属知情同意。排除标准: ① 患者有其他自身免疫系统疾病、严重消化系统疾病(如消化性溃疡、胃肠道癌等)或有严重循环系统疾病、肝、肾功能不全等严重原发性疾病及精神系统疾病等; ② 妊娠或哺乳的女性患者; ③ 近12周内应用过SSZ、免疫抑制剂以及其他DMARD药或糖皮质激素者; ④ 患者体温持续在39 ℃以上伴有剧烈全身疼痛或脊柱疼痛,应用非甾体类抗炎药(NSAIDS)对疼痛缓解不明显者,或已发生中轴关节、外周关节严重畸形和严重功能障碍的AS晚期患者; ⑤ 患者因为经济受限或不能按实验规定坚持完成12周治疗随访; ⑥ 年龄小于15岁或大于70岁者; ⑦ 临床和影像学检查证实脊柱已完全强直、缺血性坏死; ⑧ 既往有过各类传染病史,或近期与各类传染病患者有过密切接触者; ⑨ 有其他严重血液系统、内分泌系统病变患者; ⑩ 对本实验选取药物有过敏表现或对本实验药物有既往过敏史者。
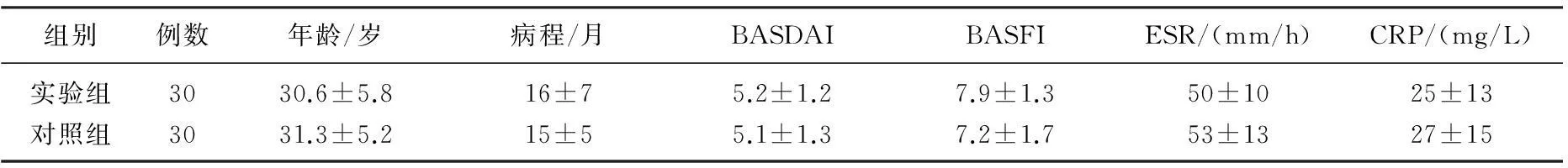
表1 2组患者基线时临床特征比较
1.2 方法
采用前瞻、非随机、对照、开放研究,疗程12周。按照患者经济承受能力及个人意愿分组。实验组:SSZ(上海三维制药有限公司生产,批准文号:国药准字H31020450,服用方法同对照组)联合仙灵骨葆胶囊(贵州同济堂制药有限公司生产,批准文号:国药准字Z20085337), 0.5 g/粒, 3粒/次, 2次/d, 连续治疗12周。SSZ用法同对照组。对照组:口服SSZ,第1周0.25 g/次, 3次/d; 第2周0.5 g/次, 3次/d; 第3周0.75 g/次,3次/d。2组均以治疗4周为1个疗程,观察3个疗程。
采用国际通用的巴氏强直性脊柱炎指数,即巴氏强直性脊柱炎活动性指数(BASDAI)、巴氏强直性脊柱炎功能指数(BASFI)对患者治疗前后脊柱关节的疼痛、活动度、功能改善等进行量化评估,实验组采用专人负责的盲法评估进行Bath指数的采集,同时对2组治疗前后血沉(ESR)、C反应蛋白(CRP)进行测定。基线和1、3、6、12周对患者的BASDAI、BASFI、ESR和CRP进行评价。同时对改善百分比(BASDAI/BASFI)进行评估。其计算公式为: (BaselineBASDAI/BASFI-CurrentBASDAI/BASFI)/BaselineBASDAI/BASFI×100。
患者每4~8周复查血、尿常规,肝、肾功能。基线及每12周行胸片、心电图检查。
1.3 疗效评价
评价标准: ① 患者的中轴关节及周围关节总体VAS评分; ② 中轴关节夜间痛和持续痛VAS评分; ③ BASFI; ④ 中轴关节炎症:BASDAI中后2项和脊柱晨僵有关的VAS平均分值。实现AS疗效评价标准20%、50%(AS20%、AS50%)改善的患者比例,定义为患者在上述4项指标中有3项或3项以上获得20%、50%以上的改善,并且VAS评分≥1分(0~10分),没能达到20%、50% 改善的一项与基线相比无进展。
1.4 统计学分析
选用SPSS 13.0软件对数据进行统计处理,各项观察指标中计量资料以均数±标准差表示,比较采用t检验或秩和检验,计数资料比较采用P检验。所有的统计检验均采用双侧检验,以P<0.05为差异有统计学意义。
2结果
2.1 临床疗效
治疗第1个周后实验组(仙灵骨葆联合SSZ)与对照组(单用SSZ)BASFI评分相比无显著差异,而BASDAI评分相比有显著差异。治疗第3个周后实验组(仙灵骨葆联合SSZ)与对照组(单用SSZ)BASDAI评分相比无显著差异,而BASFI评分相比有显著差异。治疗第6、12个周后实验组(仙灵骨葆联合SSZ)与对照组(单用SSZ)BASDAI评分及BASFI评分相比差异均有统计学意义,平均BASDAI、BASFI改善百分比差异也均有统计学意义。ESR、CRP在仙灵骨葆联合SSZ实验组中1周后出现下降,呈持续下降,而在SSZ对照组3个周后呈持续下降。见表2。
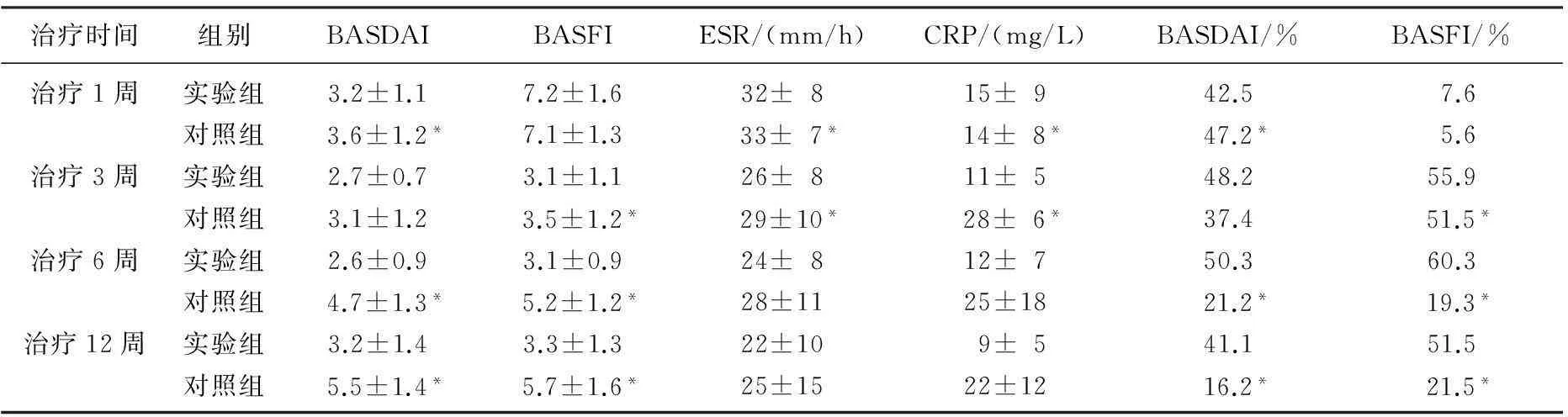
表2 治疗1、3、6、12 周时2组患者各观察指标比较
与实验组比较,*P<0.05。
2.2 2组疗效综合评估情况
治疗1个周后,实验组(仙灵骨葆联合SSZ)疗效综合评价达到AS20%改善率为73.3%(21/30), 达到AS50%改善率为62.2% (18/30), 对照组(单用SSZ)达到AS20%改善率均为34.5%(12/30),达到AS50%改善率为19.2%(6/30), 2组相比有显著差异(P<0.05); 治疗3个周后,实验组疗效综合评估达到AS20%改善率为84.5%(23/30), 达到AS50%改善率为72.2%(21/30),对照组达到AS20%改善率为48.3%(15/30), 达到AS50%改善率为32.3%(9/30), 2组相比有显著差异(P<0.05); 治疗6个周后,实验组疗效综合评估达到AS20%改善率为86.1%(26/30), 达到AS50%改善率为73.6%(22/30), 对照组达到AS20%改善率均为67.1%(16/30), 达到AS50%改善率为52.5%(15/30), 2组相比有显著差异(P<0.05);治疗12个周后,实验组疗效综合评估达到AS20%改善率为90.5%(27/30), 达到AS50%改善率为86.6%(26/30),对照组达到AS20%改善率为67.3%(16/30), 达到AS50%改善率53.1%(15/30), 2组相比有显著差异(P<0.05)。
2.3 药物安全性
应用仙灵骨葆联合SSZ实验组患者无1例出现严重不良反应,未发现结核等其他感染,未发现转氨酶、血细胞分析异常指标。实验组有2例患者自诉轻度口干、便秘,对照组有2例患者发现轻度皮疹,均未对继续用药治疗造成影响,2组在治疗过程中均未发现有异常改变的肝、肾功能及血常规指标。
3讨论
AS的发病原因、病理机制复杂,尚未发现靶向病因及病机,目前对此疾病的研究热点在遗传、免疫、感染及环境等多因素相互作用上。AS的临床发病主要表现在对中轴关节、外周关节和关节外器官(如眼、肾、心血管等)的侵犯、破坏上,病情严重者会影响患者的生活质量。对于AS的治疗,目前尚无特异性的治疗手段。NSAIDS药物对 AS患者的关节疼痛及晨僵感可迅速改善,但部分患者因严重胃肠道的不良反应而不能耐受,且对中轴关节、外周关节功能破坏的进展无阻断作用[4]。最新国内外报道[5-8]采用新型生物制剂、肿瘤坏死因子、微量元素等治疗本病有一定疗效,但价格较贵且疗效不确切,限制了其在临床的广泛应用。在传统治疗药物中,只有SSZ被证明对外周关节有一定疗效[9],对于改善中轴关节方面,目前尚无循证医学证明的有效药物[10-11]。
AS属于中医“痹证(骨痹)”范畴。“正气存内,邪不可干,邪之所凑,其气必虚”。《黄帝内经》中始载:“骨痹不已,复感于邪,内舍于肾……肾痹者,善胀,尻于代踵,脊以代头”。“肾者水也,而生于骨,肾不生则髓不能满,故寒甚至骨也……病名曰骨痹,是人当挛节也”。历代医家遵《内经》之旨,多从“肾虚邪恋”立论,认为肾虚为内因(按现代流行病学对此病的研究,肾虚多为先天禀赋不足,后天劳损积累所致的肾虚较少),风寒湿邪侵入督脉为本病发生的外因。内外合邪,痹阻筋脉,久则伤筋损骨,导致脊柱关节疼痛、僵硬、强直变形。根据以上病机特点,作者认为抗风湿结合补肾活血通络是AS的治疗原则,仙灵骨葆联合SSZ可能是中西医结合治疗AS的理想用药选择,并对其进行了短期临床观察研究。
仙灵骨葆全方主要由黔岭淫羊藿、补骨脂、丹参、生地黄、续断、知母等六味中药组成,淫羊藿温阳补肾,丹参补益肾阳、活血通络,全方具有温阳补肾、强筋壮骨、通络止痛之功效,可治疗因肝肾亏虚、外邪阻络而引起的骨痹。组方君药淫羊藿主要成分为淫羊藿苷,淫羊藿苷可通过抑制AS成纤维细胞中BMP/Smad信号通路的活化,降低成其骨标志基因cbfa-1的表达,从而延缓AS成纤维细胞向成骨型分化可能是淫羊藿苷发挥抗AS骨化的分子机制之一[13-14]。最新研究[15]发现补骨脂中的苷类活性成分和异补骨脂苷,此两种物质分别是补骨脂素和异补骨脂素的前体,在特定实验条件下可以离解为补骨脂素和异补骨脂素,对骨的再生和重建起到促进作用。部分学者认为骨吸收增加是AS并发骨质疏松的主要原因。最新研究表明,补肾中药对调节骨质代谢具有多环节作用,对骨质疏松的防治临床效果确切,一定程度上阻断了AS骨量丢失这一病理环节,从而能提前防治AS并发的骨质疏松性骨折。
丹参主要成分为丹参酮,丹参酮在改善微循环、促进组织的再生与修复有重要作用。经研究,仙灵骨葆多指标溶出度测定中丹参酮ⅡA溶出度高,累积溶出百分率高。国内药学专家研究[16]表明,单味大黄对血浆cAMP含量过高及cAMP/cGMP比值升高有一定抑制作用, 从而达到了抗炎解热效应。Niu等[17]通过研究证实了川续断皂苷Ⅵ可以激活P38和ERK1/2活性,促进成骨细胞增殖和分化,而且大鼠体外间充质干细胞(MSC)向成骨细胞增殖和分化的过程中,川续断皂苷Ⅵ也起到了重要的促进作用。Lu等[18]提出知母皂苷BII能在mRNA和蛋白质水平上减少炎性细胞因子如白介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的生成,并呈现剂量依赖性,知母皂苷BII还能抑制核因子NFκB的活性。Kim 等[19]认为知母皂苷B具有抗炎作用,与知母皂苷BII功效类似,通过阻断p38丝裂素活化蛋白激酶(MAPK)生成,来达到抑制细胞炎症因子NF-κB生成的目的。本研究中,实验组仙灵骨葆联合SSZ在应用1个周时患者的疼痛、晨僵症状即得以显著改善,表明仙灵骨葆改善疾病症状的主要机制是通过抗炎、镇痛、改善微循环的作用来实现的,这也是仙灵骨葆在AS疾病过程中对中轴及周围关节症状改善方面比传统西药治疗更有效的重要原因。
综上所述,仙灵骨葆联合SSZ用药治疗AS能在短时间内控制患者症状,患者依从性好,用药安全,短期疗效确切,是目前短期治疗AS的较理想的中西医结合联合用药选择,但其远期疗效及具体机制尚待进一步研究。
参考文献
[1]Narotam Sharma, Veena Sharma, Tariq Masood, et al. Usageof Conventional PCR Technology for the Detectionof HLA-B27 Allele:A Significant Molecular Marker of Ankylosing Spondylitis[J]. Indian J Clin Biochem, 2013, 28(2): 189.
[2]Sieper J, Porter-Brown B, Thompson L, et al. Assessment of short-term symptomatic efficacy of tocilizumab in ankylosing spondylitis: results of randomised, placebo-controlled trials[J]. Annals of the rheumatic diseases, 2014, 73(1): 95.
[3]Poddubnyy D, Hermann K G A, Callhoff J, et al. Ustekinumab for the treatment of patients with active ankylosing spondylitis: results of a 28-week, prospective, open-label, proof-of-concept study (TOPAS)[J]. Annals of the rheumatic diseases, 2014: 204248.
[4]Haibel H, Poddubnyy D. NSAIDs for spondyloarthrits including ankylosing spondylitis[J]. Advances in the Management of Ankylosing Spondylitis, 2013: 47.
[5]Jung K H, Lim M J, Kwon S R, et al. Angioimmunoblastic T cell lymphoma in an ankylosing spondylitis patient treated with etanercept[J]. Modern Rheumatology, 2013, 23(4): 817.
[6]Arends S, Spoorenberg A, Brouwer E, et al. Clinical studies on bone-related outcome and the effect of TNF-α blocking therapy in ankylosing spondylitis[J]. Current opinion in rheumatology, 2014, 26(3): 259.
[7]Cohen J D, Ferreira R, Jorgensen C. Ankylosing spondylitis refractory to tumor necrosis factor blockade responds to tocilizumab[J]. The Journal of rheumatology, 2011, 38(7): 1527.
[8]Zhao S, Duffield S J, Moots R J, et al. Systematic review of association between vitamin D levels and susceptibility and disease activity of ankylosing spondylitis[J]. Rheumatology, 2014: keu042.
[9]Braun J, Pavelka K, Ramos-Remus C, et al. Clinical efficacy of etanercept versus sulfasalazine in ankylosing spondylitis subjects with peripheral joint involvement[J]. The Journal of rheumatology, 2012, 39(4): 836.
[10]Song I H, Hermann K G, Haibel H, et al. Effects of etanercept versus sulfasalazine in early axial spondyloarthritis on active inflammatory lesions as detected by whole-body MRI (ESTHER): a 48-week randomised controlled trial[J]. Annals of the Rheumatic Diseases, 2011, 70(4): 590.
[11]Braun J, Pavelka K, Ramos-Remus C, et al. Clinical efficacy of etanercept versus sulfasalazine in ankylosing spondylitis subjects with peripheral joint involvement[J]. The Journal of rheumatology, 2012, 39(4): 836.
[12]赵冀伟. 仙灵骨葆胶囊治疗作用的实验与临床研究概述[J].中国医疗前沿, 2012, 11: 008.
[13]马晓娟. 从BMP/Smad信号传导通路探索淫羊藿苷抗强直性脊柱炎骨化的分子机制[D]. 北京: 北京中医药大学, 2012: 1.
[14]贾春蓉, 冯兴华, 刘宏潇, 等. 淫羊藿苷对细胞因子诱导下的强直性脊柱炎成纤维细胞成骨型表达及其分子机制的影响[J]. 辽宁中医杂志, 2012, 39(4): 636.
[15]Chen Y, Cheung Y T, Kong L, et al. Transcriptional regulation of corticotrophin releasing factor gene by furocoumarins isolated from seeds of Psoralea corylifolia[J]. Life sciences, 2008, 82(21): 1117.
[16]刘卫欣, 卢兖伟, 杜海涛, 等. 地黄及其活性成分药理作用研究进展[J]. 国际药学研究杂志, 2009, 36(4): 277.
[17]Niu Y, Li Y, Huang H, et al. Asperosaponin VI, A Saponin Component from Dipsacus asper Wall, induces Osteoblast Differentiation through Bone Morphogenetic Protein‐2/p38 and Extracellular Signal-regulated Kinase 1/2 Pathway[J]. Phytotherapy Research, 2011, 25(11): 1700.
[18]Lu W Q, Qiu Y, Li T J, et al. Timosaponin B-II inhibits pro-inflammatory cytokine induction by lipopolysaccharide in BV2 cells[J]. Archives of pharmacal research, 2009, 32(9): 1301.
[19]Kim J Y, Shin J S, Ryu J H, et al. Anti-inflammatory effect of anemarsaponin B isolated from the rhizomes of Anemarrhena asphodeloides in LPS-induced RAW 264.7 macrophages is mediated by negative regulation of the nuclear factor-κB and p38 pathways[J]. Food and chemical toxicology, 2009, 47(7): 1610.

Effect ofxianlinggubaocombined with sulfasalazine in a short period on maintenance treatment of patients with ankylosing spondyloarthritis
ZHENG Yu1,2, DANG Jianjun2, JIN Hongbin3, CHENG Hongyi2,
LI Qiang2, QI Lei2, WANG Lei2, WANG Jianwu2
(ThefirstdepartmentofOrthopedics,ShaanxiProvinceTraditionalChineseMedicine
Hospital,Xi′an710032)
ABSTRACT:ObjectiveTo explore the clinical effect of xianlinggubao combined with sulfasalazine (SSZ) on treatment of patients with ankylosing spondyloarthritis. MethodsSixty patients with AS were divided into experimental group and control group, 30 cases in each group. The experimental group was treated with xianlinggubao combined with SSZ for 12 weeks, while the control group was treated with SSZ. After treatment of 1, 3, 6, 12 weeks, BASDAI, BASFI, improved percentage, ESR, CRP, AS20% and AS50% were evaluated and compared between two groups.ResultsOne week after treatment, there was significant difference of BASDAI between two groups. Three weeks after treatment, there was significant difference of BASFI between two groups. Six and twelve weeks after treatment, there were significant differences of BASDAI and BASFI between two groups. ESR and CRP in the experimental group declined continuously after one week of treatment, while there was a declining trend 3 weeks after treatment in the control group. There were no severe adverse reactions in both groups. ConclusionApplication of xianlinggubao combined with SSZ in the treatment of AS is better than SSZ.
KEYWORDS:short-term treatment; ankylosing spondylitis; clinical effect
通信作者:党建军
收稿日期:2014-12-16
中图分类号:R 593.23
文献标志码:A
文章编号:1672-2353(2015)07-060-05DOI: 10.7619/jcmp.201507017

