有氧运动及消脂散对高脂膳食所致大鼠生殖机能下降的保护作用
李宁川, 李 铃, 李兴燕, 李 奇, 胡玉龙
(1. 扬州大学体育学院, 江苏 扬州, 225009; 2. 扬州市公道中学, 江苏 扬州, 225119)
有氧运动及消脂散对高脂膳食所致大鼠生殖机能下降的保护作用
李宁川1, 李铃1, 李兴燕1, 李奇2, 胡玉龙1
(1. 扬州大学体育学院, 江苏 扬州, 225009; 2. 扬州市公道中学, 江苏 扬州, 225119)
摘要:目的探讨有氧运动及中药消脂散对高脂膳食所致大鼠生殖机能下降的保护作用及相关机制。方法雄性SD大鼠随机分为C组(普通膳食)、HF组(高脂膳食)、HE组(高脂膳食+运动)、HZ组(高脂膳食+中药)、HZE组(高脂膳食+运动+中药)。运动方案为每周6次、每次60 min无负重游泳运动,进行10周。10周后称取大鼠肾周脂和睾周脂重;测血清TG、TC、FFA水平用以衡量脂代谢状况;测量大鼠精子数、精子活动率、畸形率及FSH、LH、T、E2、LEP水平。结果高脂膳食导致大鼠肾周脂重、睾周脂重、TG、TC、FFA明显上升,精子数、精子活动率明显下降、畸形率明显升高,FSH、LH、T及T/LH明显下降,而E2显著升高、T/E2显著下降、LEP明显升高。有氧运动或消脂散及运动联合消脂散均能使大鼠睾周脂及肾周脂重量、血清TG、TC、FFA、LEP显著下降,FSH、LH、T、T/LH明显上升、E2明显下降,精子数、精子活动率明显上升、畸形率明显下降。结论高脂膳食可以诱导大鼠脂代谢异常并导致生殖功能下降。有氧运动和中药消脂散可改善高脂膳食诱导的脂代谢异常,同时调节性激素分泌和改善大鼠生殖机能。
关键词:有氧运动; 消脂散; 高脂膳食; 精子数; 精子活动率
肥胖是由多因素共同作用导致人体内脂肪堆积过多的疾病。近几十年来,全球肥胖人口的比例呈逐年上升趋势,而中国近10年来居民肥胖发生率等同于西方发达国家30年发展水平。目前研究[1]认为肥胖对男性生殖机能起到了非常大的影响,肥胖、精子质量以及男性不育之间存有一定的关联性,但肥胖引起生殖功能低下的具体机制尚未清楚。本研究探讨高脂膳食对雄性大鼠精子数、活动率、畸形率的影响以及运动、中药对其保护作用及其机制。
1材料与方法
1.1 实验对象及实施方案
5周龄雄性SD大鼠60只(南京青山实验动物研究中心提供),体质量140~160 g, 随机分为普通饮食的对照组(C组,10只),高脂膳食组(HF组,12只);高脂膳食+运动训练组(HE组, 13只);高脂膳食+中药组(HZ组, 12只);高脂膳食+运动训练+中药组(HZE组,13只)。
高脂膳食配方: 80%的基础膳食, 14%的猪油, 2%的胆固醇, 0.5%的胆盐,3%的麻油,由南通立默生物科技有限公司加工。中药消脂散配方为:制何首乌、山楂、白术、泽泻、柴胡、水蛭(炒)、冬瓜皮、荷叶、决明子、生大黄、黄芪、三七等。在每次训练前,对HZ组和HZE组大鼠以500 mg/Kg BW·d(浓度为0.8 g/mL)剂量的中药灌胃,每周6次,补充10周,其余各组在10周实验期间灌服等量的生理盐水。
运动训练方案为每次进行60 min的无负重游泳运动,每周6 d。第1天运动时间为15 min, 每天递增10~20 min,经1周适应训练后增加至60 min, 以后各周维持此运动量,共持续10周。
1.2 取材
各组大鼠于末次游泳结束次日取材。大鼠麻醉后于腹主动脉取血4 mL, 制备血清保存于-20 ℃冰箱。取睾周和肾周脂肪垫称重;完整剪下大鼠睾丸、附睾称重。取附睾尾,置于预先放有1.5 mL生理盐水的离心管中,剪碎混匀,吸管吹打30次并用1层擦镜纸过滤制成精子悬液。
1.3 指标测定
1.3.1精子数、畸形率、活动率测定:精子数测定:将100 μL精子悬液等比稀释混匀后,取1滴于红细胞计数板在显微镜下计数精子。精子畸形率测定:取1滴悬液推片,甲醛固定15 min, 伊红染色10 min, 蒸馏水冲洗、晾干后镜检。畸形的主要表现:如圆锥形头、双头、双尾、尾卷曲等。每个样品计数1 000个精子,记录畸形精子数并计算精子畸形率。精子活动率检测:室温(18 ~24 ℃)条件下,取1滴精子悬液置于清洁载玻片上,连续计数200个左右精子数,并进行分级: Ⅰ,具有快速、直线的向前运动;Ⅱ,慢速或迟钝的直线或非直线向前运动;Ⅲ,具有不向前的运动; Ⅳ,不活动。计算各组大鼠精子活动率,活动率=(Ⅰ+Ⅱ+Ⅲ)/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100。
1.3.2血清生化指标测定:采用贝克曼DXC-800全自动生化分析仪测定血清中甘油三酯(TG)、胆固醇(TC)、游离脂肪酸(FFA)含量(试剂盒购自南京建成生物公司);采用酶联免疫吸附法测定睾酮(T)、雌二醇(E2)、促卵泡激素(FSH)、黄体生成素(LH)、瘦素(LEP)水平(试剂盒购自北京鼎国生物科技有限公司),所用仪器为ELX 800酶标仪。
1.4 统计学分析
实验结果采用平均值±标准差表示,并运用SPSS 17.0统计软件进行方差分析和组间t检验,P<0.05为差异有统计学意义。
2结果
2.1 实验大鼠一般表现及体质量、肾脂重、睾脂重变化
在整个10周实验过程中, C组大鼠体毛洁白有光泽,体质量逐渐增大且较为活泼。从第6周开始,HF组大鼠体毛发黄、稀疏且蓬乱无光泽,精神萎靡,嗜睡,体质量增速减小。而HE、HZ和HZE组大鼠体毛比较洁净,体质量增速正常,精神状态较好、活泼。至10周实验结束时,与C组相比, HF组大鼠体质量略有下降,但无显著差异; HE组、HZE组体质量略低于HF组, HZ组体质量比HF组有明显降低(P<0.05)。与C组相比,HF组睾脂及肾脂质量明显增加(P<0.05); 与HF组相比,HE组、HZ组、HZE组大鼠睾脂及肾脂质量显著下降(P<0.01)。见表1。
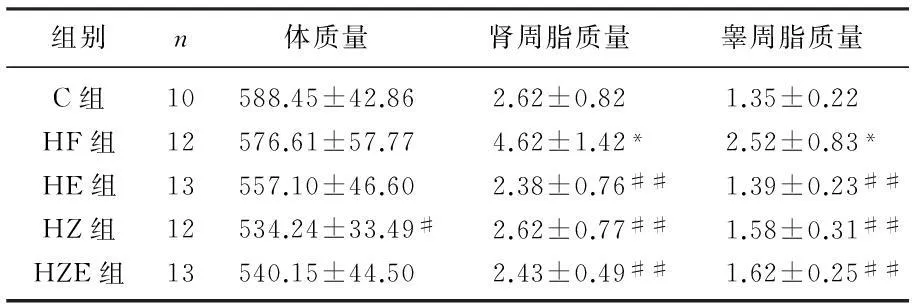
表1 实验大鼠体质量、肾周脂、睾周脂重量 g
与C组比较,*P<0.05; 与HF组比较,#P<0.05, ##P<0.01。
2.2 实验大鼠血清TG、TC、FFA含量变化
与C组相比,高脂膳食使得HF组大鼠血清TG、TC水平明显增高(P<0.01); 有氧运动或消脂散均能显著地降低高脂膳食大鼠血清TG、TC的水平(P<0.01), 而有氧运动联合消脂散对降低高脂膳食大鼠血清TG、TC水平更显著的作用(P<0.01)。
与C组相比,HF组大鼠血清FFA水平明显升高(P<0.05); 在饲喂高脂膳食的同时进行有氧运动训练或服用消脂散能够显著地降低高脂膳食大鼠血清中FFA含量(P<0.01)。见图1。
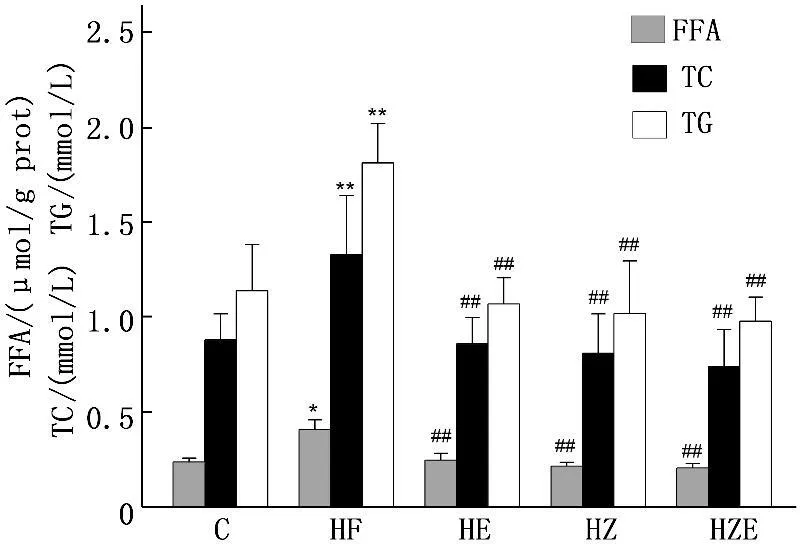
与C组比较,*P<0.05, **P<0.01;
与HF组比较,##P<0.01
图1各组大鼠血清FFA、TC和TG含量
2.3 实验组大鼠精子密度、畸形率、活动率变化
由表2可知,与对照组相比,HF组大鼠精子数和活动率显著下降,畸形率显著升高(P<0.01)。与HF组相比, HE组大鼠精子数明显增多(P<0.05), 畸形率显著下降(P<0.01), 活动率略升高; HZ组大鼠精子数略升高,畸形率明显下降(P<0.05), 活动率略升高; HZE组大鼠精子数明显增多、畸形率显著下降(P<0.01), 而精子活动率略升高。
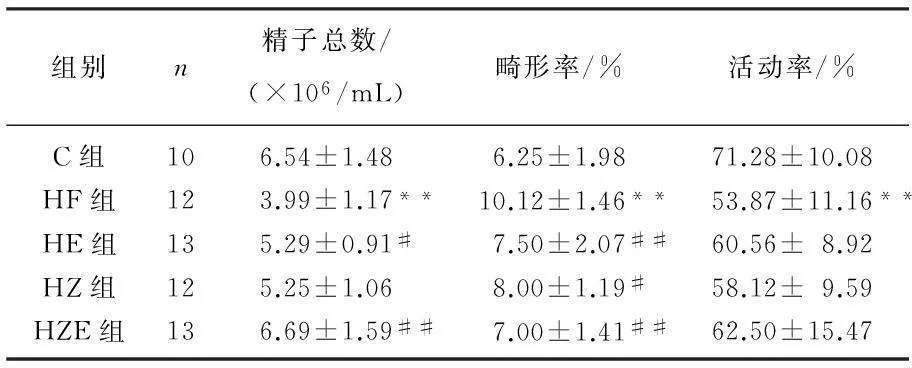
表2 实验大鼠精子数、精子畸形率、活动率比较
与C组比较, *P<0.05; 与HF组比较,#P<0.05,##P<0.01。
2.4 实验大鼠血清T、LH、FSH、LEP含量
由表3可知,与C组相比,HF组大鼠血清T、LH、FSH水平及T/LH明显降低(P<0.05), 而E2显著升高、T/E2显著下降(P<0.01); HE、HZ组血清LH、FSH、T/LH明显高于HF组,E2明显低于HF组(P<0.05), 血清T、T/E2显著高于HF组,运动联合消脂散也可以明显升高血清LH、FSH(P<0.05)和T(P<0.01)的水平,降低E2水平。
与C组相比, HF组大鼠血清中LEP(P<0.01)水平显著升高;在进食高脂膳食的同时进行有氧运动训练(HE)或补充消脂散(HZ)能够明显地降低高脂膳食大鼠血清LEP含量(P<0.05),同时运动联合消脂散对升高血清中LEP(P<0.01)也有显著作用。
3讨论
3.1 高脂膳食对大鼠精子数、精子活动率的影响及机制
在美国及其他西方国家,由于肥胖的流行,男性精子的数量正以每年1.5%的速度减少,而在其他肥胖患病率较低的地区却无此现象[2]。翟玲玲等[3]以高脂膳食饲喂小鼠19周后,小鼠睾丸系数和附睾系数都明显低于对照组,且精子活动度明显低于对照组小鼠。另有报道[4-5]用高脂高胆固醇喂养的雄性小鼠,产生高胆固醇血症的同时小鼠睾丸功能受到影响,睾丸内精子数量减少。本研究以高脂膳食饲喂大鼠10周模拟营养性肥胖对生殖机能的影响,结果表明10周高脂膳食使得大鼠体质量略有下降。本课题组前期亦有同样研究结果[6],有研究者[3]认为这可能是高脂膳食引起大鼠肝脏脂肪沉积引发脂代紊乱,并出现肥胖。本实验中大鼠血清TG、TC和FFA显著升高,睾周脂及肾周脂重量都呈显著性增加;同步实验[7]检测大鼠血糖显著升高,并形成胰岛素抵抗。作者推测长期高脂膳食诱导大鼠糖、脂代谢异常及胰岛素抵抗可能是导致体质量略下降的另一原因。实验结果显示长期高脂膳食使得大鼠精子总数、活动率显著降低,精子畸形率显著升高。说明长期高脂膳食使大鼠体内大量脂肪沉积,出现脂代谢异常的同时导致大鼠精子数量、活动率下降、畸形率升高,这可能是肥胖引发不孕不育的原因之一。Hammoud等[1]也发现肥胖患者的精子总数和密度均减少,存在精子产生障碍。Kort HI等[8]分析了BMI与精液各种相关参数的关系,发现BMI与精子质量之间存在着明显的负相关关系。
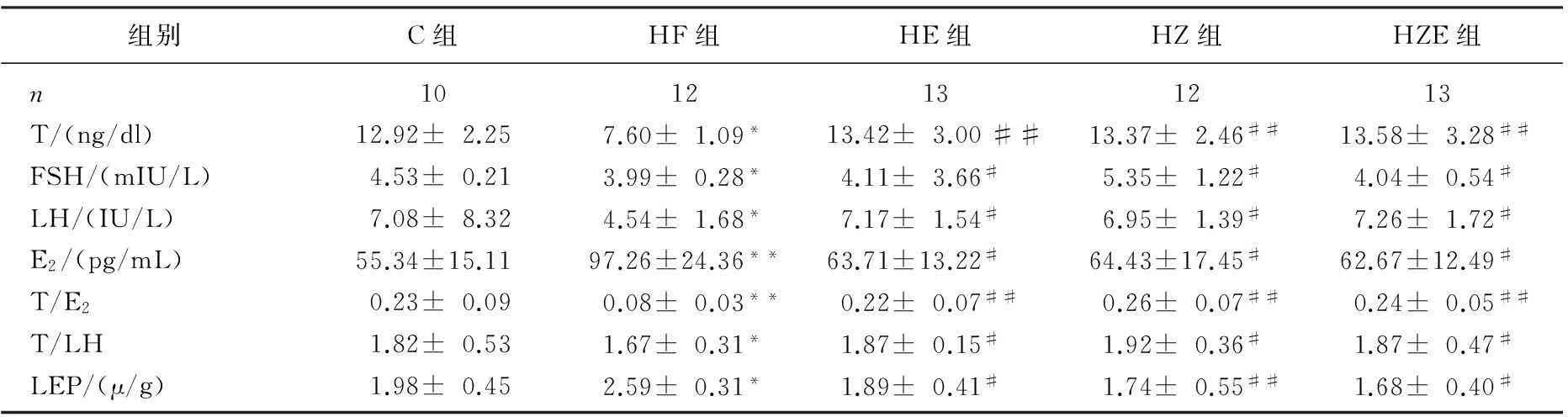
表3 实验大鼠血清T、FSH、LH、E2、Lep比较
与C组比较, *P<0.05, **P<0.01; 与HF组比较,#P<0.05, ##P<0.01。
本研究结果表明,10周高脂膳食可导致大鼠血清T、FSH、LH、T/LH水平明显降低,E2显著升高、T/E2显著下降。王勇等[9]研究发现单纯营养肥胖可影响青春期雄性大鼠生殖器官发育和性激素分泌,进而影响生殖功能。研究[10]表明男性体内总睾酮及游离睾酮均与体脂及皮下脂肪和腹脂呈负相关。Huang等[11]报道,T可由脂肪组织分泌的芳香化酶催化转变E2。实验结果显示高脂膳食促使大鼠血清E2水平升高,而高水平的E2可能反馈抑制促性腺激素释放素(GnRH)的释放,进而降低血清T及T/E2水平。雄性哺乳动物的精子发生与成熟过程,主要是LH刺激睾丸Leydig细胞产生T,T作用于Sertoli细胞刺激精子的生成。精子发生依赖于T及T/E2的平衡,雄性激素水平降低或T与E2失衡都影响睾丸生精细胞的增殖、发育和成熟[12]。高脂膳食导致血清T水平低下将直接影响生精上皮细胞的功能及精子成熟,使睾丸和附睾内的精子数目减少,从而影响生殖功能。因此作者推测长期高脂膳食饲喂大鼠,可引发大鼠脂代谢异常的同时诱发性激素分泌紊乱,进而导致大鼠精子质量下降。
实验[13]结果显示长期高脂膳食明显降低T/LH。研究表明T/LH间接反映了Leydig 细胞的功能。因此长期高脂膳食已引起Leydig细胞的功能下降,进而影响大鼠的生殖机能。实验结果还表明长期高脂膳食可使大鼠血清LEP明显升高。LEP由脂肪组织分泌,可通过神经肽Y(NPY)抑制食欲、调节脂肪代谢,在动物能量代谢过程中,需要通过LEP维持自身能量平衡及生理体脂量。体内一定水平的LEP是保证生殖功能正常的前提,但肥胖患者出现LEP抵抗,血液中LEP大幅升高。高浓度LEP可以通过中枢神经系统发挥间接调控作用,即LEP升高,引发NPY升高,NPY可抑制GnRH分泌,进而干扰生殖内分泌功能;LEP还可以直接作用于垂体组织调节FSH、LH的释放[14], 或作用于外周质膜受体直接调控男性性腺功能[15]。人血清LEP含量与体脂量、BMI呈明显正相关[16]。于春媛等[17]发现,肥胖男童血清LEP高,而高LEP也有抑制T水平的作用。脂肪组织促使T向E2的转化,而E2与LEP可相互促进, 肥胖者高LEP促进了E2的产生,而高LEP水平不能使脂肪消耗增加, 反而促使E2的产生增多, 形成恶性循环,进而导致T/E2失衡。因此,作者推测长期高脂膳食诱导大鼠LEP抵抗性升高是高脂膳食引起生殖机能障碍的另一原因。
3.2 游泳运动联合消脂散对高脂大鼠精子数、精子活动率影响
本研究发现,游泳运动或给予消脂散都可以降低高脂膳食大鼠血清TC、TG、FFA水平及睾周脂和肾周脂重。有氧运动因消耗大量能量进而促进脂肪分解供能,改善高脂膳食导致的脂代谢异常症,减少大鼠体质量、腹脂及双侧附睾脂肪垫重量,调节脂代谢,防止肥胖的发生。
中药能降低脂肪沉积、调节脂代谢且副作用小,已得到许多学者的重视[18-19]。本实验采用的消脂散主要由何首乌、山楂、白术、泽泻、柴胡、水蛭(炒)、荷叶、决明子、生大黄、三七、黄芪等组成,其功效是抑制外源性脂类的吸收,抑制胆固醇、甘油三酯的合成,影响脂质的分布、运转与清除,促进胆固醇的排泄,进而降低脂肪在机体中的沉积[20]。实验也发现给予消脂散可以改善高脂膳食诱导的脂代谢异常。
实验还发现游泳运动还可通过调节高脂大鼠FSH、LH、T、E2、LEP的分泌,进而改善高脂诱导的精子质量下降现象。衣雪洁等[21]研究发现,高脂膳食可诱导雌性大鼠肥胖,LEP水平升高、LEP受体mRNA表达下降,呈瘦素抵抗。耐力训练可明显降低体脂和血瘦素水平,上调脂肪中LEP受体的基因表达,改善LEP抵抗[22-24]。中药消脂散以降脂为主要功效,因此高脂膳食大鼠在补充消脂散后,精子数和活动率增高、畸形率下降,精子质量明显改善。
长期高脂膳食可以诱导大鼠脂代谢异常,进而导致生殖功能下降。有氧运动和中药消脂散可改善高脂膳食诱导的脂代谢异常,同时调节性激素分泌和改善大鼠生殖机能。
参考文献
[1]Hammoud A O, Gibson M, Matthew Peterson C, et al. Obesity and male reproductive potential[J]. J Androl, 2006, 27(5): 619.
[2]熊承良, 吴明章, 刘继红, 等. 人类精子学[M]. 武汉: 湖北科学技术出版社, 2002: 182.
[3]翟玲玲, 赵剑, 白英龙, 等. 肥胖对小鼠生殖功能影响及与性激素关系[J]. 中国公共卫生, 2011, 27(2): 204.
[4]Bataineh H N, Nusier M K. Effect of cholester oldiet on reproductive function in male albino rats[J]. Saudi Med J, 2005, 26(3): 398.
[5]张颖花, 翟玲玲, 张春东, 等. 膳食诱导肥胖小鼠生殖功能变化的试验研究[J]. 现代预防医学, 2011, 38(16): 3179.
[6]李宁川, 邓玉强, 金其贯. 运动训练及大豆多肽对高脂饮食诱导大鼠脂肪肝形成的干预作用[J]. 中国运动医学杂志, 2011, 30(10): 931.
[7]金美东. 有氧运动联合“消脂散”对高脂膳食大鼠胰岛素抵抗的干预作用及其机制的研究[D]. 扬州大学, 2012.
[8]Kort H I, Massey J B, Elsner C W, et al. Impact of body mass index on sperm quantity and quality[J]. Androl, 2006, 27(3): 450.
[9]王勇, 刘晓平, 秦达念, 等. 营养性肥胖对青春期雄性大鼠睾丸发育过程的影响[J]. 中华男科学杂志, 2007, 13(6): 514.
[10]Tsai E C, Matsumoto A M, Fujimoto W Y, et al. Association of bioavailable, free, and total testosterone with insulin resistance: influence of sex hormone-binding globulin and body fat[J]. Diabetes Care, 2004, 27(4): 861.
[11]Huang S W, Seow K M, Ho L T, et al. Resistin mRNA levels aredownregulated by estrogenin vivoandin vitro[J]. FEBS Lett, 2005, 579(2): 449.
[12]Rodriguez A M, Palou A. Uncoupling proteins: gender dependence and their relation to body weight control[J]. International Journal of Obesity,2004,5(28): 500.
[13]Chavarro J E, Toth T L, Wright D L, et al. Body mass index in relation to semen quality,sperm DNA integrity,and serum reproductive hormone levels among men attending an infertility clinic[J]. Fertil Steril, 2010, 93(7): 2222.
[14]张海蓉, 夏雷. 肥胖对女性生殖系统功能影响的研究进展[J]. 山东医药, 2008, 48(39): 112.
[15]Aquila S, Gentile M, Middea E, et al. Leptin secretion by human ejaculated spermatozoa[J]. J Clin EndocrinolMetab, 2005, 90(8): 4753.
[16]Zaccaria M, Ermolao A, Roi G S, et al. Leptin reduction after endurance races differing in duration and energy expenditure[J]. Eur J Appl Physiol, 2002,87(2): 108.
[17]于春媛. 肥胖与正常儿童血中瘦素与性激素水平变化规律研究[J].中国学校卫生, 2001, 22(2): 126.
[18]黄晓兰, 杨明亮, 等. 枸杞多糖对大鼠生殖系统保护作用的机制探讨[J]. 武汉大学学报, 2004, 25(1): 29.
[19]蔡德培, 张炜. 补肾中药对下丘脑GnRH、垂体FSH、LH及成骨细胞BGP基因表达的调节作用[J]. 中医杂志, 2002, 43(3): 221.
[20]傅晨, 欧阳五庆, 尚朋朋, 等. 复方中药降血脂作用及减肥作用的研究[J]. 西北农业学报, 2011, 20(10): 20.
[21]衣雪洁, 王卉, 李秋萍, 等. 运动对高脂膳食雌鼠性发育和瘦素受体mRNA表达的影响[J]. 中国应用生理学杂志, 2009, 25(4): 454.
[22]戎成婷, 韩俊岭, 杜振宁. HSP90β在小鼠生殖系统中的表达及调控[J]. 南方医科大学学报, 12013, 33(4): 491.
[23]杨培培, 刘长云, 朱海玲, 等. 外源性雌激素对雄性青春前期大鼠生殖系统的损伤及其自然修复过程[J]. 吉林大学学报: 医学版), 2014, 40(3): 554.
[24]刘忠平, 李质馨, 李守远, 等. 淫羊藿对生殖系统影响的研究进展[J]. 中国妇幼保健, 2013, 28(5): 884.
Protective function of aerobatic exercise combined with clear-fat-herbal on high fat diet-induced reproductive function suppression in rats
LI Ningchuan1, LI Ling1, LI Xingyan1, LI Qi2, HU Yulong1
(1.PhysicalEducationCollege,YangzhouUniversity,Yangzhou,Jiangsu, 225009;
2.GongdaoMiddleSchool,Yangzhou,Jiangsu, 225119)
ABSTRACT:ObjectiveTo investigate the protection and mechanism of aerobatic exercise combined with clear-fat-herbal on high fat diet-induced reproductive function suppression in rats. MethodsMale SD rats were divided randomly into five groups: control group (group C), high fat diet group (group HF), high fat diet plus exercise group (group HE), high fat diet plus clear-fat-herbal group (group HZ) and high fat diet plus exercise plus clear-fat-herbal group (group HZE). The training plan for rats was 60 minutes unloaded swimming, which would be done 6 days per week for 10 weeks. At the end of experiment, the peri-renal fat weight, inguinal fat weight as well as the levels of triglyceride (TG), total cholesterol (TC), free fatty acid (FFA) in plasma were detected in order to measure the lipid metabolism. The number, abnormal rate, mobility of sperm as well as the levels of follicle stimulating hormone (FSH), luteinizing hormone (LH), testosterone (T), Estradiol(E2)and leptin (LEP) were used to value the reproductive function of rats. ResultsTen weeks of high fat diet?induced the perirenal fat weight, inguinal fat weight as well as the levels of TG, TC and FFA in plasma increased significantly. The sperm number, sperm mobility decreased and the sperm abnormal rate elevated significantly because of obesity. The levels of FSH, LH, T, T/LH, T/E2significantly decreased, and E2significantly increased in HF rat. Aerobic exercise, clear-fat-herbal or exercise combined with clear-fat-herbal was able to decrease the perirenal fat weight and inguinal fat weight significantly. The levels of TG, TC and FFA in plasma decreased significantly, and the sperm activity, the levels of FSH, LH and T significantly increased because of aerobic exercise and clear-fat-herbal.ConclusionHigh fat diet can induce lipid metabolism abnormality and reproductive function suppression. Aerobic exercise combined with clear-fat-herbal can play perform protective effects on reproductive function by regulating lipid metabolism and sex hormone secretion.
KEYWORDS:aerobic exercise; clear-fat-herbal; high fat diet; sperm number; sperm mobility
基金项目:江苏省教育厅重点实验室开放课题资助(K13034)
收稿日期:2014-12-13
中图分类号:R 339.2
文献标志码:A
文章编号:1672-2353(2015)07-016-05DOI: 10.7619/jcmp.201507004

