小鼠Stra8基因慢病毒表达载体的构建与鉴定
郑 哲, 郑 英
(扬州大学医学院, 1. 组织学与胚胎学教研室; 2. 临床医学系, 江苏 扬州, 225001)
小鼠Stra8基因慢病毒表达载体的构建与鉴定
郑哲1,2, 郑英1
(扬州大学医学院, 1. 组织学与胚胎学教研室; 2. 临床医学系, 江苏 扬州, 225001)
摘要:目的探讨GV341质粒构建小鼠Stra8基因的慢病毒表达载体的方法。方法应用PCR技术扩增目的基因,将扩增产物插入慢病毒质粒GV341, 通过PCR筛选及测序对阳性克隆进行鉴定。将慢病毒表达载体转染至293T细胞后,提取转染细胞的总蛋白,用Western Blot法检测细胞中Stra8蛋白的表达情况。结果 成功构建了GV341-Stra8慢病毒表达载体。结论Stra8慢病毒表达载体的构建为体外研究Stra8基因的功能奠定了基础。
关键词:小鼠Stra8基因; 慢病毒载体; 293T细胞
Stra8是一种受视黄酸(RA)调控的基因,是哺乳动物生殖细胞由有丝分裂转变为减数分裂前特异表达的基因[1]。研究[2]表明,Stra8是胚胎和出生后性腺中特异性表达的基因,同时其在生殖细胞的细胞质和细胞核内均有表达,且当细胞处于不同功能状态时,Stra8可在细胞质和细胞核之间进行穿梭,从而发挥不同的功能。Stra8基因敲除小鼠雄性不育,出现与减数分裂细胞周期、染色质浓缩、基因同源重组、DNA损伤修复及细胞凋亡相关的异常表型[3]。据报道[4],Stra8的一个单核苷酸多态性的遗传变异可能与中国男性原发性无精子症和严重少精子症有相关性。Stra8在人类及小鼠的精子发生的过程中都是必不可少的,但Stra8在精子发生中的分子调控网络尚未阐明。本研究构建了Stra8慢病毒表达载体,通过转染293T细胞后发现,在转染的细胞中能够特异性高表达Stra8蛋白。该载体构建后,作者将应用慢病毒表达系统包装慢病毒,感染小鼠精原细胞株,构建具有稳定表达Stra8蛋白的生精细胞系,为体外研究Stra8的分子调控机制提供模型。
1材料与方法
1.1 材料与试剂
GV341载体购自上海吉凯基因化学技术有限公司,293T细胞由扬州大学医学院生物化学教研室程宏博士惠赠, DNA分子量标准、dNTP、Age I、BamH I及T4连接酶购自Takara公司, Taq polymerase 购自上海生工生物有限公司,引物由华大基因生物公司合成,质粒抽提试剂盒购自Axygen公司,脂质体lipofectamine2000购自Invitrogen公司, DMEM、胰酶及胎牛血清购自Gibco公司, Flag鼠抗购自Sigma公司,辣根酶标记山羊抗鼠IgG购自北京中杉金桥生物技术有限公司, GAPDH兔多克隆抗体购自Santa cruz公司, Plus-20离心超滤装置购自Millipore公司, ECL发光试剂盒购自北京普利来基因技术有限公司。
江苏省创新创业训练计划项目(201311117094X); 扬州大学大学生实践创新训练计划项目
1.2 实验方法
1.2.1Stra8片段的扩增:以pCR-Blunt-Stra8质粒为模板进行Stra8编码阅读框区域的扩增,上游扩增引物为: 5′-CCAACTTTGTGCCAACCGGTCGCCACCATGGCCACCCCTGGAGAAGG-3′; 下游扩增引物为: 5′-AATGCCAACTCTGAGCTTCAGATCGTCAAAGGTCTCCAG-3′; PCR反应条件为: 94 ℃ 5 min, 94 ℃ 45 s、55 ℃ 1 min、72 ℃ 1 min, 35个循环, 72 ℃ 10 min。反应体系为: 10×Taq Buffer 5 L, 10 mmol/L dNTP 1 L, 10 mol/L上游引物2 L, 10 mol/L下游引物2 L, 10 ng/μL模板2 L, Taq酶1 L, H2O 37 L, 预计PCR产物长度为1182 bp。琼脂糖凝胶电泳进行鉴定。
1.2.2GV341-Stra8重组质粒的构建:将上述PCR产物及GV341空载质粒分别用Age I和BamH I进行双酶切,然后用T4连接酶进行连接,将连接反应产物转化,利用PCR法对转化子进行鉴定,筛选出阳性克隆。PCR上游引物为: 5′-GGGTCAATATGTAATTTTCAGTG-3′; 下游引物为: 5′-CCTTATAGTCCTTATCATCGTC-3′; 预计阳性转化子PCR产物片段为1281 bp, 阴性转化子PCR产物片段为212 bp。PCR反应条件同上。将经PCR鉴定后的阳性克隆送上海华大基因公司进行测序。
1.2.3慢病毒重组质粒表达的鉴定:将慢病毒重组质粒GV341-Stra8转染至真核细胞中,观察其能否在细胞中表达Stra8蛋白。转染前1 d将293T细胞接种于6孔板中,次日细胞融合度约80%左右。按照Lipofectamine TM2000说明书的要求,将GV341-Stra8表达载体DNA 10 g转染至293T细胞中,转染48 h后收集细胞。
1.2.4细胞总蛋白质的提取:收集转染后的293T细胞,用200 L蛋白裂解液冰上裂解细胞30~60 min, 4 ℃高速离心20 min, 取上清保存备用。
1.2.5Western Blot分析:在细胞总蛋白(约50 μg)中加入等体积2×loading buffer, 将样品在水中煮5~10 min, 冰上冷却5~10 min, 13 000 r/min离心15 min后取上清;将样品加入到聚丙烯酰胺凝胶(125 g/L)上样孔,先10 mA恒流电泳30 min, 后用20 mA恒流电泳,直至溴酚蓝到达凝胶下缘;将凝胶中的蛋白用电转膜仪(0.8 mA/cm2)转移到PVDF膜;将PVDF膜放入含50 g/L脱脂奶粉的TBS中封闭2 h; 加入Flag鼠抗(以1∶3 000稀释于TBS中), 4 ℃过夜;次日用TBS洗3次, 10 min/次;加入HRP-conjugated goat anti-mouse 二抗(1∶4 000稀释), 37 ℃, 1 h; TBS洗3次, 10 min/次;用增强化学发光反应(ECL kit, Amersham Bioscience)显色,化学发光凝胶成像系统中检测杂交信号。
2结果
2.1 慢病毒重组质粒GV341-Stra8的构建
应用前述引物,以质粒pCR-Blunt-Stra8为模板进行扩增,经过琼脂糖凝胶电泳观察, PCR产物大小在1 200 bp左右,与预计片段长度相一致(图1)。将PCR产物与线性慢病毒载体GV341连接后,应用PCR扩增,获得含插入片段的阳性克隆(图2),经序列测定后,证实插入片段的序列正确无误。
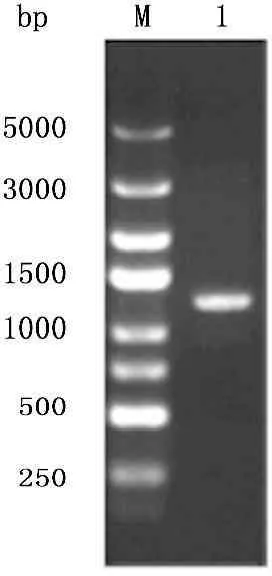
M. DNA分子量标准;
1. Stra8 PCR产物琼脂糖凝胶电泳
图1Stra8 PCR产物琼脂糖凝胶电泳结果
2.2 Western blot分析结果
以未转染慢病毒重组质粒的293T细胞为对照,转染了慢病毒重组质粒GV341-Stra8的293T细胞中可检测到约55 kD大小的片段,其大小与Stra8蛋白相比偏大,但与试剂公司检测的大小相一致(图3),而没有转染慢病毒表达载体的293T细胞中没有检测到相应大小的条带。上述结果提示,用慢病毒重组质粒GV341-Stra8转染293T细胞后能够表达Stra8蛋白,提示慢病毒重组质粒GV341-Stra8构建成功并具有表达能力。
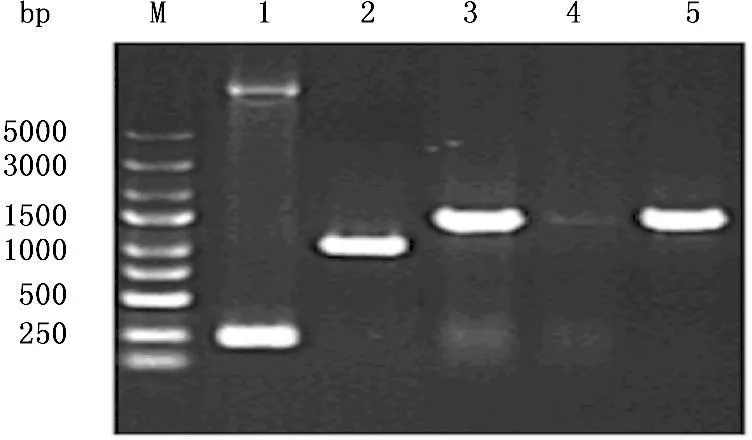
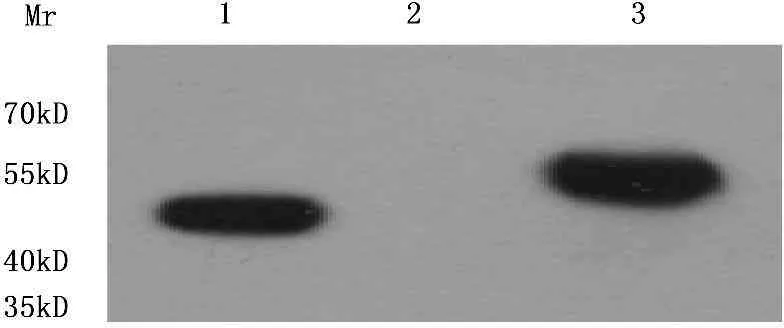
M. DNA分子量标准; 1. 阴性对照(空载自连对照);
1. 阳性对照SURVIVIN-3FLAG-GFP蛋白;
2. 未转染慢病毒表达载体的293T细胞;
3. GV341-Stra8慢病毒表达载体转染293T细胞。
图3Western blot检测慢病毒表达载体转染
293T细胞后Stra8蛋白的表达
3讨论
精子发生过程是一个特殊的细胞分化过程,在这一过程中表现出许多体细胞分化过程中所没有的现象,如减数分裂及精子变态成形。生殖细胞独特的形态与功能导致其表达的基因必然在一定程度上不同于机体的体细胞,具有在不同时空、组织结构和发育模式中的表达方式[5],一旦这些基因的表达方式发生变化,必然会引起精子发生和受精过程的病理改变,导致不育症的产生[6]。
维生素A在哺乳动物多种生理过程中起着必不可少的作用。维生素A一般储存于肝脏,以视黄醇的形式在血液中运输,而在靶器官或靶组织中发挥作用的是其活性形式RA。RA在生殖细胞的发生过程发挥着非常重要的作用[7-9]。RA对精子发生过程也发挥着至关重要的作用[9-13]。成年雄性小鼠缺乏维生素A时,生精小管中所有分化后的生精细胞完全消失,仅残留A型精原细胞和支持细胞。而这种分化后消失的生精细胞在注射RA或给予补充含维生素A饲料后可以重新恢复[14]。因而,RA对于正常的精子发生过程必不可少的[10,14-15]。研究[8,16-17]发现,在胚胎期睾丸中RA氧化酶Cyp26b1的表达使RA失去活性,从而抑制了RA的作用,使精子发生处于未启动状态;从青春期开始,Cyp26b1表达减少,RA开始发挥作用,精子发生启动直至性成熟。
为了研究生殖细胞中受RA调控的基因,1995年法国Bouillet P等[17]研究小组用RA处理小鼠全能的P19胚胎癌细胞,筛选出50个RA反应基因,Stra8是新发现的基因之一[18-20]。进一步研究发现,该基因定位在小鼠第6号染色体上,全长1 455 bp,含有9个外显子,编码一个含393个氨基酸的蛋白质。序列同源性比较发现,在人类也有小鼠Stra8的同源基因,二者的同源性为80%[19]。此外,在其他种属动物如大鼠、牛、狗、恒河猴、大猩猩、灰色短尾负鼠、家鸡、红原鸡等中均有Stra8的同源基因,提示Stra8基因是一种进化上高度保守的基因[19]。在胚胎发育的不同时期睾丸组织中Stra8均未见表达,而在成年小鼠的多组织中,Stra8仅在睾丸中表达,而在脑、心、肺、肝、肾、脾脏及卵巢等其他组织中均未见表达[12]。应用免疫组织化学等多种技术,Zhou Q等[20-21]研究发现,Stra8在成年小鼠睾丸生精小管VI-VIII期中Stra8 mRNA水平最高。对Stra8蛋白的亚细胞定位研究表明:Stra8蛋白可同时表达于生殖细胞的胞浆和胞核内,并根据细胞的状态不同在这两种部位进行穿梭,从而发挥不同的功能[1-2,19]。
为探讨Stra8的作用,Mark M[3]小组构建了Stra8基因敲除小鼠,表型分析发现,除生殖功能外其他器官未见异常表型。雄性小鼠精子发生功能严重缺陷,睾丸体积变小,重量减少,不能生育。20%生精小管中仅见精原细胞和支持细胞,在大多数生精小管中可见细线前期及细线期的初级精母细胞,只有少量初级精母细胞呈现出偶线期及粗线期的细胞核,而粗线中期和偶线期的初级精母细胞及减数分裂后的精子细胞等均缺乏。上述表型显示,在Stra8缺乏的情况下,B型精原细胞可以进行一轮DNA复制,分化为细线前期的精母细胞,进入减数分裂,进一步表型分析发现,进入减数分裂的精母细胞中联会复合体缺乏或畸形,产生了异型联会[12]。提示Stra8可能在染色体配对过程中发挥作用。Anderson EL等[22]也构建了不同遗传背景的Stra8缺陷小鼠,表型分析进一步证实青春期小鼠中Stra8对于细线前期精母细胞的DNA复制过程中并非必须,但对细线前期精母细胞进入减数分裂的染色体浓缩、联会及DNA同源重组过程是必不可少的。
对Stra8表达调控的研究主要集中在其上游调控分子上,如RA的调控通路[7-13]。研究[23-24]表明,生精细胞在RA作用下可促进Stra8基因的表达,因而RA的合成、来源及降解是调节该基因表达的关键。RA激活Stra8基因的表达,可能是通过RA与核受体RXR-RARγ结合形成二聚体,识别并结合在Stra8基因上游的RA反应元件序列而致。CYP26B1可将RA氧化为无活性的形式,降低Stra8的表达,进而阻碍精子发生过程[25-27]。其他研究小组的研究[23-28]发现,SHP和Nanos2蛋白可促进CYP26B1表达,使局部RA浓度降低,进而抑制Stra8基因表达来影响精子发生,同时SHP还可以直接抑制RARs的转录活性,导致Stra8的表达减少。DMRT1则在生精细胞中通过限制RA依赖的转录,结合到Stra8两个启动子附近的RA反应元件上抑制Stra8的转录来调控精子发生过程[29]。
目前对Stra8调控的下游分子相关研究鲜有报道。由于Stra8表达于特定阶段的生精细胞[10],且在目前仅有的两种小鼠永生化的生精细胞株中Stra8蛋白并不表达,这也在一定程度上限制了Stra8功能的体外研究及其下游调控网络的探索。因此,构建具有稳定表达Stra8蛋白的生精细胞系,并应用该细胞模型进行Stra8功能的研究迫在眉睫。
慢病毒载体是以人类免疫缺陷I型病毒为基础发展起来的基因治疗载体,该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。同时慢病毒载体介导的转基因表达能持续数月,且无可观察到的病理学现象。据文献报道及本实验室前期研究发现,永生化小鼠精原细胞株在进行真核表达质粒转染时转染效率较低,稳定表达蛋白的性状维持时间较短且易丢失。因此,慢病毒表达系统为构建稳定表达Stra8蛋白的精原细胞系提供了可能。
本研究首先通过PCR扩增法,成功获得了Stra8基因全长开放阅读框,并将其重组到慢病毒载体GV341上,获得了慢病毒重组质粒GV341-Stra8,经PCR筛选及序列测定证实插入片段序列准确无误。将慢病毒重组载体GV341-Stra8转染到293T 细胞中,用Western blot法检测发现,转染后的293T细胞中能够表达大量的Stra8蛋白。在GV341载体中Stra8插入片段的氨基端含有Flag标签,因此,作者用Flag的抗体来识别Stra8蛋白。慢病毒载体构建完成后,作者将在此基础上进行慢病毒的包装和制备,进而用慢病毒感染生精细胞,从而构建一种稳定过表达Stra8蛋白的生精细胞系,并在此基础上进行Stra8基因的功能研究。
综上所述,本研究成功构建了慢病毒表达载体GV341-Stra8,该表达载体能够通过转染293T细胞获得稳定表达的Stra8蛋白。该研究为进一步探索Stra8基因的功能及其作用的分子机制奠定了实验基础。
参考文献
[1]Oulad-abdelghani M, Bouillet P, Decimo D, et al. Characterization of a premeiotic germ cell-specific cytoplasmic protein encoded by Stra8, a novel retinoic acid-responsive gene[J]. Journal of Cell Biology, 1996, 135(2): 469.
[2]Tedesco M, La Sala G, Barbagallo F, et al. STRA8 shuttles between nucleus and cytoplasm and displays transcriptional activity [J]. Journal of Biological Chemistry, 2009, 284(51):35781.
[3]Mark M, Jacobs H, Oulad-Abdelghani M, et al. STRA8-deficient spermatocytes initiate, but fail to complete, meiosis and undergo premature chromosome condensation [J]. Journal of Cell Science, 2008,121(Pt 19):3233.
[4]Lu C, Xu M, Wang Y, et al. Genetic variants in meiotic program initiation pathway genes are associated with spermatogenic impairment in a Han Chinese population [J]. PLOS One,?2013, 8(1):e53443.
[5]Eddy EM. Regulation of gene expression during spermatogenesis [J]. Seminars in Cell & Developmental Biology, 1998, 9(4): 451.
[6]Stouffs K, Vandermaelen D, Tournaye H, et al. Genetics and male infertility [J].Verh K Acad Geneeskd Belg, 2009, 71(3):115.
[7]Koubova J, Menke DB, Zhou Q, et al. Retinoic acid regulates sex-specific timing of meiotic initiation in mice [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(8): 2474.
[8]Bowles, J, Knight, D, Smith, C, et al. Retinoid signaling determines germ cell fate in mice[J]. Science, 2006, 312(5773): 596.
[9]Childs AJ, Cowan G, Kinnell HL, et al. Retinoic Acid signalling and the control of meiotic entry in the human fetal gonad [J]. PLOS One,?2011, 6(6): e20249.
[10]Ghyselinck N B, Vernet N, Dennefeld C, et al. Retinoids and spermatogenesis: lessons from mutant mice lacking the plasma retinol binding protein [J]. Developmental Dynamics, 2006, 235(6): 1608.
[11]Vernet N, Dennefeld C, Rocherre-egly C, et al. Retinoic acid metabolism and signaling pathways in the adult and developing mouse testis[J]. Endocrinology, 2006, 147(1): 96.
[12]Snyder E M, Davis J C, Zhou Q, et al. Exposure to Retinoic Acid in the Neonatal but Not Adult Mouse Results in Synchronous Spermatogenesis [J]. Biology of Reproduction, 2011, 84(5): 886.
[13]Koubova J, Hu Y C, Bhattacharyya T, et al. Retinoic acid activates two pathways required for meiosis in mice [J]. PLOS Genetics, 2014, 10(8): e1004541.
[14]Li H, Palczewski K, Baehr W, et al. Vitamin A deficiency results in meiotic failure and accumulation of undifferentiated spermatogonia in prepubertal mouse testis[J]. Biology of Reproduction, 2011, 84(2): 336.
[15]Busada JT1, Kaye E P, Renegar R H, et al. Retinoic acid induces multiple hallmarks of the prospermatogonia-to-spermatogonia transition in the neonatal mouse[J]. Biology of Reproduction, 2014, 90(3): 64.
[16]Chen W, Jia W, Wang K, et al. Retinoic acid regulates germ cell differentiation in mouse embryonic stem cells through a Smad-dependent pathway [J]. Biochemical and Biophysical Research Communications, 2012, 418(3): 571.
[17]Wu J W, Wang R Y, Guo Q S, et al. Expression of the retinoic acid-metabolizing enzymes RALDH2 and CYP26b1 during mouse postnatal testis development[J]. Asian Journal of Andrology, 2008, 10(4): 569.
[18]Bouillet P, Oulad-abdelghani M, Vixaire S, et al. Efficient cloning of cDNAs of retinoic acid responsive genes in P19 embryonal carcinoma cells and characterization of a novel mouse gene, Stra1(mouse LERK-2 /Eplg2)[J]. Developmental Biology, 1995, 170(2): 420.
[19]Miyamoto T, Sengoku K, Takuma N, et al. Isolation and expression analysis of the testis-specific gene, STRA8, stimulated by retinoic acid gene 8[J]. Journal of Assisted Reproduction and Genetics, 2002, 19(11): 531.
[20]Zhou Q, Nie R, Li Y, et al. Expression of stimulated by retinoic acid gene 8 (Stra8) in spermatogenic cells induced by retinoic acid: an in vivo study in vitamin A-sufficient postnatal murine testes[J]. Biology of Reproduction, 2008, 79(1): 35.
[21]Zhou Q, Li Y, Nie R, et al. Expression of stimulated by retinoic acid gene 8 (Stra8) and maturation of murine gonocytes and spermatogonia induced by retinoic acid in vitro[J]. Biology of Reproduction, 2008, 78(3): 537.
[22]Anderson E L, Baltus A E, Roepers-Gajadien H L, et al. Stra8 and its inducer, retinoic acid, regulate meiotic initiation in both spermatogenesis and oogenesis in mice [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(39): 14976.
[23]Gely-Pernot A, Raverdeau M, Célébi C, et al. Spermatogonia differentiation requires retinoic acid receptor γ[J]. Endocrinology, 2012, 153(1): 438.
[24]Kashyap V, Laursen K B, Brenet F, et al. RARγ is essential for retinoic acid induced chromatin remodeling and transcriptional activation in embryonic stem cells[J]. Journal of Cell Science, 2013, 126(Pt 4): 999.
[25]Saba R, Wu Q, Saga Y. CYP26B1 promotes male germ cell differentiation by suppressing STRA8-dependent meiotic and STRA8-independent mitotic pathways[J]. Developmental Biology, 2014, 389(2): 173.
[26]Kumar S, Chatzi C, Brade T, et al. Sex-specific timing of meiotic initiation is regulated by Cyp26b1 independent of retinoic acid signalling [J]. Nature Communications, 2011, 2: 151.
[27]MacLean G, Li H, Metzger D, et al. Apoptotic extinction of germ cells in testes of Cyp26b1 knockout mice[J]. Endocrinology, 2007, 148(10): 4560.
[28]Feng CW1, Bowles J, Koopman P. Control of mammalian germ cell entr into meiosis[J]. Molecular and Cellular Endocrinology, 2014, 382(1): 488.
[29]Matson C K, Murphy M W, Griswold M D, et al. The mammalian double sex homolog DMRT1 is a transcriptional gatekeeper that controls the mitosis versus meiosis decision in male germ cells[J]. Developmental Cell, 2010, 19(4): 612.
Construction and identification of mouse Stra8 gene recombinant lentivirus vector
ZHENG Zhe1,2, ZHENG Ying1
(1.DepartmentofHistologyandEmbryology; 2.DepartmentofClinicalMedicine,Medical
CollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
ABSTRACT:ObjectiveTo explore the method for construction and identification of Stra8 gene lentiviral expression vector. MethodsStra8 was synthesized with particular primer, amplified by PCR and cloned into the lentiviral vector expression plasmid GV341. After digestion and sequencing, GV341-Stra8 was transfected into 293T cells.Expression of Stra8 protein was detected by Western blot. ResultsThe lentiviral expression vector GV341-Stra8 was constructed. 293T cells transfected with GV341-Stra8 vector were able to express Stra8 protein. ConclusionConstruction of GV341-Stra8 lentiviral expression vector can provide an experiment foundation for further studies of Stra8 function.
KEYWORDS:mouse Stra8; lentivirus vector; 293T cells
通信作者:郑英, E-mail: yzzkl@163.com
基金项目:国家自然科学基金资助项目(No. 31371174); 江苏省自然科学基金资助项目(BK20131230);
收稿日期:2014-12-24
中图分类号:R 596.1
文献标志码:A
文章编号:1672-2353(2015)07-011-05DOI: 10.7619/jcmp.201507003

