艾滋病HAART治疗中免疫重建炎性综合征临床特征与潜在影响因素探讨
胡利萍, 努力比亚·阿不都克尤木, 潘珂君, 伊法热·买买提艾力,
买买提艾力·吾布力, 鲁晓擘, 张跃新
(新疆医科大学第一附属医院 感染科, 新疆维吾尔自治区 乌鲁木齐, 830054)
艾滋病HAART治疗中免疫重建炎性综合征临床特征与潜在影响因素探讨
胡利萍, 努力比亚·阿不都克尤木, 潘珂君, 伊法热·买买提艾力,
买买提艾力·吾布力, 鲁晓擘, 张跃新
(新疆医科大学第一附属医院 感染科, 新疆维吾尔自治区 乌鲁木齐, 830054)
摘要:目的观察艾滋病患者高效抗逆转录病毒治疗(HAART)启动后发生免疫重建炎性综合(IRIS)的临床特征,并探讨IRIS发生影响因素。方法以2003年6月—2013年6月接受HAART治疗的艾滋病患者102例为研究对象,设立6个月随访期。分别与HAART启动时,启动后90 d和180 d检测患者HIV RNA病毒载量和CD4+细胞计数,根据观察期内是否出现IRIS将患者分为IRIS组(19例)和非IRIS组(83例)。收集2组一般资料,实验室和影像检查资料。结果IRIS发病率18.6%(19/102), HAART启动后IRIS发生平均为33 d, 感染类型以结核分枝杆菌感染为主(57.9%, 11/19)。IRIS组和非IRIS组CD4+细胞计数基线比较差异有统计学意义(P<0.01); HAART启动后2组HIV RNA病毒载量呈下降趋势, CD4+细胞计数呈上升趋势。经分析, HAART启动时CD4+细胞计数(OR=6.45, 95% CI∶4.59~15.6)和HAART启动后HIV RNA病毒载量变化(>2 log10拷贝/mL)(OR=3.12, 95% CI∶1.45~6.24)与IRIS发生相关。结论IRIS多发生于HAART启动后3个月内, HAART启动前基线CD4+细胞水平越低,HAART启动后HIV RNA病毒载量变化越大,则患者IRIS发生风险越大,应积极开展对症抗感染治疗。
关键词:艾滋病病毒; 抗逆转病毒治疗; 免疫重建炎性综合; 结核杆菌
高效抗逆转录病毒疗法(HAART)的应用有效减少了艾滋病病毒(HIV)感染者机会感染的发生,延缓艾滋病进程,降低总死亡率,是一种有效的预防治疗措施[1-2]。但某些接受HAART治疗的患者即使在HIV-1 RNA表达下降和CD4细胞计数上升的情况下,病情仍出现恶化,表现为已治愈的机会感染复发或新增感染,并可能导致血培养阴性脑膜炎或坏死性淋巴结炎等炎症反应,这类现象被定义为免疫重建炎性综合征(IRIS)。IRIS多发生在HAART后3~6个月,以感染性IRIS最常见。相关研究报道,HAART后IRIS发生率约为15%~25%,且不同人群间发病率存在差异[3-4]。本研究观察HIV感染者/艾滋病(AIDS)患者HARRT后IRIS发生率和相关临床特征,并初步探讨IRIS发生的潜在影响因素。
1资料与方法
1.1 一般资料
选取2004年6月—2013年6月于新疆医科大学第一附属医院接受HAART治疗的HIV/AIDS患者102例为研究对象,均经新疆维吾尔自治区疾病预防控制中心或所在地区市级疾病预防控制中心HIV抗体确认实验室血检阳性,且符合《国家免费艾滋病抗病毒药物治疗手册》关于启动HAART治疗要求。其中男68例,女34例,平均(36.8±10.1)岁。HIV传播途径:经性传播75例,经血液传播20例(包括不洁输血和静脉注射吸毒),不明原因7例。根据治疗手册规定启动HAART治疗并随访,随访6个月,定期随访截止时间为2014年1月,分别取HAART启动时、90 d和180 d为随访观察点。随访期间根据是否出现IRIS将患者分为IRIS组和非IRIS组。患者均签署知情同意,且研究通过医院伦理委员会批准。
1.2 方法
1.2.1治疗方法:患者抗病毒药物方案:奈韦拉平(NVP)+齐多夫定(AZT)+拉米夫定(3TC)或者NVP+司他夫定(d4T)+3TC。对于NVP不能耐受患者,采用依非韦伦(EFV)+AZT+3TC或EFV+d4T+3TC。药物剂量: AZT 300 mg,2次/d; 3TC 300 mg, 1次/d; d4T 30 mg, 2次/d; EFV 600 mg, 1次/d; NVP初始剂量为200 mg, 1次/d, 若未出现肝功能异常,可增加至2次/d。
1.2.2检测方法: ① 分别于HAART开始时,开始后90 d、180 d以EDTA真空采血管采集静脉血2 mL,新鲜标本2 h内做染色处理。采用四色免疫荧光染色,用流式细胞仪测定外周血淋巴细胞中CD4+细胞、CD8+细胞的百分率,及各亚群的细胞数; ② 同上述方法,采静脉血2 mL, 2 h内离心分离血浆并置于-80 ℃备检,制备RNA样本溶液,采用HIV-1核酸扩增(PCR)荧光定量检测仪检测HIV RNA病毒载体量。
1.2.3IRIS诊断:参照艾滋病病毒相关IRIS国际网络研究组织(INSHI)关于IRIS诊断标准[5]: ① ART治疗后出现反应;接受ART治疗中且出现病毒学应答,HIV RNA病毒载体量下降>1 log10拷贝/mL; ② ART开始后感染或炎症状况暂时或一过性出现恶化; ③ 症状不能由下列情况解释: ART前已知并成功控制的感染,在病程预计时间范围内出现;药物毒性副反应; ART治疗失败;依从性不佳。
1.3 观察指标
观察期结束后,收集患者不同观测点时(HAART启动前、HAART启动后90 d和180 d)HIV RNA病毒载量、CD4+细胞计数检测资料,并比较IRIS组和非IRIS组患者上述指标差异。治疗期间定期行常规生化、影像学和病原学检查,及时记录患者并发症和其他相关临床症状。
2结果
2.1 患者一般资料
102例接受HAART治疗的患者中,随访期间有19例发生IRIS,IRIS发生率为18.6%,见表1。IRIS 和非IRIS组患者在性别比例、年龄、感染途径、HAART启动前HIV持续感染时间、HAART启动时HIV RNA病毒载量和用药方案选择上,差异无统计学意义(P>0.05)。HAART启动时CD4+细胞计数2组比较差异有统计学意义(P<0.01)。
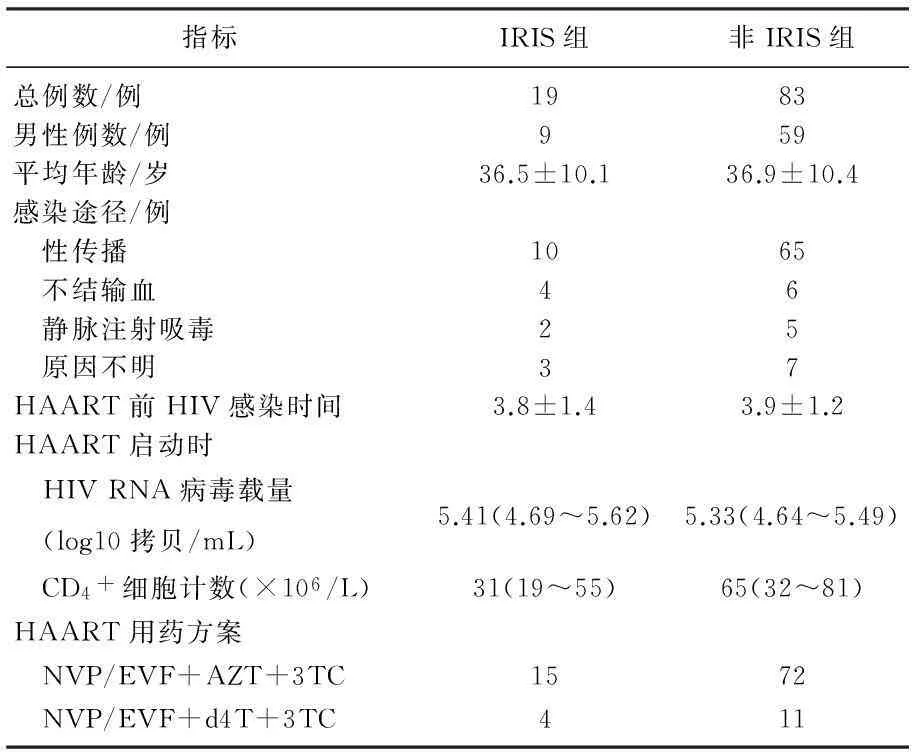
表1 2组一般资料比较
2.2 IRIS患者临床特征和转归
19例患者HAART启动后确诊IRIS时间平均33 d, 四分位间距(10~42) d。最早和最晚1例IRIS分别出现在HAART启动后第6天和第140天, 患者均出现发热、咳嗽等症状,经痰涂片和X线摄片诊断为肺结核,且HAART启动前结核抗体检测阴性。分析19例患者感染类型:结核分枝杆菌感染11例(57.9%), 主要为肺结核,其中1例患者脑部核磁共振显示异常;疱疹病毒感染5例(26.3%), 包括单纯疱疹2例和带状疱疹3例;巨细胞病毒感染3例(15.8%), 为巨细胞病毒感染IRIS视网膜炎;此外,19例IRIS患者均对症行抗感染治疗,包括糖皮质激素和非甾体类抗炎药,症状均得以缓解。
2.3 病毒和免疫学检测结果
① 基线时, 2组HIV RNA病毒载量差异无统计学意义(P>0.05), HAART启动后, 2组HIV RNA病毒载量均呈下降趋势; HIV RNA病毒载量较基线变化值比较, 2组在90 d时差异有统计学意义(P<0.01), 但在180 d时差异无统计学意义(P>0.05); ② 基线时, 2组CD4+细胞计数差异有统计学意义(P<0.01), HAART启动后,2组HIV RNA病毒载量均呈下降趋势; CD4+细胞计数较基线变化值比较, 2组在90 d和180 d时差异有统计学意义(P<0.01)。见表2。
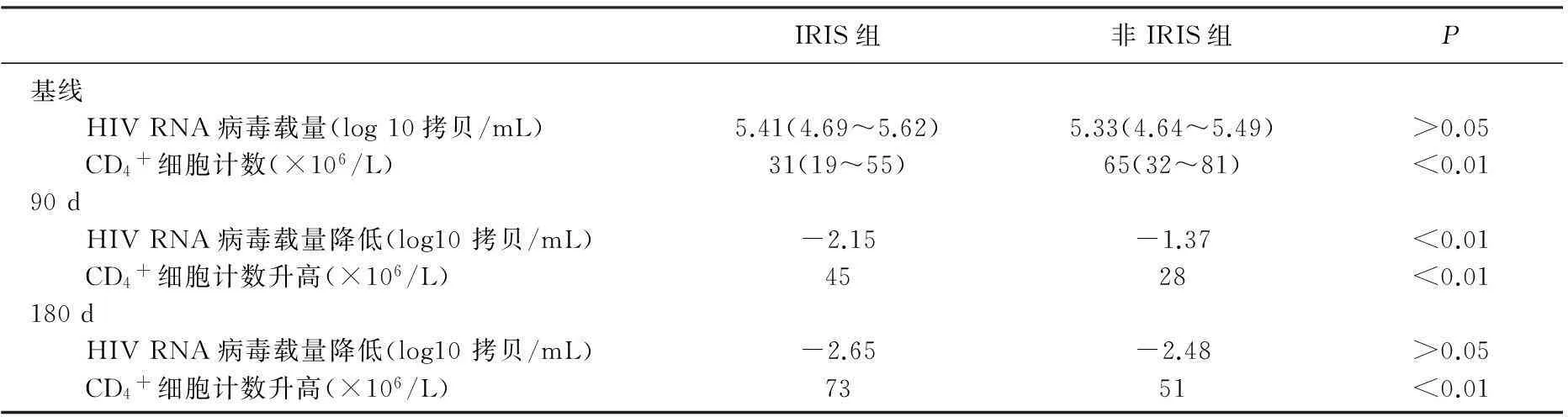
表2 HAART启动后HIV RNA病毒载量和CD4+较基线值变化
2.4 IRIS相关危险因素分析
将HAART启动时CD4+细胞计数,HAART启动后HIV RNA病毒载量和CD4+细胞计数变化纳入多因素回顾分析。根据IRIS是否发生(无设为0,有设为1)作为因变量,对HAART启动时CD4+细胞计数, HAART启动后HIV RNA病毒载量和CD4+细胞计数变化分别赋值(HIV RNA病毒载量变化: <2 log10拷贝/mL 设为1, >2 log10拷贝/mL设为2; CD4+细胞计数变化: <50×106个/L设为1, >50×106个/L设为2)作为自变量,进行多元逐步logistic回归分析,结果显示,HAART启动时CD4+细胞计数和HAART启动后HIV RNA病毒载量变化(>2 log10拷贝/mL)是IRIS发生的危险因素,见表3。
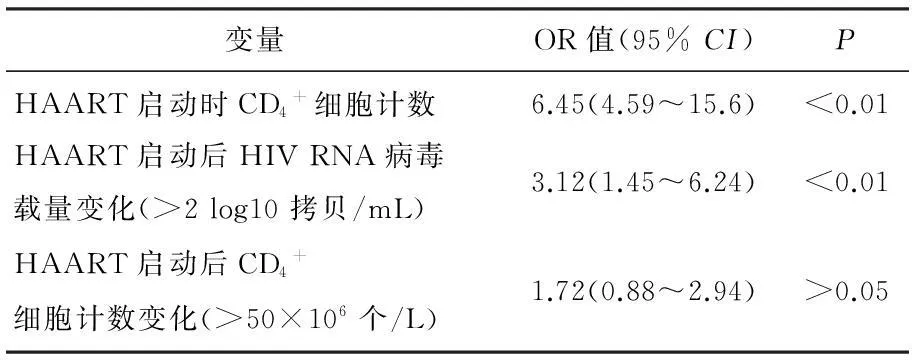
表3 IRIS发生危险因素分析
3讨论
艾滋病患者由于细胞免疫功能受损,易发生多种机会性感染。当ART重建患者免疫系统后,原先的潜伏性感染会转变为显性感染,导致机体出现严重的感染症状。目前, IRIS发生机制尚未明确,可能解释为: ① 免疫缺陷患者感染时自然免疫反应与获得性免疫反应协调功能失衡[6]。Barber等[7]通过建立IRIS小鼠模型,认为由于存在CD4细胞缺乏,免疫移植后患者感染病原菌后,巨噬细胞因CD4+T细胞产生的干扰素(IFN)-γ不足而无法完全活化,导致病原菌大量繁殖。当机体免疫重建后, IFN-γ大量产生并进一步活化巨噬细胞,释放促炎症介质,造成组织器官炎症反应; ② 与抗原特异性CD4+T细胞有关[8]。Wilson等[9]则认为IRIS发生与T细胞针对特异性抗原扩增和失调导致的免疫反应有关。此外,也有学者从基因层面考虑,IRIS发生于部分携带特殊人类白细胞抗原(HLA)的等位基因有关。
本研究中, 102例HIV病毒感染患者中有18.6%(19/102)出现IRIS, 这与相关文献报道基本一致[10-11]。IRIS多发生在ART治疗后3个月内,可累及全身各个组织器官,通常根据病因分为感染性和非感染性。其中感染性以杆菌感染(结核分歧杆菌、鸟分支歧菌等),病毒感染(带状疱疹病毒、单纯疱疹病毒等)和真菌感染(隐球病菌的)多见[12]。本研究19例病例中,有17例(89.5%)在HAART启动后90 d内出现IRIS, 感染类型主要为结核分歧杆菌感染11例(57.9%), 其他依次疱疹病毒感染5例和巨细胞病毒感染3例。
HIV感染最明确的免疫学特征是CD4+细胞计数明显下降,而ART后快速重建的免疫系统可能与IRIS产生密切相关[13]。有研究显示,患者CD4+细胞计数<100×106个/L时启动HAART会增加患者IRIS出现的风险。本研究中,2组患者HAART启动后CD4+细胞计数均呈现上升趋势, HAART启动时IRIS组患者CD4+细胞计数显著低于非IRIS组。这可能是因为CD4+细胞计数越低,患者机会感染危险越高,进行性免疫损害越严重,机体对免疫功能自身稳态调节能力越差所致[14]。另一方面, HIV RNA病毒载量在HAAR启动后变化程度显著影响IRIS发生[15], 本研究分析结果显示, HIV RNA病毒载量变化(>2 log10拷贝/mL)是IRIS发生的危险因素。Yukari等[16]研究发现, HIV RNA下降>2.5 log10拷贝/mL是IRIS发生的独立危险因素。
IRIS的预防和治疗相对棘手,除了在患者出现严重免疫抑制之前行HAART治疗外,在HAART启动前彻底筛查活动性机会感染也相当重要。有研究[17]显示,机会感染确诊后过早行HAART是诱发IRIS的危险因素,世界卫生组织建议对CD4+细胞计数<200个/μL患者在抗结合治疗2周至2个月后开展HAART[18]。本研究中, 19例患者经皮质激素和非甾体类药物治疗后,炎症反应均有所缓解,但由于观察时间较短,故观察期外患者疾病转归无法统计。
参考文献
[1]Cohen M S, Chen Y Q, McCauley M, et al. Prevention of HIV-1 infection with early antiretroviral therapy[J]. N Engl J Med, 2011, 365(6): 493.
[2]Granich R, Gupta S, B Suthar A, et al. Antiretroviral therapy in prevention of HIV and TB: update on current research efforts[J]. Curr HIV Res, 2011, 9(6): 446.
[3]Beatty G W. Immune reconstitution inflammatory syndrome [J]. Emerg Med Clin North Am, 2010, 28(2): 393.
[4]陈武, 刘薇芝, 胡汉昆, 等. 免疫重建炎性综合征研究进展[J]. 中国全科医学, 2012 (33): 3776.
[5]Haddow L J, Colebunders R, Meintjes G, et al. International Network for the Study of HIV-associated IRIS (INSHI) Cryptococcal immune reconstitution inflammatory syndrome in HIV-1-infected individuals: proposed clinical case definitions [J]. Lancet Infect Dis, 2010, 10(11): 791.
[6]Muller M, Wandel S, Colebunders R, et al. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2010, 10(4): 251.
[7]Barber D L, Andrade B B, Sereti I, et al. Immune reconstitution inflammatory syndrome: the trouble with immunity when you had none[J]. Nat Rev Microbiol, 2012, 10(2): 150.
[8]Mahnke Y D, Greenwald J H, DerSimonian R, et al. Selective expansion of polyfunctional pathogen-specific CD4+T cells in HIV-1-infected patients with immune reconstitution inflammatory syndrome[J]. Blood, 2012, 119(13): 3105.
[9]9 Wilson E M P, Sereti I. Immune restoration after antiretroviral therapy: the pitfalls of hasty or incomplete repairs [J]. Immunological Reviews, 2013, 254(1): 343.
[10]10 Ratnam I, Chiu C, Kandala N B, et al. Incidence and risk factors for immune reconstitution inflammatory syndrome in an ethnically diverse HIV type 1-infected cohort[J]. Clin Infect Dis, 2006, 42(3): 418.
[11]Murdoch D M, Venter W D F, Feldman C, et al. Incidence and risk factors for the immune reconstitution inflammatory syndrome in HIV patients in South Africa: a prospective study[J]. Aids, 2008, 22(5): 601.
[12]张晓宁, 姚煦. 免疫重建炎性综合征的研究进展[J]. 国际皮肤性病学杂志, 2014, 40(5): 295.
[13]郑煜煌, 刘猛, 周华英, 等. 艾滋病 HAART 治疗免疫重建炎性综合征的免疫机制初步研究[J]. 中华微生物学和免疫学杂志, 2011, 31(1): 62.
[14]潘珂君, 买买提艾力, 张跃新. 艾滋病高效抗病毒治疗时期的免疫重建综合征及处理措施[J]. 中华临床感染病杂志, 2009, 2(3): 187.
[15]Shelburne S A, Visnegarwala F, Darcourt J, et al. Incidence and risk factors for immune reconstitution inflammatory syndrome during highly active antiretroviral therapy[J]. Aids, 2005, 19(4): 399.
[16]Manabe Y C, Campbell J D, Sydnor E, et al. Immune reconstitution inflammatory syndrome: risk factors and treatment implications[J]. J Acquir Immune Defic Syndr, 2007, 46(4): 456.
[17]Bonham S, Meya D B, Bohjanen P R, et al. Biomarkers of HIV immune reconstitution inflammatory syndrome[J]. Biomark Med 2008, 2(4): 349.
[18]陈武, 刘薇芝, 胡汉昆, 等. 免疫重建炎性综合征研究进展[J]. 中国全科医学, 2012 (33): 3776.
Study on clinical features of HAART associated immune reconstitution inflammatory syndrome and its potential risk factors
HU Liping, Nurbiya·Abdul Keyoumu, PAN Kejun, Yifare·Maitiaili,
Maitiaili·Wubuli, LU Xiaobo, ZHANG Yuexin
(DepartmentofInfectiousDisease,TheFirstAffiliatedHospitalofXinjiangMedical
University,Urumchi,Xinjiang, 830054)
ABSTRACT:ObjectiveTo observe clinical features of highly active anti-retroviral therapy (HAART) associated immune reconstitution inflammatory syndrome (IRIS) and explore its potential risk factors. MethodsA total of 102 HIV/AIDS patients treated with HAART from June 2003 to June 2013 were selected and followed up for 6 months. Blood sample were collected before HAART, 90 days and 180 days after HAART in order to detect level of HIV RNA viral load and CD4+cell count. Patients were assigned to IRIS group (n=19) and non-IRIS group (n=83) according to the occurrence of IRIS.ResultsThe incidence of IRIS was 18.6%(19/102), and the average length from initiation to IRIS occurrence was 33 days, and mycobacterium tuberculosis infection was the main infection type (57.9%,11/19). There was significant difference in CD4+cell count at baseline between the IRIS group and the non-IRIS group (P<0.01). After HAART initiation, the HIV RNA viral load declined and CD4+cell count increased in both groups. A correlation was found between IRIS occurrence, the CD4+cell count at baseline (OR=6.45, 95% CI∶4.59~15.6) and changes(>2 log10 copies/mL) of HIV RNA viral load (OR=3.12, 95% CI∶1.45~6.24). ConclusionIRIS usually occur within 3 months after HAART initiation. The lower level of CD4+cell count at baseline, the greater change of HIV RNA viral load after HARRT initiation, and this correlation may indicate the higher risk of IRIS.
KEYWORDS:human immunodeficiency virus;highly active anti-retroviral therapy; immune reconstitution inflammatory syndrome; mycobacterium tuberculosis
通信作者:买买提艾力·吾布力, E-mail: mamatali@126.com
基金项目:全国全球基金艾滋病项目2012年支持社会组织参与艾滋病防治工作项目(CSO-2012-活-15)
收稿日期:2014-12-17
中图分类号:R 512.91
文献标志码:A
文章编号:1672-2353(2015)07-021-04DOI: 10.7619/jcmp.201507005

