雷公藤内酯醇对前列腺癌PC-3细胞中的白细胞介素8的表达调节作用
刘彼得, 冯倩倩, 顾 晓, 李 巍
(1. 扬州大学医学院 临床医学系, 江苏 扬州, 225001;
2. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州, 225001)
雷公藤内酯醇对前列腺癌PC-3细胞中的白细胞介素8的表达调节作用
刘彼得1,2, 冯倩倩1,2, 顾晓1,2, 李巍1,2
(1. 扬州大学医学院 临床医学系, 江苏 扬州, 225001;
2. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州, 225001)
摘要:目的探讨雷公藤内酯醇对前列腺癌PC-3细胞中白细胞介素8(IL-8)信号分子的表达影响。方法采用ELISA方法检测雷公藤内酯醇(10、30、50 nmol/L)处理后PC-3细胞分泌至培养基中的IL-8蛋白水平变化;采用qRT-PCR方法检测雷公藤内酯醇(10、30、50 nmol/L)作用下IL-8的mRNA水平变化;构建IL-8的启动子荧光素酶报告基因,并转染至前列腺癌细胞中,使用双荧光素酶报告基因检测系统检测IL-8启动子活性在雷公藤内酯醇作用下的变化情况。采用Wester Blotting方法检测雷公藤内酯醇作用后细胞内的IL-8的两个受体(CXCR1和CXCR2)的表达变化情况。结果雷公藤内酯醇处理后,PC-3细胞分泌至培养基中的IL-8的蛋白量有显著下调,但IL-8的mRNA水平及其启动子活性均未发生改变。对IL-8的受体的蛋白水平检测结果表明,CXCR1和CXCR2受影响不显著。结论雷公藤内酯醇通过下调IL-8的分泌来下调IL-8信号的活性,该作用是对IL-8的转录后的蛋白水平的调控机制。
关键词:雷公藤内酯醇; 前列腺癌; 白细胞介素-8
前列腺癌(PCa)在美国男性肿瘤致死原因中排第2位[1], 近年来中国前列腺癌的发病率和死亡率也明显上升[2]。前列腺癌患者血清白介素-8(IL-8)等炎症分子的含量要明显高于正常组,并且IL-8的血清含量可能作为此疾病的预后指标[3]。同时原位杂交实验[4]表明,前列腺癌组织中肿瘤细胞内IL-8的mRNA表达随疾病的恶化程度升高。免疫组化的研究[5-6]结果表明, 去势抵抗性前列腺癌(CRPC)细胞中高表达IL-8, 并且IL-8的高表达可能是激素去除治疗引起的。IL-8的过表达与前列腺癌细胞的生长及对药物治疗的不敏感有关[7]。因此下调IL-8信号活性可能对前列腺癌治疗有积极的意义。
雷公藤内酯醇(triptolide)提取自中药雷公藤(tripterygiumwilfordii), 具有免疫抑制、抗肿瘤等生物活性。雷公藤内酯醇的14-琥珀酰钠盐被合成为前药,进行过临床I期实验研究其抗肿瘤活性[8]。根据前期研究[9], 雷公藤内酯醇对前列腺癌PC-3细胞的生长有强烈的抑制作用。CRPC细胞株PC-3中有IL-8 组成型高表达[10]。本研究采用该细胞株对雷公藤内酯醇作用后细胞的IL-8分泌及其受体(CXCR1和CXCR2)的表达情况进行检测,分析雷公藤内酯醇作用的可能机制。
1材料与方法
1.1 细胞培养
PC-3细胞购自中国科学院典型培养物保藏委员会细胞库。细胞培养于含10%胎牛血清(Clark)的Ham′s F12培养基(Hyclone),在37 ℃、5% CO2的饱和湿度环境下培养。每3~4 d传代1次。
1.2 细胞分泌的IL-8水平检测
细胞接种于24孔板(5×104/孔),预培养24 h。更换培养基为含雷公藤内酯醇(0、10、30、50 nmol/L)的培养基(含0.1% DMSO), 培养48 h后,细胞刮刀将细胞从板底部分离,将全部孔内容物转移至离心管,离心收集培养基上清,沉淀PBS清洗2次后采用细胞裂解液裂解并检测裂解蛋白含量。培养基上清使用PBS 100倍稀释后使用ELISA试剂盒(博士德)检测细胞分泌的IL-8蛋白水平。ELISA结果使用细胞裂解液蛋白含量标准化。
1.3 qRT-PCR
PC-3细胞以2×105/孔的浓度接种于6孔板,预培养24 h。TP(0、10、30、50 nmol/L,n=3)处理48 h, Trizol法提取细胞总RNA, 使用反转录试剂盒(宝生物)进行反转录,并使用Sybr Green实时定量试剂盒(罗氏)对IL-8的mRNA表达量进行检测。引物为IL-8 SY F和IL-8 SY R, 序列见表1。
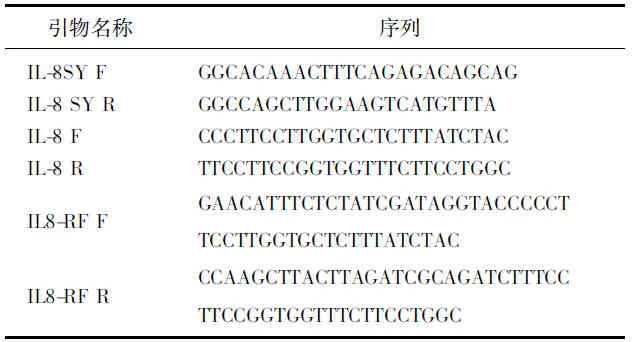
表1 引物序列
1.4 双荧光素酶报告基因实验
采用RF克隆法[11-12]将IL-8上游启动子片段克隆至pGL3-Basic质粒来构建报告基因载体。引物见表1。以人前列腺癌PC-3细胞的基因组DNA(采用Takara DNAiso试剂盒分离)为模板,使用引物IL-8 F和IL-8 R及PrimeSTAR-HS DNA聚合酶(宝生物)扩增IL-8基因-1164/+133序列,电泳并进行胶回收纯化产物。采用RF克隆引物IL8-RF F和IL8-RF R(引物序列见表1,引物各含有25 bp的IL-8片段序列和25 bp pGL3-basic质粒待插入序列,大写字母为载体互补序列,小写字母为IL-8启动子互补序列),以上述胶回收产物为模板进行PCR,获得带有pGL3-Basic片段的IL-8引物片段,电泳后进行胶回收纯化(Axygen小量胶回收试剂盒)。采用此产物作为RF克隆引物进行RF克隆,具体实验流程如下: ① RF I反应体系包含200 ng pGL3-basic, 10 μL 5×PCR buffer, 560 ng引物,于95 ℃加热2 min, 立即冷却至4 ℃; ② RF II反应体系:向RF I中加入8 mmol/L dNTPs和1.25 U PrimeSTAR HS DNA聚合酶,进行PCR反应: 72 ℃ 5 min, 98 ℃ 10 s, 70 ℃ 5 s, 72 ℃ 5 min, 15个循环,每个循环降温1 ℃; 98 ℃ 10 s, 55 ℃ 5 s, 72 ℃ 5 min, 20个循环; 72 ℃ 7 min, 4 ℃结束反应。取10 μL RF II反应产物加入0.5 μL DpnI (10 U/μL), 37 ℃消化2 h以降解DNA甲基化的母质粒(pGL3-basic)。用热激法将2 μL消化产物转化至感受态大肠杆菌(DH5α, Takara)中,使用promega提供的引物序列RV3和GL2以及taq DNA聚合酶(Takara)进行菌落PCR鉴定。菌落PCR筛选出阳性菌落并进行测序鉴定。质粒命名为pGL3-IL8。
PC-3细胞接种至24孔细胞培养板, 37 ℃培养24 h至细胞达到70%~80%融合。更换opti-MEM培养基(Gibco),采用FuGene HD试剂(Promega)转染0.7 μg质粒(包含0.6 ng荧光素酶报告质粒, 0.09 μg pcDNA3和0.01 μg pCMV-Renilla质粒)至PC-3细胞中。37 ℃孵箱培养6 h后换Ham′s F12(含10% FBS)培养基,孵箱培养过夜, TP (0、30、50 nmol/L)处理24 h。用PBS (pH 7.4)清洗细胞,每孔加入100 μL裂解液(Promega)裂解细胞,取10 μL细胞裂解产物,使用双荧光素酶活性检测试剂盒(Promega)检测裂解液中的荧光素酶活性(荧光定量酶标仪, Synergy 2, BioTech), 计算萤火虫荧光素酶的化学发光值与内参海肾荧光素酶化学发光值的比值(F/R)。
1.5 Western Blot分析
PC-3细胞以2×105/孔的浓度接种于6孔板,预培养24 h。TP(0、10、30、50 nmol/L,n=3)处理48 h, 提取细胞总蛋白,采用碧云天BCA试剂盒定量蛋白浓度。细胞提取物进行10% SDS/PAGE凝胶并电泳(上样量30 μg), 转移蛋白至PVDP膜,5%脱脂奶粉的TBS封闭;用TBST洗涤1次,分别加入抗CXCR1抗体(1∶1 000稀释, Proteintech)、抗CXCR2抗体(1∶1 000稀释,Proteintech)和抗β-actin抗体(1∶1 000稀释,中杉金桥), 4 ℃摇床过夜,加入HRP-山羊抗兔二抗或HRP-山羊抗小鼠二抗(1∶5 000稀释,中杉金桥),室温摇床孵育1 h, ECL显色,用化学发光凝胶成像系统成像(FluorChem FC2, Alpha Innotech)。
1.6 统计学分析
数据统计分析采用GraphPad Prism 5统计软件,检测结果以均数±标准差表示,组内比较采用one-way ANOVA检测,P<0.05为差异有统计学意义
2结果
2.1 雷公藤内酯醇下调IL-8蛋白表达
雷公藤内酯醇作用人前列腺癌细胞PC-3后,采用ELISA方法对细胞分泌至培养基上清中的IL-8进行定量检测,ELISA结果计算得到的培养基中的IL-8使用细胞蛋白浓度进行标准化。PC-3细胞分泌IL-8,而雷公藤内酯醇在10、30、50 nmol/L的浓度下,均显著抑制了PC-3细胞向培养基中分泌IL-8。见图1。
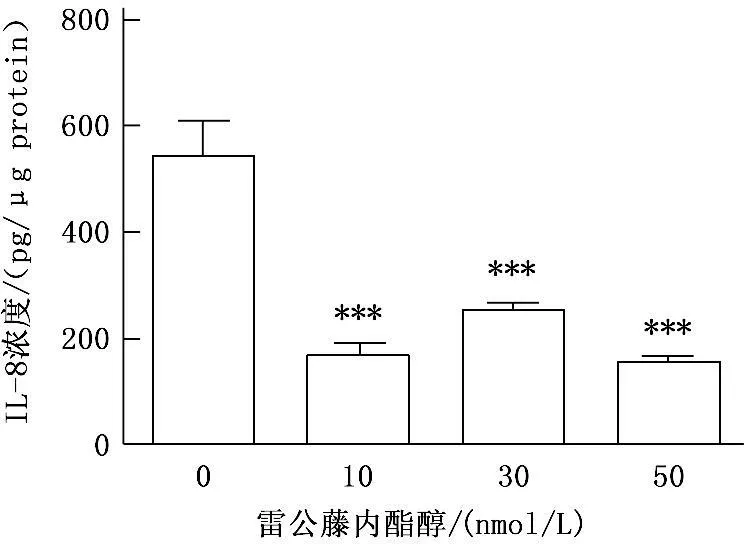
***P<0.001
图1雷公藤内酯醇处理PC-3细胞48 h后
细胞分泌IL-8的变化情况
2.2 IL-8的mRNA水平和启动子活性不受TP的调控
IL-8的调控可能是转录水平也可能是转录后水平,为进一步明确转录调控的机制,采用qRT-PCR和构建启动子分别对IL-8的mRNA水平和启动子的转录活性进行了分析。qRT-PCR结果显示,雷公藤内酯醇虽然在10、30、50 nmol/L的浓度下引起了蛋白分泌的改变,但是PC-3细胞中的IL-8的mRNA水平在相同的药物浓度下未见任何显著变化(图2),提示对mRNA水平的调控可能不是关键的调控机制。为进一步确认转录调控不参与雷公藤内酯醇对PC-3细胞中IL-8的下调控机制,采用RF克隆法构建了IL-8启动子报告基因,菌落PCR和测序鉴定证明插入片段正确且无突变,该质粒命名为pGL3-IL8。将pGL3-IL8和pRL-CMV共转染至PC-3细胞,采用双荧光素酶实验对雷公藤内酯醇作用后IL-8的启动子活性进行分析。如图3所示,雷公藤内酯醇处理后相对荧光素酶活性无显著变化,提示雷公藤内酯醇不影响IL-8的启动子活性。
2.3 CXCR1和CXCR2的表达水平变化
IL-8通过作用于其受体(CXCR1和CXCR2)发挥作用,采用Western blotting方法对雷公藤内酯醇处理后PC-3细胞中的这两个受体的表达情况进行了分析。在实验中使用的各个雷公藤内酯醇的浓度下,CXCR1和CXCR2的蛋白水平均无显著影响(图4)。
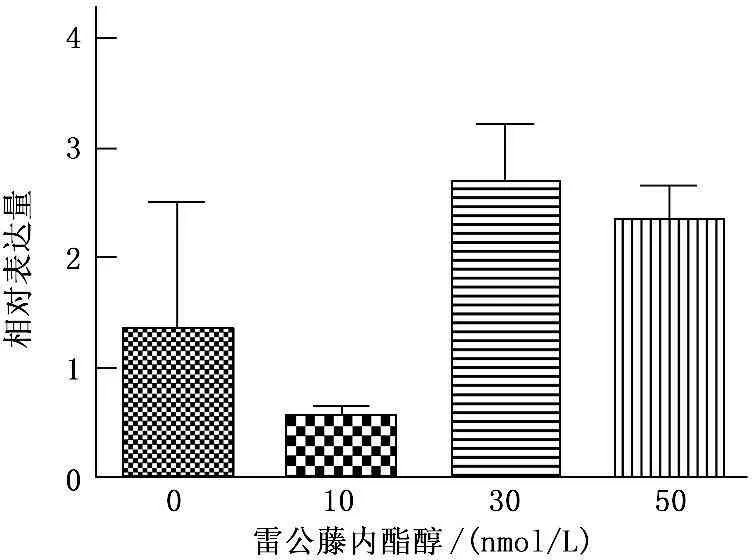
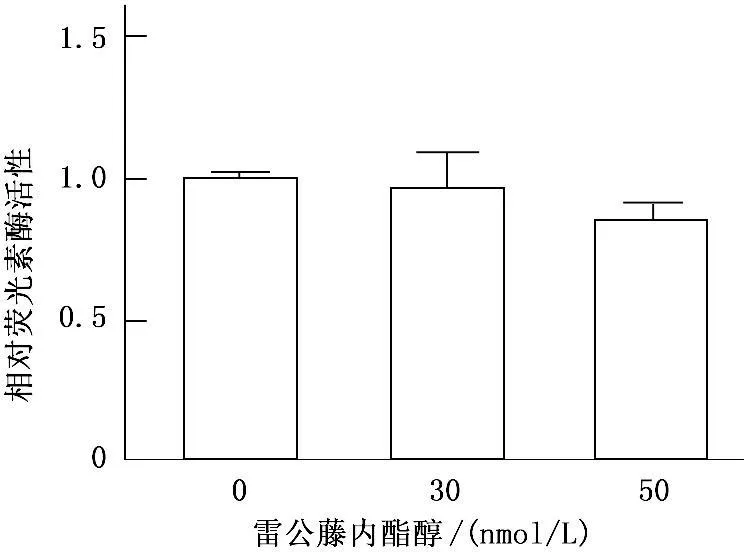
图2 雷公藤内酯醇处理PC-3细胞后48 h的qRT-PCR检测细胞内IL-8的mRNA水平变化
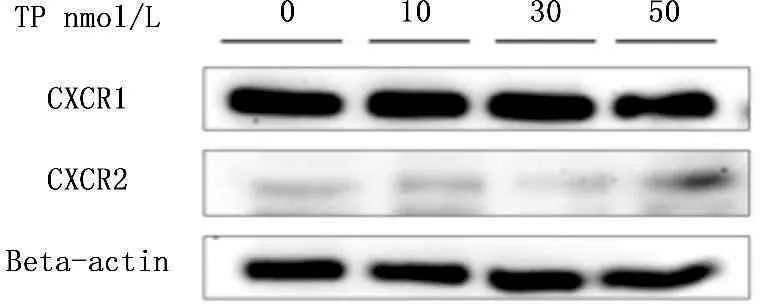
图3 雷公藤内酯醇(30、50 nmol/L)处理转染了pGL3-IL8的启动子报告基因载体的PC-3细胞后细胞内的荧光素酶活性的变化
图4雷公藤内酯醇处理PC-3细胞48 h后Western blotting检测细胞内的CXCR1和CXCR2的表达变化情况(TP: 雷公藤内酯醇)
3讨论
本研究结果表明,雷公藤内酯醇对前列腺癌PC-3细胞中的IL-8的分泌有非常显著的抑制作用。IL-8是重要的促炎症因子,最初发现的活性为引发中性粒细胞趋化和脱颗粒。近年来的进一步研究发现, IL-8也可作用于肿瘤细胞,刺激肿瘤细胞的增殖,与肿瘤的发生和发展密切相关。体外利用激素敏感的前列腺癌细胞株LNCaP和LAPC4实验研究[7, 13]表明,IL-8支持激素敏感的前列腺癌在激素去除的情况下生长,并IL-8可能是前列腺癌转变为CRPC的关键因子, IL-8通过诱导酪氨酸及丝氨酸/苏氨酸激酶活性诱导前列腺癌细胞在激素去除的情况下增殖并转移。对激素非依赖的前列腺癌细胞中IL-8信号通路的干扰可以抑制CRPC 细胞的生长[14]。IL-8对这些CRPC细胞生长的刺激和对凋亡的抑制作用也可能是AIPC对化疗不敏感的机制之一。前列腺癌中过表达IL-8 造成前列腺癌细胞对多西紫杉醇耐药[7]。此外,采用siRNA抑制IL-8表达可增强AIPC细胞株PC-3和DU145对多西紫杉醇、星状孢子素和雷帕霉素这些化疗药物的敏感性[10,15]。这些报道提示,雷公藤内酯醇对IL-8的抑制可能会有助于CRPC的治疗,可能是其对抗前列腺癌细胞的活性机制之一。
虽然雷公藤内酯醇对前列腺癌PC-3细胞中的IL-8的分泌有非常显著的抑制作用,但是IL-8的转录调控及其他mRNA水平的调控作用均无显著的变化。同时IL-8的细胞表明受体CXCR1和CXCR2在PC-3细胞中的表达也无显著变化。提示雷公藤内酯醇对IL-8信号的作用主要是通过对IL-8的转录后的调控机制实现的。据报道[16-17]雷公藤内酯醇是蛋白酶体抑制剂,可抑制蛋白的泛素化降解过程,提示雷公藤内酯醇对蛋白水平可能有直接调控作用。NF-κB被认为与前列腺癌的进展有密切关系,其过表达与CRPC的发生有关[18]。有报道[19-20]认为NF-κB是IL-8转录调控的重要机制,而p38为IL-8 mRNA水平稳定性调控的关键机制。但也有研究[21]证实NF-κB被证实有调控IL-8释放的能力。NF-κB的主要调控途径之一为PI3K/AKT信号通路[22], 但前列腺癌中最为常见的是PTEN的缺失导致PI3K/AKT过度活化,并降解NF-κB的抑制因子IκBα, 导致了NF-κB的过度活化。本研究也证实在PC-3细胞中,雷公藤内酯醇在10、30、50 nmol/L下可下调细胞内的NF-κB表达(该结果未发表)。提示雷公藤可能通过这些机制直接调节IL-8的水平。
综上所述,本研究结果表明,雷公藤内酯醇对前列腺癌PC-3细胞中的IL-8的分泌有非常显著的抑制作用。但是IL-8的转录调控及其他mRNA水平的调控作用均无显著变化。同时雷公藤内酯醇对PC-3细胞表面的IL-8受体CXCR1和CXCR2表达也无显著影响。雷公藤内酯醇对IL-8的抑制可能会有助于CRPC的治疗,可能是其对抗前列腺癌细胞的活性机制之一。
参考文献
[1]Siegel R, Ma J, Zou Z, et al. Cancer Statistics, 2014[J]. Ca-a Cancer Journal for Clinicians, 2014, 64: 9.
[2]Gu F L. Changing constituents of genitourinary cancer in recent 50 years in Beijing[J]. Chinese Medical Journal, 2003, 116: 1391.
[3]Veltri R W, Miller M C, Zhao G, et al. Interleukin-8 serum levels in patients with benign prostatic hyperplasia and prostate cancer[J]. Urology, 1999, 53: 139.
[4]Uehara H, Troncoso P, Johnston D, et al. Expression of interleukin-8 gene in radical prostatectomy specimens is associated with advanced pathologic stage[J]. Prostate, 2005, 64: 40.
[5]Huang J, Yao JL, Zhang L, et al. Differential expression of interleukin-8 and its receptors in the neuroendocrine and non-neuroendocrine compartments of prostate cancer[J]. The American journal of pathology, 2005,166: 1807.
[6]Murphy C, McGurk M, Pettigrew J, et al. Nonapical and cytoplasmic expression of interleukin-8, CXCR1, and CXCR2 correlates with cell proliferation and microvessel density in prostate cancer[J]. Clinical cancer research: an official journal of the American Association for Cancer Research, 2005, 11: 4117.
[7]Araki S, Omori Y, Lyn D, et al. Interleukin-8 is a molecular determinant of androgen independence and progression in prostate cancer[J]. Cancer research, 2007, 67: 6854.
[8]Fidler J M, Li K, Chung C, et al. PG490-88, a derivative of triptolide, causes tumor regression and sensitizes tumors to chemotherapy[J]. Molecular Cancer Therapeutics, 2003, 2: 855.
[9]Li W, Liu Y, Li X-X, et al. MAPKs Are Not Involved in Triptolide-Induced Cell Growth Inhibition and Apoptosis in Prostate Cancer Cell Lines with Different p53 Status[J]. Planta Medica, 2011, 77: 27.
[10]Singh R K, Lokeshwar B L. Depletion of intrinsic expression of Interleukin-8 in prostate cancer cells causes cell cycle arrest, spontaneous apoptosis and increases the efficacy of chemotherapeutic drugs[J]. Molecular cancer, 2009, 8: 57.
[11]Van den Ent F, Lowe J. RF cloning: A restriction-free method for inserting target genes into plasmids[J]. Journal of Biochemical and Biophysical Methods, 2006, 67: 67.
[12]Yang F, Zhang S, Tang W, et al. Identification of the orotidine-5′-monophosphate decarboxylase gene of the oleaginous yeast Rhodosporidium toruloides[J]. Yeast, 2008, 25: 623.
[13]Lee L F, Louie M C, Desai S J, et al. Interleukin-8 confers androgen-independent growth and migration of LNCaP: differential effects of tyrosine kinases Src and FAK[J]. Oncogene, 2004, 23: 2197.
[14]Shamaladevi N, Lyn D A, Escudero D O, et al. CXC receptor-1 silencing inhibits androgen-independent prostate cancer[J]. Cancer research, 2009, 69: 8265.
[15]Wilson C, Purcell C, Seaton A, et al. Chemotherapy-induced CXC-chemokine/CXC-chemokine receptor signaling in metastatic prostate cancer cells confers resistance to oxaliplatin through potentiation of nuclear factor-kappaB transcription and evasion of apoptosis[J]. The Journal of pharmacology and experimental therapeutics, 2008, 327: 746.
[16]Wan Z, Chen X. Triptolide inhibits human immunodeficiency virus type 1 replication by promoting proteasomal degradation of Tat protein[J]. Retrovirology, 2014, 11: 88.
[17]Lu L, Kanwar J, Schmitt S, et al. Inhibition of tumor cellular proteasome activity by triptolide extracted from the Chinese medicinal plant 'thunder god vine'[J]. Anticancer research, 2011, 31: 1.
[18]Zhang L, Altuwaijri S, Deng F, et al. NF-kappa B Regulates Androgen Receptor Expression and Prostate Cancer Growth[J]. American Journal of Pathology, 2009, 175: 489.
[19]Hoffmann E, Dittrich-Breiholz O, Holtmann H, et al. Multiple control of interleukin-8 gene expression[J]. Journal of leukocyte biology, 2002, 72: 847.
[20]Hoberg J E, Yeung F, Mayo M W. SMRT derepression by the IkappaB kinase alpha: a prerequisite to NF-kappaB transcription and survival[J]. Molecular cell, 2004, 16: 245.
[21]He W, Qu T, Yu Q, et al. LPS induces IL-8 expression through TLR4, MyD88, NF-kappaB and MAPK pathways in human dental pulp stem cells[J]. International endodontic journal, 2013, 46: 128.
[22]Marques R B, Aghai A, de Ridder C M, et al. High Efficacy of Combination Therapy Using PI3K/AKT Inhibitors with Androgen Deprivation in Prostate Cancer Preclinical Models[J]. European urology, 2014, 23: 231.
论著
Role of triptolide in expression and regulation of interleukin-8 in prostate cancer PC-3 cells
LIU Bide1,2, FENG Qianqian1,2, GU Xiao1,2, LI Wei1,2
(1.DepartmentofClinicalMedicine,MedicalCollegeofYangzhouUniversity,Yangzhou,
Jiangsu, 225001; 2.JiangsuKeyLaboratoryofIntegratedTraditionalChineseandWestern
MedicineforPreventionandTreatmentofSenileDiseases,Yangzhou,Jiangsu, 225001)
ABSTRACT:ObjectiveTo explore the influence of triptolide on expression of signal molecula interleukin-8 (IL-8) in prostate cancer PC-3 cells.MethodsAfter PC-3 cells were treated with triptolide (10, 30 and 50 nmol/L), the ELISA assay was used to detect the changes of IL-8 secreted by PC-3 cells. The IL-8 mRNA change in PC-3 cells by triptolide (10, 30 and 50 nmol/L) was determined by qRT-PCR assay. The pGL3-IL8 promoter reporter plasmid was constructed, and pGL3-IL8 and pRL-CMV were transfected into PC-3 cells, and the luciferase activity was investigated by dual-luciferase reporter assay. The protein levels of IL-8 receptors (CXCR1 and CXCR2) were detected by Western Blotting assay. ResultsTriptolide decreased the secretion of IL-8 in PC-3 cells, but promoter activity and mRNA level showed no significant changes. The expressions of CXCR1 and CXCR2 did not change after triptolide treatment. ConclusionTriptolide can down regulate the IL-8 signaling activity by down regulating the secretion of IL-8 in PC-3 cells, and the mechanism might be a posttranscriptional protein level regulation.
KEYWORDS:triptolide; prostate cancer; interleukin-8
基金项目:国家自然科学基金资助项目(81102460); 江苏省高校教育厅自然基金面上项目(14KJB310026)
通信作者:李巍, E-mail: weili@yzu.edu.cn
收稿日期:2014-12-23
中图分类号:R 737.25
文献标志码:A
文章编号:1672-2353(2015)07-001-05DOI: 10.7619/jcmp.201507001

