SD大鼠C6脑胶质瘤模型建立方法的改进
李 亮,白 雪,冯文茹,周 洁*
(1.天津中医药大学第二附属医院,天津 300150; 2.天津市医药科学研究所,天津 300020)
实验研究
SD大鼠C6脑胶质瘤模型建立方法的改进
李 亮1,白 雪1,冯文茹2,周 洁1*
(1.天津中医药大学第二附属医院,天津 300150; 2.天津市医药科学研究所,天津 300020)
目的:通过对造模方法的调整,找寻建立简单易行、稳定的SD大鼠C6脑胶质瘤模型的方法。方法:对造模中接种细胞悬液数量、MRI检测造影剂的选择以及MRI检测造影剂注射方式进行改进,进行MRI以及病理学检测。结果:在对造模方法进行调整后,MRI检测可见肿瘤组织明显强化,病理学检测证实造模成功。结论:通过对造模方法进行调整,造模成功率得以提高,对造模方法有一定认识。
脑胶质瘤,动物模型,造模方法改进
脑胶质瘤是临床最常见的颅内恶性肿瘤,易复发,病死率极高[1]。阐明肿瘤细胞侵袭的潜在机制有助于提高治疗效果,需要利用动物模型来研究脑胶质瘤的侵袭性及其对大脑结构和功能的影响[2]。因此,建立成熟、稳定的脑胶质瘤动物模型,对进一步了解和研究脑胶质瘤的发病机制及治疗方法是有必要的。采用立体定向技术建立SD大鼠脑胶质瘤模型的实验方法国内外报道较多,本实验组采用文献报道较多的实验方法建立脑胶质瘤动物模型,结果成功率偏低;在对实验方法进行调整后,成功率有所提高,现报道如下。
1 材料与方法
1.1 细胞株和实验动物 C6大鼠脑胶质瘤细胞由天津医科大学总医院提供。SD大鼠,雄性,体重220~240 g,购自中国人民解放军军事医学科学院卫生学环境医学研究所,动物许可证号SCXK-(军)2009-007,动物合格证号0001506。
1.2 药品 钆双胺注射液[规格 15 ml∶4.305 g,购自通用电气药业(上海)有限公司,批号11870116]。水合氯醛[规格100 ml∶10 g,购自天津医科大学总医院,院内制剂]。康派特医用胶喷雾剂[规格喷雾型1.5 ml/支,批号120125]。
1.3 试剂 Hyclone血清(批号GDB0058;购自天津瑞博星科技有限公司)。培养基(DMEM/F12,批号1285082,购自GIBCO公司)。
1.4 仪器设备和器械 培养瓶(规格25 ml、75 ml。批号430168,购自美国Corning公司)。CO2孵育箱(C-2021型,购自TyTe公司)。台式离心机(LD4-2型,购自北京医用离心机厂)。PL-203型电子天平(购自Mettler-Toledo公司)。生物光学显微镜(日本产,Nikon)。微量进样器(规格25 μl,购自上海高鸽工贸有限公司)。西门子Verio 3.0T成像系统:层厚1.5 T,Fov 80 mm×80 mm(视野内),层距0.15 mm,冠状、矢状及横断面T1加权(TR/TE=540/22 ms),T2加权(TR/TE=4 400/22 ms),T1加权扫描。
1.5 方法
1.5.1 实验方法与改进 (1)在接种细胞数量方面,国内外学者制作C6脑胶质瘤动物模型接种的细胞数量在105~107之间[3~6]。在实验初期,本实验组采取以下方法接种:①C6大鼠脑胶质瘤细胞培养;②将处于对数生长期的细胞消化、离心后,以含琼脂糖(15 mg/ml),不含血清的DMEM/F12混合培养液制备细胞悬液,细胞浓度为3×107/ml;③SD大鼠用10%的水合氯醛麻醉,常规消毒、铺巾、切开,暴露前囟,用牙科钻于中线右3.5 mm、冠状缝后1 mm处钻孔。以颅骨表面计算,进针3.5 mm,退0.5 mm,在皮层和白质交界处,接种C6细胞,以25 μl注射器吸取细胞悬液,接种量为10 μl,注射速度1 μl/min,注射完毕留针5 min;④骨蜡封闭骨孔;⑤表面皮肤伤口用医用胶粘合。大约1 h后动物苏醒,随时观察动物的状态。观察14 d后,照射核磁。但经多次实验,未见肿瘤生长。后采取匀浆法制备细胞悬液,再次接种,效果仍不理想。因此,本实验对接种细胞数量进行提高,将接种细胞浓度调整为3×109/ml。
(2)在MRI检测造影剂选择方面,文献报道采用注射钆喷酸葡胺作为显影剂的方法[7,8]。本实验采用注射钆双胺注射液0.4 ml/只进行MRI扫描。
(3)在MRI检测造影剂注射方式方面,文献报道采用鼠尾静脉注射造影剂[9]的方法。本实验采用腹腔注射钆双胺注射液。
1.5.2 病理学检测方法 经10%福尔马林液固定脑组织标本,取材肿瘤接种部位,酒精梯度脱水,Leica EG1150H自动生物组织包埋机包埋,Leica RM2255切片机制片,HE染色,OLYMPUS显微镜观察,IDA-2000高清晰度数码显微图象分析系统采图。
2 接种方法改进结果
在接种方法改进后,接种成功率达70%左右。在MRI检测造影剂选择和注射方式方面,采用注射钆双胺注射液进行MRI扫描,成功显影脑胶质瘤接种情况。注射方式方面,采用腹腔注射钆双胺注射液成功率高,不影响MRI增强扫描的效果。
3 实验结果
3.1 一般情况 大鼠接种后3 d开始,大鼠运动量逐渐减少,攻击性下降。继而饮水进食减少,皮毛不整洁并失去光泽,精神萎靡,对侧或双侧放置反射损害,偏瘫进行性加重。后期,大鼠面部不整洁,眶周出血,对刺激反应减弱甚至呈木僵状,偶有癫痫发作。濒死前表现为极度恶液质,呼吸衰竭。
3.2 MRI检测 经MRI检测,与对照组比较,实验组SD大鼠造模成功,见图1、图2。

图1 对照组SD大鼠正常脑组织

图2 实验组SD大鼠脑组织中瘤体情况(箭头所指)
3.3 病理学检测 可见肿瘤组织血管丰富,细胞异型性明显,细胞核分裂相易见,瘤细胞恶性特征明显,未见明显包膜,呈浸润性生长,可见肿瘤组织变性,中心可见明显的出血及小片状、大片状坏死或栅栏状坏死,证实造模成功,见图3。
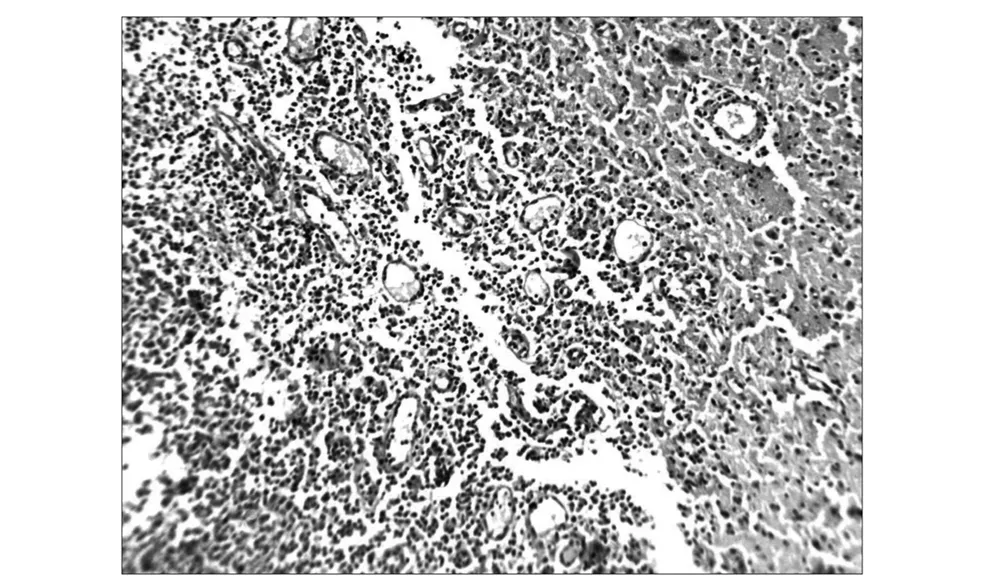
图3 肿瘤组织血管丰富
4 讨论
建立可靠、稳定的动物模型是进行各种实验研究的基础,SD大鼠C6脑胶质瘤动物模型是脑胶质瘤实验研究中应用最为广泛的模型之一[10]。
4.1 C6细胞是经N-亚硝基甲脲(N-nitrosomethy-lurea)诱发的鼠脑胶质瘤细胞,与大鼠脑组织有很好的相容性,种植成功率高,肿瘤生长快,其生长特点与人脑胶质瘤较为接近,是制作大鼠脑胶质瘤模型的理想细胞。
在实验初期,采取单细胞悬液直接接种的方法,未见肿瘤生长。考虑改进制作实体模型的方法:①采取将单细胞悬液直接接种于大鼠皮下的方法,肿瘤虽生长,但生长率为60%左右,效果不佳;②使用肿瘤组织切块直接接种,亦未见生长。
经文献检索,高斌等[11]研究发现匀浆法制备单细胞悬液省时省力,且单细胞产率高,检测准确性更好,更适合于实体组织单细胞悬液的制备。因此,本实验组将肿瘤组织剪成小块状,放入匀浆机样本槽内,加适量PBS液,打开匀浆机开关,2 min后关闭,打开样本槽,20 ml注射器抽取组织匀浆,用200目细胞滤网过滤到冰预冷的试管内;1 500 r/min×5 min离心沉淀,去上清,试管内加PBS液轻微振荡混匀后,300目细胞滤网过滤去细胞团块,500 r/min×5 min离心沉淀去上清,试管内加15 ml PBS液轻微振荡混匀后,300目细胞滤网过滤去细胞块,后用注射器接种。实验发现,经匀浆法制备的细胞悬液接种成功率为50%左右,效果仍不佳。考虑原因可能为选取的肿瘤组织成囊性,中间有液体,边缘组织韧性较大,造成匀浆不完全,影响细胞悬液质量。文献中屠珏[12]报道匀浆液移植法在制备匀浆悬液的过程中出现死亡细胞较多,接种后产生的炎症应答较强,动物状态差,容易继发感染,不推荐使用。因此,最终选择提高接种细胞数量的方法,使得实验得以顺利进行。可见接种的细胞数量与造模是否成功密切相关。并且,亦有报道称接种悬液的细胞量影响造模的成功率[13]。
4.2 在造影剂选择方面,钆双胺与钆喷酸葡胺都为小分子顺磁性造影剂,具有水溶性,不易通过正常脑组织的血脑屏障。但当血脑屏障遭受破坏导致通透性增加时,两者都可进入受损血脑屏障,进入病变组织。在影像学上,两者均能在MRI检查中,作为人体头颅核磁共振检查的造影增强剂。
但在胶质瘤小鼠模型中,MRI造影剂钆喷酸葡胺显像失败,钆双胺显像成功,分析原因可能如下:①胶质瘤对血脑屏障通透性的影响。文献报道[14]胶质瘤恶性级别与血脑屏障通透性有关。胶质瘤小鼠模型由于胶质瘤初形成,有可能对血脑屏障的影响不足以大到使造影剂通过血脑屏障的程度。②双胺与钆喷酸葡胺两药的血脑屏障通过能力不同。两药均不能通过正常脑组织的血脑屏障。当血脑屏障略有破坏时,药物理化性质就是决定药物能否通过血脑屏障的关键因素。一般来说,容易通过血脑屏障的药物,应该具有脂溶性强、亲水性弱、分子量小的特点。钆双胺为非离子型小分子造影剂,分子式为C16H26GdN5O8,分子量573.66;钆喷酸葡胺为离子型小分子造影剂,分子式为C14H20GdN3O10·2(C7H17NO5),分子量938,分子结构中多离子、多羟基结构。显然,钆喷酸葡胺分子量更大、亲水性强、亲脂性差,而钆双胺由于其分子结构多亲脂性基团、分子量小,相比较而言,当血脑屏障有较小程度破坏时,钆双胺比钆喷酸葡胺更易通过而到达病变组织。
4.3 在MRI检测造影剂注射方式方面,鼠尾静脉注射钆双胺操作较困难,成功率不高。采用腹腔注射钆双胺注射液,此法操作方便,可重复多次注射,不影响MRI增强扫描的效果。
本实验组在实验过程中,采用国内外文献报道的造模方法进行模型建立,结果不尽如人意。在改进实验方法后,造模成功率得到提高,可见,动物模型制作的结果受多种因素影响。因此,建立稳定的动物模型,需要准确定位,恰当进针深度,接种足量细胞,及选择良好的造影剂,诸多因素协调配合,方能取得较为满意的实验结果。
1 王晨.脑胶质瘤的临床治疗[J]. 医学信息, 2014, 27(4):500
2 王凯.大鼠脑胶质瘤模型的研究进展[J]. 磁共振成像, 2014, 5(1):74-80
3 李维方,张光霁,朱诚,等. VEGF反义寡核苷酸抑制荷瘤大鼠胶质瘤血管生成的作用和效果[J]. 解放军医学杂志,2003,2(82):144-145
4 Watanabe K, Sakamoto M, Somiya M,etal. Feasibility and limitations of the rat model by C6 gliomas implanted at the subcutaneous region [J]. Neurol Res, 2002, 24(5): 485-490
5 Zhang Y, Wang C, Zhang Y,etal. C6 glioma cells retrovi-rally engineered to express IL- 18 and Fas exert FasL- de-pendent cytotoxicity against glioma formation [J]. Biochem Biophys Res Commun, 2004, 325(4): 1240-1245
6 Li Y, Owusu A, Lehnert S. Treatment of intracranial rat glioma model with implant of radiosensitizer and biomodu-lator drug combined with external beam radiotherapy [J].Int J Radiat Oncol Biol Phys,2004, 58(2): 519-527
7 李承晏, 李涛, 李玲莉. 鼠脑胶质瘤模型制作方法的改良[J]. 肿瘤防治研究, 2001, 28(6):432-433
8 石键, 赵洪洋, 谭正. 大鼠脑胶质瘤模型建立与生长评估[J]. 中国临床神经外科杂志, 2006,11(2):98-100
9 姬西团, 章翔, 费舟, 等. 大鼠C- 6胶质瘤模型的建立及MRI影像学特征[J]. 中华神经外科疾病研究杂志, 2004, 3(1):5-8
10 王煜,牛洪泉,董芳永,等. 大鼠树突状细胞疫苗治疗脑胶质瘤的实验研究[J]. 中国临床神经外科杂志,2005, 10:115-117
11 高斌, 贺克武, 李嘉嘉. 剪碎法及匀浆法制备兔肌肉VX2肿瘤单细胞悬液的方法比较[J]. 中国组织工程研究与临床康复, 2007, 11(41): 8315-8317
12 屠珏, 陈方明, 周卫民,等. 不同方法建立的人大细胞肺癌裸鼠[J]. 中国比较医学杂志, 2012, 22(4): 58-63
13 高大宽,章翔,吴景文,等. 建立大鼠 C6 脑胶质瘤模型的有效方法[J]. 中华实验外科杂志, 2000, 17(1):93
14 卢建侃. 血脑屏障紧密连接在人脑胶质瘤中的变化及其分子机制[D]. 南方医科大学, 2007:15-20
2015-03-11
天津市应用基础及前沿技术研究计划(No.11JCYBJC12500)
R965
A
1006-5687(2015)03-0001-03
*通讯作者:周洁,E-mail:cnzhoujie@126.com。

