化学理论教学中培养学生反思性学习能力的实践——以“化学反应的方向”的教学为例
朱卫华(江苏省无锡市第一中学 江苏无锡 214031)
化学理论教学中培养学生反思性学习能力的实践——以“化学反应的方向”的教学为例
朱卫华
(江苏省无锡市第一中学江苏无锡214031)
摘要:高中化学课程标准提出要提高学生自主学习化学的能力,反思性学习是实现这一目标的有效方式。文章以“化学反应的方向”的教学为例,介绍了在理论教学中培养学生反思性学习能力的教学过程。
关键词:化学理论教学;反思性学习;化学反应的方向
中图分类号:
文章编号:1008-0546(2015)02-0042-03G633.8
文献标识码:B
doi:10.3969/j.issn.1008-0546.2015.02.013
一、化学理论教学中进行反思性学习的思考
高中化学课程目标中提出要提高学生“自主学习化学的能力”[1],反思性学习是实现这一目标的有效方式。所谓反思性学习,就是通过对学习活动过程的反思来进行学习。用元认知的理论来描述,就是学习者对自身学习活动的过程以及活动过程中所涉及的有关事物、材料、信息、思维、结果等学习特征的反向思考。它包含两层意思:一是对整个思维过程进行检查,检验策略是否合理,答案是否正确等;二是评估问题的解决过程中值得吸收的经验,并对认知结构进行必要的调整。因此,反思性学习不仅仅是对学习的一般性回顾或重复,而是探究学习活动中所涉及的知识、方法、思路、策略等,具有较强的科学研究性质。反思的目的也不仅仅是为了回顾过去或培养元认知意识,更重要的是指向未来的活动。通过反思性学习可以帮助学生学会学习;可以使学生的学习成为探究性、研究性的活动;可以增强学生的能力,提高学生的创造力,促进他们的全面发展[2]。
反思性学习的基本环节可以概括为以下七个阶段:反省阶段、评判阶段、察觉问题阶段、界定问题阶段、确定对策阶段、实践验证阶段、总结提高阶段。实际的反思活动中,以上七个阶段往往前后交错,界限不甚分明[2]。
化学基本理论的学习能帮助学生深入理解元素化合物知识,能促进学生的化学反应知识系统化、结构化,能帮助学生发展逻辑推理能力,能促进学生的化学素养。以化学反应的方向为例,它可以让学生了解化学反应的调控原理,让学生更全面地认识化学反应,拓展学生的视野,提升学生的综合素质。但是这节课的理论性较强,概念比较抽象,学生理解有一定的难度。因此,教学过程中,要避免填鸭式地罗列理论,应尽可能启发学生开动脑筋、动手实践,经过反省、评判、界定等理性思考之后确定方案,再通过实践验证归纳生成理论,而这恰恰是反思性学习的基本环节。
这节课的实施能让学生初步根据反应的焓变、熵变判断化学反应的方向;在反思探讨影响化学反应自发因素时,使学生体会事物的发展变化常常受多种因素制约,培养学生分析、研究问题的全面性,通过反思性学习会帮助学生学会学习,提高自主学习化学的能力;通过联系生产生活,认识到化学反应原理在生产生活中的重要作用,发展学习化学的兴趣。
二、教学过程
1.认识化学反应的方向性
为了能使学生直观地感受化学反应的方向,教师设计了以下的实验。
[引入]向盛有鸡蛋壳的烧杯中加入盐酸,其中发生了怎样的化学反应?
[学生]CaCO3+2HCl=CaCl2+H2O+CO2↑
[追问]倒过来,向氯化钙溶液中通入CO2气体,会生成沉淀吗?
[学生]思考,猜想。
[学生实验]用塑料吸管向氯化钙溶液中吹入CO2气体验证,无明显现象。
[小结]看来化学反应具有方向性,许多反应的正反应能自动进行,而其逆反应无法自动进行,又如锌与硫酸铜溶液的反应、盐酸和氢氧化钠的中和反应等等。
设计意图:熟悉的化学反应可以让学生很自然地进入探究状态,简单易行的实验验证可以顺畅引出本节课的主题。
2.反省评判,察觉能量因素
[教师]像这些正反应一样,在一定温度和压强下,无需外界帮助就能自动进行的反应,我们称之为自发反应。这些化学反应为什么能自发进行,具有怎样特征的化学反应是自发反应呢?
[提问]请大家列举你熟悉的自然界中的自发过程。
[学生]水由高处自发往低处流,石头从山坡上自发滚下。
[教师]这些自发过程有什么共同点?
[学生]自发过程发生后,体系的能量降低。
[教师]那么,怎样的化学反应能自发进行?
[学生]放热反应,反应后,体系的能量降低。
设计意图:学生通过反省、广泛搜集有关的生活经验,对它们进行认真地分析,察觉到问题的根源,并提出假设。在反思性学习的七个阶段中,察觉问题阶段是一个关键的环节,反思集中体现在此阶段。
3.实践验证,发现仅从能量因素研究反应自发性的局限性
[教师]研究表明,对于化学反应而言,绝大多数的放热反应都能自发进行,且反应放出的能量越多,反应就越完全。
[学生]验证刚才的三个自发反应。
[教师]放热反应一般能自发,那么吸热反应就一定不是自发反应吗?
[学生]思考,猜想,实验验证。少量氯化铵固体和氢氧化钡晶体置于小气球中,扎紧密封小气球后,手捏混匀固体,用手摸气球外壁。
[教师]C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.3kJ /mol、CaCO3
=CaO+CO2都是吸热反应,在高温下也是自发反应。
[学生]吸热反应也可以自发,只根据焓变判断反应是否自发是不全面的,焓变只是制约化学反应能否自发进行的因素之一。
设计意图:氯化铵固体和氢氧化钡晶体的反应会产生刺激性气体氨气,利用小气球设计成微型实验,既环保又节约试剂。学生通过实践检验以上阶段所形成的规律,这时,如果能够解释当前的疑惑,说明检验成功,问题解决了,于是进入总结提高阶段;如果不能,或者在检验过程中遇到新的具体问题,又会进入反思的第一环节,开始新的循环。
4.认识化学反应中的熵变因素
[教师]还有什么因素会制约反应能否自发呢?能不能也从生活中的现象得到启发?
[学生探索]拿出火柴盒,里面的火柴井然有序,倒出来立刻就乱了,很难恢复到原来的井然有序。
[教师]墨水滴入水中能自发扩散成无序的状态,恢复到原来的状态很难;房间收拾整齐,弄乱很容易,重新恢复原样很困难;体育课解散,同学自由活动很容易,重新集合整队很困难。
[学生领悟]有序体系都趋向于变为无序体系,趋向于混乱。化学反应也是如此,如果反应体系的混乱度增大,该反应往往能自发进行。
[资料]1850年,德国物理学家克劳修斯引入了一个新的物理量——熵,用符号S表示,来表示任何一种能量在空间中分布的混乱程度,能量分布得越混乱,熵就越大,也可以用来衡量一个体系的混乱度,体系越混乱,熵值也就越大。
[阅读]根据所给的《无机化学》中附表一些物质的熵值,归纳熵值的特点。
[学生]熵(S)——S(气)>S(液)>S(固);气体越多,体系熵越大。
设计意图:学生翻阅大学教材,查找所需的信息,有利于培养学生查阅资料的能力,提升学生的学科素养。
[提问]为什么那三个吸热反应是自发反应?
[学生]熵增的反应,所以能自发。
5.焓变和熵变走向融合
[追问]熵减的反应一定不能自发进行吗?工业上合成氨的反应和镁条燃烧的反应是熵增的反应还是熵减的反应?
[学生疑问]熵减的反应。
[教师]为什么这两个反应能自发进行?
[学生领悟]因为这两个反应是放热反应ΔH<0。看来,只根据熵变来判断反应是否自发也是不全面的,熵变也只是制约化学反应能否自发进行的一个因素。
设计意图:学生通过提出新的对策、实践验证,可以不断地总结优化,最终发现焓变和熵变是制约化学反应能否自发的两个因素。
[教师]要判断一个化学反应是否能自发进行,必须综合考虑反应的焓变和熵变,怎么综合考虑呢?
[学生]思考以下反应能否自发以及焓变和熵变:
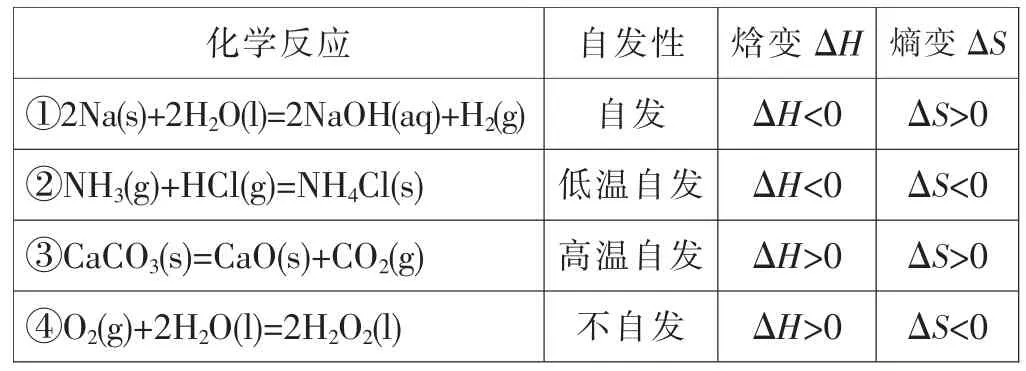
化学反应 自发性 焓变ΔH熵变ΔS ①2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) 自发 ΔH<0 ΔS>0 ②NH3(g)+HCl(g)=NH4Cl(s) 低温自发 ΔH<0 ΔS<0 ③CaCO3(s)=CaO(s)+CO2(g) 高温自发 ΔH>0 ΔS>0 ④O2(g)+2H2O(l)=2H2O2(l) 不自发 ΔH>0 ΔS<0
[学生小结]ΔH<0、ΔS>0的反应,必定自发进行;ΔH>0、ΔS<0的反应,必定不自发;ΔH<0、ΔS<0的反应,低温自发进行;ΔH>0、ΔS>0的反应,高温自发进行;看来,两个因素只满足一个的反应,能否自发取决于温度。
[化学史]1878年美国著名科学家吉布斯经过大量研究,提出了一个综合考虑焓变和熵变的公式,可以判断恒温恒压体系下化学反应能否自发进行:ΔH-T ΔS<0
[学生]利用上面的四个化学反应验证此公式。
[教师]为何向氯化钙溶液中吹入CO2,不能发生反应?
[学生]ΔH-TΔS>0,不能自发进行。
[教师]汽车尾气中的主要污染物是NO和CO,为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)=N2(g)+2CO2(g),此方案可行吗?(298K、100kPa下,该反应的ΔH=-746.8kJ/mol ΔS=-197.5J·mol-1·K-1)
[学生]低温即可自发。
[教师]低温时反应速率太慢,怎么办?
[学生]使用催化剂加快反应速率。
[教师]通常使用钯、铂作为催化剂,将其装入汽车尾气净化器中,并将净化器与汽车尾气排放管道连接在一起。利用这个装置,可以有效地将汽车尾气中的污染物NO和CO同时除去。
[教师]2H2O(g)=2H2(g)+O2(g)是焓增熵增的反应,理论上来讲高温自发,通过数据可以计算出它的分解温度为10500℃左右的高温,很难实现,因此实际可认为此反应不自发。那么如何使此反应发生呢?
[学生]电解
[教师]不自发的反应要发生需要外界帮助,主要就是指电解等方式。
设计意图:对于自发反应的定义中的“无需外界帮助”,学生会误认为加热、加压等方式,通过这个反例,可以让学生体会其真正含义。
[教师]值得注意的是,研究反应自发性只是研究了反应的可能性,实际工业生产的时候,还要考虑两个方面:1.反应的速率,有些反应比如2H2(g)+O2(g)=2H2O(g)室温能自发,但常温下因为反应速率太慢几乎不反应,此类反应为了加快反应速率,一般采用高温;2.大多数化学反应都是可逆反应,存在反应的限度,也要选择合适的反应条件,达到所需的限度。
设计意图:如果学生将化学知识应用于生产、生活实践中,可以对化学有关的社会和生活问题做出合理的判断,发展学习化学的兴趣。
反思性学习是提高学生自主学习能力的一种有效方式,当然,让学生学会反思、提高反思性学习能力,并非一朝一夕的事,它需要教师遵循“循序渐进”的原则和“始终如一”的耐心对学生进行培养,使反思性学习成为一种常态的学习方法,而不是特例。这样,常态的方法成为习惯,长期的习惯成为意识,长期的意识养成能力,实现真正意义上的反思性学习。
参考文献
[1]教育部.普通高中化学课程标准(实验)[S].北京:人民教育出版社,2003:7-8
[2]郑菊萍.反思性学习简论[J].上海教育科研,2002,(8):43-45

