单纯疱疹病毒Ⅰ型的Th细胞和B细胞表位重组核酸疫苗的构建及真核表达
刘贤洁,孙原,马小力
(1.中国医科大学附属第一医院眼科,沈阳 110001;2.华北理工大学附属医院神经内科重症病房,河北 唐山 063000)
·论著·
单纯疱疹病毒Ⅰ型的Th细胞和B细胞表位重组核酸疫苗的构建及真核表达
刘贤洁1,孙原2,马小力1
(1.中国医科大学附属第一医院眼科,沈阳 110001;2.华北理工大学附属医院神经内科重症病房,河北 唐山 063000)
目的构建单纯疱疹病毒Ⅰ型(HSV-1)糖蛋白B(gB)和糖蛋白D(gD)的Th细胞和B细胞表位重组串联核酸疫苗,并鉴定其真核表达。方法利用生物信息学分析软件预测HSV-1 gB和gD的Th细胞表位和B细胞表位,结合已发表文献,设计合成HSV-1的Th细胞和B细胞表位重组串联抗原基因(Th/B基因)。将Th/B基因定向克隆入真核表达载体pVAX1,构建真核表达质粒pVAX1-Th/B。用制备的质粒转染COS-7细胞,裂解细胞后经Western blot鉴定其蛋白表达。结果预测得到了HSV-1 gB和gD的Th细胞和B细胞表位,成功构建真核表达质粒pVAX1-Th/B,经测序确认序列正确。SDS-PAGE分离出相应大小的蛋白表达片段,经Western blot鉴定并证实该重组核酸疫苗能够在体外真核细胞中表达。结论成功构建HSV-1 Th细胞和B细胞表位重组串联核酸疫苗,并能够在体外真核细胞中表达,为HSV-1核酸疫苗的进一步研究打下基础。
单纯疱疹病毒;Th细胞和B细胞表位;核酸疫苗
单纯疱疹病毒Ⅰ型(herpes simplex virusⅠ,HSV-1)是一个嗜神经的双链DNA病毒,可以终身潜伏性感染神经元和胶质细胞。HSV-1感染宿主后引起角膜免疫病理反应并发生单纯疱疹病毒性角膜炎,感染的HSV-1长期潜伏在三叉神经节内,导致角膜反复感染而最终导致失明,是一种严重的致盲性眼病[1]。目前单纯疱疹病毒性角膜炎的治疗主要还是依赖抗病毒药物,但现有抗病毒药物不但具有一定的毒副作用,使耐药毒株增加,而且不能预防病毒感染和复发。因此,研制预防HSV-1感染及复发的疫苗具有重要意义[2,3]。本研究通过预测HSV-1糖蛋白B(glycoprotein B,gB)和糖蛋白D(glycoprotein D,gD)的Th细胞表位和B细胞表位,构建HSV-1 Th细胞和B细胞表位重组串联抗原疫苗,为今后进一步研究HSV-1核酸疫苗打下基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌种及细胞:pVAX1质粒和表达菌DH5α感受态细胞由本实验室保存。COS-7细胞为非洲绿猴的肾细胞,购自中国科学院上海细胞库。
1.1.2 分子生物学试剂:NheⅠ、XhoⅠ限制性内切酶、T4 DNA连接酶、Polymerase Taq DNA聚合酶、质粒抽提试剂盒购于大连宝生物工程有限公司。Histag抗体购于康为世纪公司,羊抗小鼠IgG-HRP购于碧云天公司,Attractene转染试剂购于QIAGEN公司,其余试剂均为国产或进口分析纯以上产品。
1.2 方法
1.2.1 HSV-1 Th细胞、B细胞表位重组串联抗原疫苗的设计:根据GenBank上公布的HSV-1(17株)的基因序列,获得gB和gD的氨基酸序列。利用生物信息学分析软件预测HSV-1 gB和gD糖蛋白抗原的Th细胞和B细胞表位。生物信息学主要组织相容性复合体Ⅰ类分子预测采用BIMAS(http://wwwbimas.cit.nih.gov/molbio/hla_bind/)和 IEDB(http:// www.iedb.org)。生物信息学B细胞表位预测采用网络服务器Bcepred(http://www.imtech.res.in/raghava/ bcepred/bcepred_submission.html)和IEDB。结合已发表的文献,优化选择抗原表位的编码基因,综合各项结果确定HSV-1 gB和gD糖蛋白抗原的Th细胞和B细胞表位。按照表位在基因组上的顺序,在各表位间添加适合的Linker设计Th细胞和B细胞表位盒,并通过蛋白二级结构预测网络服务器SOPMA(http://npsa-prabi.ibcp.fr/cgi-bin/npsa_auomat.pl? page=/NPSA/npsa_sopma.html)和蛋白酶体切割预测网络服务器PAPROC(http://www.Paproc.de)优化表位盒的构成和Linker的选择。在此基础上在表位盒中加入内质网信号引导序列(Igκ链信号序列)和泛DR辅助T细胞表位(pan-DR helper T cell epitope,PADRE),以辅助表位更好地突破主要组织相容性复合体限制性而发挥功能,加入蛋白酶有限识别基序(GPGPG)作为间隔序列,起始端引入Kozak序列[4]介导mRNA翻译起始,末端加入His标签,两端加入NheⅠ/XhoⅠ酶切位点。根据设计的表位盒,复原其核苷酸序列,并参照真核优势密码子规则进行优化,设计Th/B基因。
1.2.2 真核表达质粒pVAX1-Th/B的构建:Th/B基因由苏州金唯智生物科技有限公司合成。Th/B基因定向克隆入真核载体pVAX1构建真核表达质粒pVAX1-Th/B,将质粒pVAX1-Th/B转化DH5α感受态细胞,筛选阳性克隆,提取质粒,NheⅠ/XhoⅠ双酶切鉴定并交付金唯智公司DNA测序。
1.2.3 细胞转染:取对数生长期的COS-7细胞接种于6孔板中,每孔细胞悬液2 mL,每孔接种细胞5× 105个。于37℃、5%CO2的培养箱内平衡30 min后,加入转染试剂Attractene转染试剂和去内毒素提取的pVAX1-Th/B质粒,另设空载体转染对照组,每组均设2个复孔,用无血清的DMEM培养基于37℃、5%CO2的培养箱中培养,24 h后收集细胞。
1.2.4 Western blot鉴定蛋白表达:将收集到的细胞加入细胞裂解液,静置5 min,用低温冷冻离心机离心10 min(12 000 r/min,4℃),分离上清为所得到的蛋白质抽提物。用5×Loading Buffer和PBS稀释蛋白样品,在沸水浴中煮沸5 min,制成上样液,进行SDS-PAGE电泳(浓缩胶浓度为5%,分离胶浓度为13%,本次实验的上样体积20 μL,含40 μg蛋白,加入蛋白Marker体积为5 μL)。取适当大小的PVDF膜用“三明治”法进行转膜,转膜结束后取出PVDF膜进行封闭。以稀释比例1∶1 500的His-tag抗体为一抗工作液,倒入杂交袋中,放入封闭好的PVDF膜,压膜机封口后置于4℃冰箱过夜孵育一抗。将孵育一抗后的PVDF膜从杂交袋中取出,洗膜。以稀释比例1∶1 500的羊抗小鼠IgG-HRP为二抗工作液,倒入杂交袋中,放入漂洗好的PVDF膜,压膜机封口后置于37℃温箱45 min孵育二抗。将孵育二抗后的PVDF膜从杂交袋中取出,以ECL底物发光法在暗室进行曝光。
2 结果
2.1 HSV-1 gB和gD糖蛋白抗原的Th细胞表位和B细胞表位
利用生物信息学分析软件预测HSV-1 gB和gD糖蛋白抗原的Th细胞和B细胞表位,结合已发表文献,筛选出10个抗原表位,各抗原表位来源及氨基酸序列见表1。进一步优化表位设计,确定Th/B基因序列,设计的重组多表位串联基因长873 bp,编码280个氨基酸残基。
2.2 Western blot鉴定Th/B基因的蛋白表达
将经过SDS-PAGE电泳分离的蛋白条带经Western blot鉴定(图1),结果显示Th/B组出现了Histag的阳性识别条带,大小约30 kDa。而对照组则未见该区域条带,无目的蛋白的表达。
3 讨论
HSV-1的结构复杂,由双链DNA和病毒染色质磷蛋白组成核,20面体核壳包绕其上,核壳又被糖蛋白、碳水化合物及脂质所构成的包膜所包绕。HSV-1的包膜糖蛋白是细胞免疫和体液免疫的主要靶标,也是目前HSV疫苗的研究热点。目前已知HSV-1至少有12种糖蛋白[5],其中gB和gD是病毒复制、穿入、细胞间扩散以及病毒囊膜与感染的细胞膜相融合所必需糖蛋白。gD是抗HSV感染中重要的保护性抗原,能保护动物免受HSV的攻击,抑制潜伏感染的发生,甚至在潜伏感染已建立后,也能减轻其复发[6]。gB在疱疹病毒家族中是高度保守蛋白,是病毒复制必需蛋白,也是宿主免疫反应的主要靶抗原,能诱导体液免疫、细胞免疫和细胞毒性T淋巴细胞反应[7]。目前,以HSV gD和gB为靶标的疫苗研究是HSV疫苗研究的热点[8],已有研究证实gB和gD疫苗在预防角膜炎发生以及减少角膜新生血管形成上具有显著疗效。虽然gB疫苗或gD疫苗的单一使用均可产生一定的免疫保护作用,但不能完全避免单疱病毒性角膜炎的发生,也不能清除病毒的潜伏感染,单一接种gB或gD疫苗后部分小鼠体内仍可检测到病毒复制,说明任何单一的糖蛋白疫苗免疫作用均不完善[9],单疱病毒糖蛋白联合疫苗或多表位疫苗可能是预防和治疗HSV较为理想的疫苗。
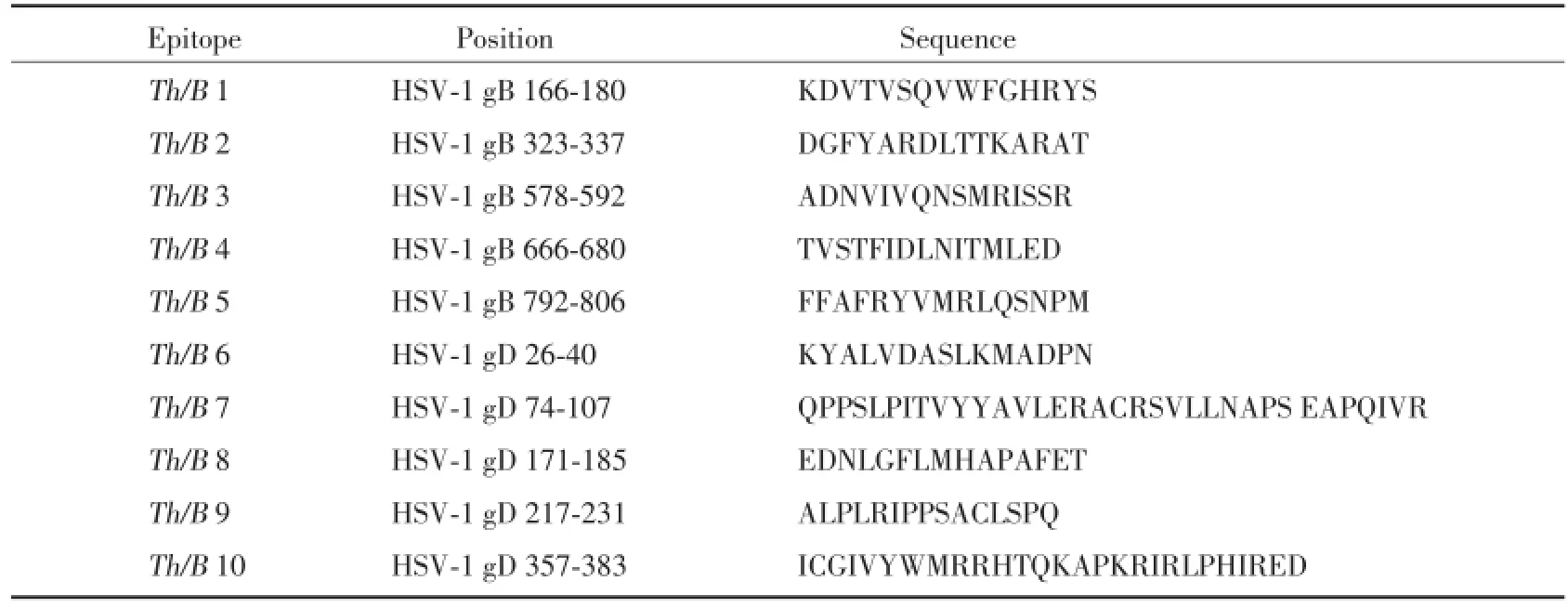
表1 重组多表位串联基因Th/B基因的抗原表位来源和序列Tab.1 Position and sequence of recombinant multi-epitope gene(Th/B gene)
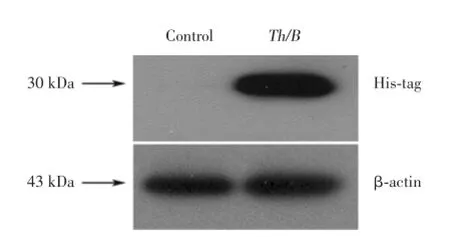
图1 重组Th/B基因的蛋白表达Fig.1 Protein expression of recombinant Th/B gene
核酸疫苗被称为最有前景的第三代疫苗,作为一种新型的免疫手段,已经在感染性疾病和肿瘤的防治中展现了巨大的潜力,日益受到关注与重视。与传统的蛋白为基础的疫苗相比,核酸疫苗不仅可激发机体的体液免疫还可激发细胞免疫,便于修饰加工、进行免疫调节,特别是可以把不同抗原的多个优势抗原表位组合制备多表位疫苗,能够对机体形成多特异性、多层次的免疫保护,远远大于单抗原的保护能力。目前新发展的基于计算机生物信息学的抗原表位预测方法,使新表位的发现效率提高10~20倍,实验工作量减少95%,节约研究成本和时间,很大程度上加快了新表位的发现效率[10],为我们研究HSV-1疫苗提供了新的思路。
因此,本研究选择HSV-1 gB和gD作为标靶抗原,应用生物信息学技术,采用计算机表位预测方法,预测HSV-1 gB和gD的Th细胞表位和B细胞表位。为使基因有效表达,在核酸5’端中加入Kozak序列(AATMG),它是真核生物mRNA 5’端帽子结构后的一段核酸序列,是提高基因表达的一个上游调控元件,可与翻译起始因子结合,介导翻译起始,增强外源基因在细胞内的表达。添加了内质网引导信号以促进表位信号更高效率的合成和折叠。另外,在设计中还加入了PADRE,由13个氨基酸残基组成(AKFVAAWTLKAAA),可以与人类的多数HLA-DR分子及部分小鼠的Ⅱ类基因分子结合。PADRE不仅能增加Th细胞的反应效能,比自然源性Th细胞表位高1 000倍,能增强核酸疫苗激发细胞免疫的能力;也可为B细胞表位及碳水化合物抗原提供辅助作用,同时诱导体液免疫及细胞免疫,对人体安全、无毒副作用。表位间采用了“GPGPG linker”,以减少表位间的干扰使之独立发挥功能。本研究对HSV-1 Th细胞、B细胞表位重组核酸疫苗进行了多步优化设计,并已证实可在真核细胞中表达,为今后的HSV-1疫苗研制打下基础。目前关于该疫苗的免疫原性和免疫保护性还有待进一步研究。
[1]Rowe AM,St Leger AJ,Jeon S,et al.Herpes keratitis[J].Prog Retinal Eye Res,2013,32:88-101.
[2]Royer DJ,Cohen A,Carr D.The current state of vaccine development for ocular HSV-1 infection[J].Expert Rev Ophthalmol,2015,10(2):113-126.
[3]高婧一,王越,赵雨杰,等.HSV-gB、gD糖蛋白重组串联抗原表位蛋白的表达及鉴定[J].中国医科大学学报,2010,39(3):181-183.
[4]苏艳,王世民,邵俊高.Kozak序列对金黄色葡萄球菌黏附因子FnBPA-A DNA疫苗诱导小鼠免疫应答的影响[J].生物工程学报,2013,29(4):458-465.
[5]Ghiasi H,Hofman FM,Cai S,et al.Vaccination with different HSV-1 glycoproteins induces different patterns of ocular cytokine responses following HSV-1 challenge of vaccinated mice[J].Vaccine,1999,17(20-21):2576-2582.
[6]Durmanova V,Mosko T,Sapak M,et al.Efficacy of recombinant herpes simplex virus 1 glycoprotein D candidate vaccines in mice[J]. Acta Microbiol Immunol Hung,2006,53(4):459-477.
[7]Caselli E,Balboni PG,Incorvaia C,et al.Local and systemic inoculation of DNA or protein gB1s-based vaccines induce a protective immunity against rabbit ocular HSV-1 infection[J].Vaccine,2000,19(9-10):1225-1231.
[8]关瑞娟,亢泽峰,李凌.HSK的包膜糖蛋白gB和gD与疫苗的研究新进展[J].国际眼科杂志,2012,12(6):1076-1077.
[9]James SH,Kimberlin DW,Whitley RJ.Antiviral therapy for herpesvirus central nervous system infections:neonatal herpes simplex virus infection,herpes simplex encephalitis,and congenital cytomegalovirus infection[J].Antiviral Res,2009,83(3):207-213.
[10]De Groot AS,Sbai H,Aubin CS,et al.Immuno-informatics:mining genomes for vaccine components[J].Immunol Cell Biol,2002,80(3):255-269.
(编辑 陈 姜)
Construction and Eukaryotic Expression of HSV-1 Th and BLymphocytes Recombinant Multi-epitope DNAVaccine
LIUXian-jie1,SUN Yuan2,MAXiao-li1
(1.Department of Ophthalmology,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Neurology,Affiliated Hospital of North China University ofScience and Technology,Tangshan 063000,China)
Objective To construct the recombinant multi-epitope DNA vaccine of HSV-1 Th and B lymphocytes of gB-gD protein,and to identify its eukaryotic expression.MethodsThe epitopes ofHSV-1 gB-gDprotein were analyzed by bioinformatics analysis software.HSV-1 Th and Blymphocyte recombinantmulti-epitope gene(Th/B gene)was designed and synthesized.Th/B gene was cloned into pVAX1 to synthesize pVAX1-Th/B. pVAX1-Th/B was then transfected into COS-7 cell,and the protein expression was identified by Western blot.ResultsThe epitopes of Th and B lymphocytes of HSV-1 gB and gD were predicted,and the eukaryotic expression plasmid pf pVAX1-Th/B was successfully constructed and confirmed by sequencing.In addition,the in vivo protein expression of the recombinant DNA was confirmed by Western blot.ConclusionHSV-1 Th and B lymphocyte recombinant multi-epitope DNA vaccine was successfully synthesized in this study.HSV-1 Th and B lymphocyte recombinant multi-epitope DNAvaccine can be successfully expressed in isolated eukaryotic cells.This study provides a feasible solution fordeveloping DNAvaccine againstHSV-1 infection.
herpes simplex virus;Th cell and B cell epitope;DNA vaccine
R772.2
A
0258-4646(2015)09-0796-04
国家自然科学基金(81200656);辽宁省博士启动基金(20111097)
刘贤洁(1986-),女,医师,硕士研究生.
马小力,E-mail:xiaolimax@gmail.com
2015-04-20
网络出版时间:

