MiR-429对人U87胶质瘤细胞增殖、迁移和侵袭能力的影响及其作用机制
陈亮宇,刘丽波,李新星,喻博,洪杨,郑健,于奇,薛一雪,刘云会
(中国医科大学 1.盛京医院神经外科,沈阳 110004;2.基础医学院神经生物学教研室,沈阳 110122)
·论著·
MiR-429对人U87胶质瘤细胞增殖、迁移和侵袭能力的影响及其作用机制
陈亮宇1,刘丽波2,李新星1,喻博1,洪杨1,郑健1,于奇1,薛一雪2,刘云会1
(中国医科大学 1.盛京医院神经外科,沈阳 110004;2.基础医学院神经生物学教研室,沈阳 110122)
目的研究miR-429对人U87胶质瘤细胞增殖、迁移和侵袭的影响及可能机制。方法培养人U87胶质瘤细胞,应用Lipofectamine®LTX试剂将pre-miR-429质粒以及anti-miR-429质粒(shRNA质粒载体)稳定转染人U87胶质瘤细胞,real-time PCR验证转染效率后,应用CCK-8检测增殖能力的变化;使用Transwell小室法检测人U87胶质瘤细胞迁移和侵袭能力的变化;应用real-time PCR和Western blot检测E盒结合锌指蛋白1(ZEB1)mRNA和蛋白表达含量变化;将ZEB1分别转染至U87胶质瘤细胞或miR-429过表达的U87胶质瘤细胞,应用Transwell小室检测miRNA-429和ZEB1分别过表达或二者双过表达对人U87胶质瘤细胞的增殖、迁移和侵袭的影响。结果与对照组比较,miR-429过表达显著抑制了人U87胶质瘤细胞的增殖、迁移和侵袭能力;显著降低了ZEB1在人U87胶质瘤细胞的mRNA和蛋白表达水平;ZEB1过表达显著增强了人U87胶质瘤细胞增殖、迁移和侵袭能力;并且ZEB1过表达有效阻断了miR-429抑制U87胶质瘤细胞增殖、迁移和侵袭的作用。结论miR-429能够通过抑制ZEB1降低人U87胶质瘤细胞的增殖,迁移和侵袭能力。
miR-429;E盒结合锌指蛋白1;人U87胶质瘤细胞;增殖;迁移;侵袭
胶质母细胞瘤(glioblastoma,GBM)起源于神经外胚层,大约占成人颅内肿瘤的1/4,是中枢神经系统最常见的高度恶性肿瘤。即使采用手术联合放化疗等积极的治疗,GBM的中位生存期也仅为12~15个月[1],预后不良。因此,深入研究GBM发生发展机制,能够为GBM的诊断和治疗提供重要依据[2]。微小RNA(microRNA,miRNA)是由21~25个核苷酸组成的内源性非编码单链RNA分子。可以在转录后水平通过降解或抑制靶mRNA翻译过程而发挥负向调控作用,其影响细胞增殖、分化、凋亡等过程对人体肿瘤的发生、发展具有重要的调节作用[3]。MiR-429是miR-200家族中的一员,在乳腺癌、卵巢癌等肿瘤中相对于正常组织低表达,作为肿瘤抑制性miRNA发挥作用,能够抑制肿瘤的发生[4~6]。
E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)是具有锌指结构的转录因子,位于人类10号染色体短臂,包含2个锌指结构簇和1个同源结构域[7]。近来有研究表明,ZEB1在肺癌、乳腺癌、子宫内膜癌,包括胶质瘤中呈高表达,在肿瘤的发生发展过程中起重要作用[8~11]。包括miR-429在内的miR-200家族与ZEB1形成负反馈平衡系统,ZEB1与miR-200家族成员之间在上皮以及间质相互转化以及彼此基因的表达水平方面相互负性调控。ZEB1对miR-200家族的调控是转录抑制;miR-200家族对ZEB1的作用为转录后抑制[12~14]。本研究旨在探讨miR-429对U87胶质瘤细胞增殖、迁移和侵袭的作用以及相关机制,为胶质瘤的诊断和治疗提供新的思路。
1 材料与方法
1.1 主要材料
DMEM(高糖)细胞培养基(美国Gibco公司);胎牛血清(杭州四季青公司);人pre-miR-429和antimiR-429的shRNA质粒载体(上海吉玛制药有限公司);转染试剂Lipofectamine®LTX(美国Invitrogen公司);G418(美国Sigma-Aldrich公司);Cell Counting Kit-8(日本同仁化学研究所);Transwell小室(美国Corning公司);Matrigel基底膜(美国BD公司);Trizol(美国life公司);miR-429以及U6引物(美国Applied Biosystems公司);多功能酶标仪(美国Molecular Devices公司);正置显微镜(日本Olympus公司);二氧化碳培养箱(美国Forma Scientific公司);荧光显微镜(日本Olympus公司);Real-time PCR仪((美国ABI公司);ZEB1过表达质粒(美国origene公司);TaqMan®MicroRNA Reverse Transcription Kit(美国life公司);TaqMan®Universal PCR Master Mix II,with UNG(美国life公司);一步法荧光定量PCR试剂盒(日本TaKaRa公司);miR-429、ZEB1引物序列(上海生工生物工程技术服务有限公司);兔抗ZEB1抗体、鼠抗GAPDH抗体、辣根过氧化物酶标记的羊抗鼠及羊抗兔二抗(美国SANTA CRUZ公司)。
1.2 细胞培养
人U87胶质瘤细胞株由中国医科大学神经生物学教研室保存。用DMEM高糖培养基加10%胎牛血清培养U87细胞,置37℃、5%CO2培养,2~3 d传代1次,取对数生长期细胞进行实验。
1.3 细胞转染
在24孔板中,每孔接种4×104个U87细胞,培养基不加抗生素。待细胞生长至80%融合度时,按照Lipofectamine®LTX说明书,分别给予pre-miR-429以及anti-miR-429质粒以及空质粒对照,并且每孔0.5 μL Plus Reagents以及1.7μL LTX。使用0.4 mg/mL G418筛选细胞。4周后,筛选出稳定转染的细胞系:pre-miR-429、pre-miR-429-NC、anti-miR-429和antimiR-429-NC。按照上述程序,针对pre-miR-429-NC以及pre-miR-429细胞系,将ZEB1稳转其中。筛选出以下稳定转染细胞系:pre-NC+ZEB1(+)、pre-NC+ ZEB1-NC、pre-miR-429+ZEB1(+)和pre-miR-429+ ZEB1-NC。
1.4 细胞活力测定
细胞活力采用CCK-8方法检测。制备U87细胞悬液,以每孔100 μL含1×104细胞数接种于96孔板,培养24 h后,各组终止反应弃去培养液,加入10 μL的CCK-8溶液,孵育4 h,用酶标仪测定450 nm波长处各孔光吸收值。
1.5 实时荧光定量PCR
1.5.1 miR-429检测:用Trizol提取细胞的总RNA,使用分光光度仪计量RNA水平;应用Invitrogen公司的Taqman MicroRNA Reverse Transcription Kit,Taqman Universal Master MixⅡ试剂盒,以U6为内参基因,检测miR-429。采用比较Ct值法(2-ΔΔCt法)对获得的数据进行相对定量分析。
1.5.2 ZEB1检测:用Trizol提取细胞的总RNA,使用分光光度仪计量RNA水平;一步法荧光定量PCR试剂盒,以GAPDH为内参基因,检测ZEB1。采用比较Ct值法(2-ΔΔCt法)对获得的数据进行相对定量分析。
1.6 体外迁移和侵袭实验
在孔径为8 μm的Transwell小室的上室底膜表面铺40 μL稀释的Matrigel胶(1∶3),37℃孵育30 min。用无血清DMEM培养液将各组细胞的浓度调整为2×105/mL,在上室加入100 μL细胞悬液,下室加入600 μL含10%胎牛血清的DMEM培养液,37℃、5%CO2培养24 h;弃去上室培养液,无水甲醇固定30 min,湿棉签擦去上室未过膜细胞,0.1%结晶紫染色20 min;在倒置显微镜下计数上室底膜上、下、左、右、中5个视野的细胞总数(×200)。细胞迁移实验除上室底膜未用Matrigel胶包被外,其余步骤同侵袭实验。
1.7 蛋白免疫印迹
检测miR-429过表达组和沉默组中ZEB1的蛋白表达。用RIPA裂解液分别提取各组总蛋白,BCA法检测蛋白浓度,然后应用SDS-PAGE进行电泳,后将蛋白转印至PVDF膜上,在含有5%脱脂奶粉TTBS溶液中常温封闭2 h,然后分别加入兔抗ZEB1抗体(1∶1 000稀释)和鼠抗GAPDH抗体(1∶5 000稀释),4℃孵育过夜。TTBS洗涤,经相应二抗(1∶5 000稀释),室温孵育2 h。用增强化学发光法检测免疫复合物的表达。采用Chemi Imager 5500 V2.03软件对蛋白条带进行扫描,用Fluor Chen 2.0计算机图像分析系统计算各条带整合光密度值(integrated density values,IDV)。结果以ZEB1/GAPDH的IDV比值表示。
1.8 统计学分析
2 结果
2.1 实时荧光定量PCR检测miR-429相关表达变化
在双向稳定转染miR-429后,应用real-time PCR验证转染效率。与对照组相比,pre-miR-429-NC组和anti-miR-429-NC组中miR-429的mRNA表达水平无明显变化(0.92±0.12 vs 1.00±0.13,P>0.05;1.17±0.14 vs 1.00±0.13,P>0.05);与pre-miR-429-NC组相比,pre-miR-429组中miR-429的mRNA表达水平增加5.9倍(5.90±0.56 vs 0.92±0.12,P<0.01);与anti-miR-429-NC组相比,anti-miR-429组中miR-429的表达(0.23±0.05)水平降低4.3倍(P<0.01)。
2.2 miR-429对U87胶质瘤细胞增殖的影响
与对照组相比,pre-miR-429-NC和anti-miR-429-NC组U87胶质瘤细胞的细胞活力无明显变化(1.12±0.10 vs 1.00±0.09,P>0.05;0.93±0.12 vs 1.00± 0.09,P>0.05);与pre-miR-429-NC组相比,miR-429过表达后,U87胶质瘤细胞的增殖能力明显下降(0.58±0.07 vs 1.12±0.10,P<0.01);与anti-miR-429-NC组相比,miR-429沉默后,U87胶质瘤细胞的增殖能力明显增强(1.67±0.13 vs 0.93±0.12,P<0.01)。
2.3 miR-429对U87胶质瘤细胞的迁移和侵袭能力的影响(图1)
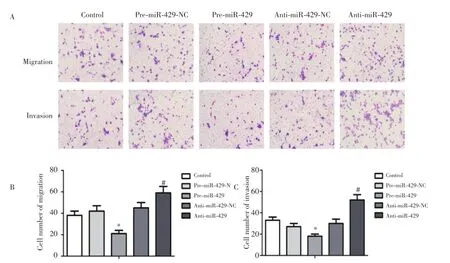
图1 稳转miR-429过表达以及沉默质粒后细胞迁移以及侵袭的变化Fig.1 Changes in cell migration and invasion of U87 after stable transfection with pre-miR-429 and anti-miR-429 plasmids
与对照组相比,pre-miR-429-NC和anti-miR-429-NC组U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目无明显变化;与pre-miR-429-NC组相比,miR-429过表达后,U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目显著降低;与anti-miR-429-NC组相比,miR-429沉默后,U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目显著增多;以上结果表明miR-429能够显著抑制U87细胞的侵袭能力。此外,miR -429对U87胶质瘤细胞迁移能力的影响与侵袭能力相一致,能够抑制U87细胞的迁移能力。
2.4 miR-429对ZEB1mRNA和蛋白表达的影响
与对照组相比,pre-miR-429-NC和anti-miR-429 -NC组U87胶质细胞中ZEB1的mRNA表达水平无明显变化;与pre-miR-429-NC组相比,miR-429过表达后,U87细胞中mRNA的表达水平显著降低;与anti-miR-429-NC组相比,miR-429沉默后,U87细胞中mRNA的表达水平显著显著增多;以上结果表明miR-429能够显著抑制U87细胞中mRNA的表达水平;此外,miR-429对U87胶质瘤细胞中ZEB1蛋白表达水平的调控与mRNA的表达水平变化相一致,上述结果表明miR-429能够在mRNA和蛋白水平上抑制ZEB1的表达(图2)。

图2 双向转染miR-429后ZEB1的mRNA及蛋白水平Fig.2 The expression levels of mRNA and protein of ZEB1 after two-way transfection with miR-429
2.5 miR-429和ZEB1分别过表达以及二者双过表达后的U87细胞活力改变
与对照组相比,pre-NC+ZEB(+)-NC组U87胶质瘤细胞的细胞活力无明显变化(0.95±0.10 vs 1.00± 0.08,P>0.05);与pre-NC+ZEB(+)-NC组相比,miR-429过表达后,U87细胞的增殖能力明显下降(0.52± 0.04 vs 0.95±0.10,P<0.01);ZEB1过表达后,U87细胞的增殖能力明显增强(1.95±0.17 vs 0.95±0.10,P<0.01);二者双过表达后U87细胞的增殖能力无明显改变(1.13±0.09 vs 0.95±0.10,P>0.05)。
2.6 miR-429和ZEB1分别过表达以及二者双过表达后的U87细胞迁移和侵袭能力改变
与对照组相比,pre-NC+ZEB(+)-NC组U87胶质瘤细胞穿过人工基底膜Matrigel胶和微孔膜的数目无明显变化;与pre-NC+ZEB(+)-NC组相比,miR-429过表达能够引起U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目明显下降;ZEB1过表达导致U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目明显增强;二者双过表达后,U87细胞穿过人工基底膜Matrigel胶和微孔膜的数目无明显改变(图3)。此外,分别过表达miR-429和ZEB,以及二者双过表达对U87胶质瘤细胞迁移能力的影响与侵袭能力相一致(图3)。
3 讨论
MicroRNA(miRNA)与靶基因mRNA的3′非翻译区(3′untranslated region,3′UTR)完全或者不完全互补配对从而发挥负性调节的作用,参与转录后基因表达的调控[3]。miR-200家族(miR-200b/c/429,miR-200a/141)通过对细胞周期、分化、凋亡等的调控作用,参与到肿瘤发生发展过程中。研究发现,miR-200家族作为发挥抑制肿瘤作用相对多见[5]。miR-200家族(包括miR-429)在神经胶质瘤中是潜在的抑癌基因[12,15]。探讨miR-429对肿瘤的影响及机制,可能为神经胶质瘤的治疗及相关研究提供新的策略。
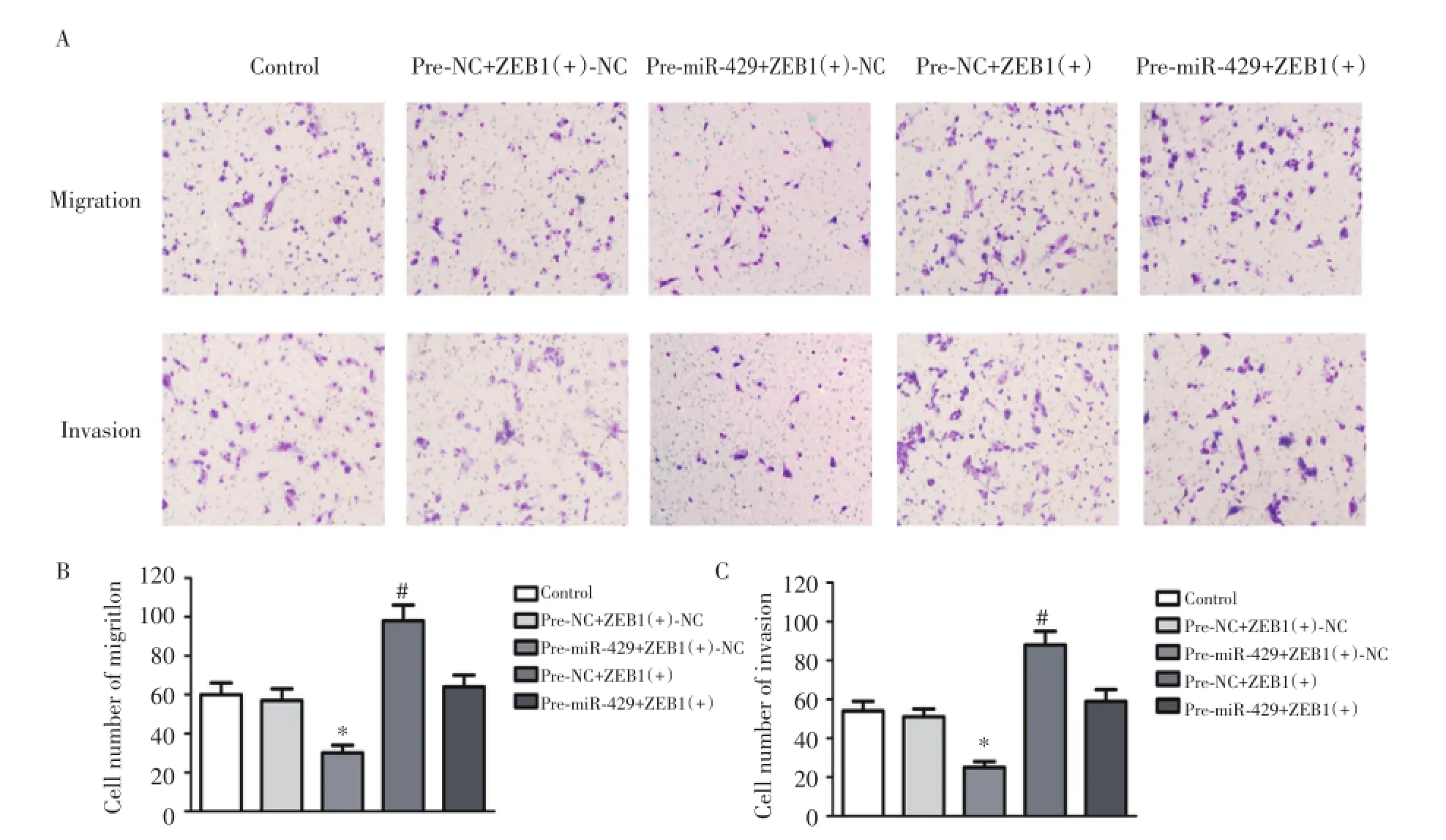
图3 分别过表达miR-429和ZEB,以及二者双过表达后U87细胞的迁移和侵袭能力变化Fig.3 Changes in cell migration and invasion abilities after transfection with single overexpressed and co-expressed miR-429 and ZEB1
ZEB1是一种E盒结合锌指蛋白,和其辅助因子共同结合在上皮性钙黏蛋白(E-cadherin)启动子的E盒上,抑制基因转录和E-cadherin的表达。所以,作为E-cadherin的重要阻遏蛋白,是研究肿瘤细胞上皮-间质转化(epithelial-to-mesenchymal transition,EMT)分子调控机制网络的关键枢纽[16]。而且ZEB1也是胚胎发育和细胞分化的重要转录因子,ZEB1的末端都有锌指簇,可识别并结合CDH1的E-box(CACCTG)序列,抑制CDH1的转录,进而调控EMT进程,控制肿瘤的恶性生物学行为[17]。miRNA-200是最早被发现参与EMT调控的miRNA,miR-200a和miR-200b可通过抑制ZEB1的转录,阻止细胞的EMT[18]。在上皮性卵巢癌中,miR-429通过控制ZEB1、ZEB2进而调节其EMT以及迁移的生物学行为[12]。
miR-429抑制直结肠癌细胞的增殖和侵袭,并且通过靶向Onecut2调控EMT相关基因[19];miR-429调节卵巢癌细胞间质内皮改变,增强卵巢癌细胞对顺铂的敏感性[20];miR-429通过与ZEB1的相互作用发挥对骨肉瘤细胞中发挥抑癌作用[21]。miR-429在多种肿瘤中发挥抑癌基因的作用,并且其生物学行为和EMT相关[19~21]。有报道称,miR-200a以及miR-200b对胶质瘤细胞的生长起抑制作用[22,23]。miR-429与miR-200a、miR-200b同属miR-200家族,但其是否在胶质瘤中发挥明显生物学作用尚无相关报道。本研究发现,miR-429过表达后可以显著抑制U87细胞的增殖、迁移和侵袭能力;沉默时作用相反。提示miR-429在胶质瘤中作为抑癌基因发挥作用。应用多种生物预测软件,包括TargetScan,microRNA.org,miRDB和PITA均能预测到miR-429和ZEB1有结合,而ZEB1在EMT中起重要作用[6,24],我们进一步检测pre-miR-429以及anti-miR-429处理后U87胶质瘤细胞中ZEB1的mRNA以及蛋白表达水平变化,证实了miR-429负性调控ZEB1的表达。但miR-429是否通过ZEB1发挥肿瘤抑制作用,尚不清楚。为此,我们进一步检测了miR-429和ZEB1的分别过表达,以及二者双过表达后对U87胶质瘤细胞的增殖、迁移和侵袭能力的影响,发现ZEB1可以有效阻断miR-429对U87细胞增殖、迁移和侵袭的抑制作用。
综上所述,miR-429能够显著降低人U87神经胶质瘤细胞的增殖、迁移和侵袭能力,其作用机制可能与miR-429抑制ZEB1的表达有关。
[1]Ahmed R,Oborski MJ,Hwang M,et al.Malignant gliomas:current perspectives in diagnosis,treatment,and early response assessment using advanced quantitative imaging methods[J].Cancer Manag Res,2014,6:149-170.
[2]刘丽波,薛一雪,王萍.缓激肽对脑胶质瘤大鼠occludin和ZO1mRNA的调节和机制[J].中国医科大学学报,2010,39(7):497-500.
[3]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[4]Ye ZB,Ma G,Zhao YH,et al.miR-429 inhibits migration and invasion of breast cancer cells in vitro[J].Inter J Oncol,2015,46(2):531-538.
[5]Ouyang Y,Gao P,Zhu B,et al.Downregulation of microRNA-429 inhibits cell proliferation by targeting p27Kip1 in human prostate cancer cells[J].Mol Med Rep,2015,11(2):1435-1441.
[6]Chen J,Wang L,Matyunina LV,et al.Overexpression of miR-429 induces mesenchymal-to-epithelial transition(MET)in metastatic ovarian cancer cells[J].Gynecol Oncol,2011,121(1):200-205.
[7]Funahashi J,Sekido R,Murai K,et al.Delta-crystallin enhancer binding protein delta EF1 is a zinc finger-homeodomain protein implicated in postgastrulation embryogenesis[J].Development(Cambridge,England),1993,119(2):433-446.
[8]Huang MT,Wei PL,Liu JJ,et al.Knockdown of thrombomodulin enhances HCC cell migration through increase of ZEB1 and decrease of E-cadherin gene expression[J].Ann Surg Oncol,2010,17(12):3379-3385.
[9]Singh M,Spoelstra NS,Jean A,et al.ZEB1 expression in type I vs type II endometrial cancers:a marker of aggressive disease[J].Modern Pathol,2008,21(7):912-923.
[10]Siebzehnrubl FA,Silver DJ,Tugertimur B,et al.The ZEB1 pathway links glioblastoma initiation,invasion and chemoresistance[J].EMBO Mol Med,2013,5(8):1196-1212.
[11]Chen L,Zhang K,Shi Z,et al.A lentivirus-mediated miR-23b sponge diminishes the malignant phenotype of glioma cells in vitro and in vivo[J].Oncol Rep,2014,31(4):1573-1580.
[12]Park SM,Gaur AB,Lengyel E,et al.The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2[J].Genes Dev,2008,22(7):894-907.
[13]Korpal M,Kang Y.The emerging role of miR-200 family of microRNAs in epithelial-mesenchymal transition and cancer metastasis[J].RNA Biol,2008,5(3):115-119.
[14]Brabletz S,Brabletz T.The ZEB/miR-200 feedback loop--a motor of cellular plasticity in development and cancer?[J].EMBO Rep,2010,11(9):670-677.
[15]Du Y,Xu Y,Ding L,et al.Down-regulation of miR-141 in gastric cancer and its involvement in cell growth[J].J Gastroenterol,2009,44(6):556-561.
[16]Zheng H,Kang Y.Multilayer control of the EMT master regulators[J].Oncogene,2014,33(14):1755-1763.
[17]Sanchez-Tillo E,Lazaro A,Torrent R,et al.ZEB1 represses E-cadherin and induces an EMT by recruiting the SWI/SNF chromatinremodeling protein BRG1[J].Oncogene,2010,29(24):3490-3500.
[18]Gregory PA,Bert AG,Paterson EL,et al.The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J].Nature Cell Biol,2008,10(5):593-601.
[19]Sun Y,Shen S,Liu X,et al.MiR-429 inhibits cells growth and invasion and regulates EMT-related marker genes by targeting Onecut2 in colorectal carcinoma[J].Mol Cell Biochem,2014,390(1-2):19-30.
[20]Wang L,Mezencev R,Svajdler M,et al.Ectopic over-expression of miR-429 induces mesenchymal-to-epithelial transition(MET)and increased drug sensitivity in metastasizing ovarian cancer cells[J]. Gynecol Oncol,2014,134(1):96-103.
[21]Liu X,Liu Y,Wu S,et al.Tumor-suppressing effects of miR-429 on human osteosarcoma[J].Cell Biochem Biophy,2014,70(1):215-224.
[22]刘峰,王占祥,刘才权,等.miR-200a通过靶向NCAM1基因影响胶质瘤细胞的迁移及侵袭[J].肿瘤,2013,33(5):398-403.
[23]赵文健,杨亮,何汉江.miR-200b通过靶向CD133抑制胶质瘤细胞和胶质瘤干细胞的生长[J].肿瘤,2014,34(3):231-237.
[24]Hurt EM,Saykally JN,Anose BM,et al.Expression of the ZEB1(deltaEF1)transcription factor in human:additional insights[J]. Mol Cell Biochem,2008,318(1-2):89-99.
(编辑 武玉欣)
The Effectand Mechanism ofmiR-429 Regulating Proliferation,Migration and Invasion of Human U87 Glioma Cells
CHENLiang-yu1,LIULi-bo2,LIXin-xing1,YUBo1,HONGYang1,ZHENG Jian1,YUQi1,XUE Yi-xue2,LIUYun-hui1
(1.DepartmentofNeurosurgery,Shengjing Hospital,China MedicalUniversity,Shenyang 110004,China;2.DepartmentofNeurobiology,College ofBasic MedicalScience,China MedicalUniversity,Shenyang 110122,China)
Objective To study the effects ofmiR-429 on proliferation,migration and invasion ofhuman glioma U87 cellsand the potentialmechanism.MethodsAfter human U87 glioma cells were cultured,Lipofectamine®LTX was applied to stably transfect U87 glioma cells with pre-miR-429 and anti-miR-429 plasmids(shRNA plasmid vector).After verification of the efficiency of transfection by real-time PCR,CCK-8 was applied to detect the change in proliferation of U87 cells.The Transwell chamber assay was applied to measure the change in migration and invasion of human U87 glioma cells,the real-time PCR and the Western blotassay were applied to measure the change in mRNA and protein levelsofzinc finger E-box binding homeobox 1(ZEB1).NormalU87 cells and miR-429-overexpressing U87 cells were transfected with ZEB1,and the Transwellchamber assay was applied to detect the effect of single overexpressed or co-overexpressed miR-429 and ZEB1 on proliferation,migration and invasion of human U87 glioma cells.ResultsCompared with the control group,overexpression of miR-429 significantly inhibited the proliferation,migration and invasion ability of U87 cells and obviously reduced the expression level of mRNA and protein of ZEB1 in human U87 glioma cells.Overexpression of ZEB1 dramatically improved the proliferation,migration and invasion of human U87 glioma cells,furthermore,effectively blocked the function of miR-429 overexpression inhibiting proliferation,migration and invasion.ConclusionMiR-429 reduces proliferation,migration and invasion ofU87 glioma cells by inhibiting ZEB1.
miR-429;zinc finger E-box binding homeobox 1;human U87 glioma cells;proliferation;migration;invasion
R-338.2;R341.6
A
0258-4646(2015)09-0769-06
国家自然科学基金(81402573,81372484,81372682,81272564,81172197,81171131)
陈亮宇(1980-),男,讲师,硕士.
刘云会,E-mail:liuyh@sj-hospital.org
2014-12-26
网络出版时间:

