肥胖相关性肾小球病肾组织脂氧素A4受体的表达及其临床意义
刘思远,李雷,姜红堃,姜红
(1.中国医科大学附属第一医院儿科,沈阳 110001;2.沈阳军区第202医院儿科,沈阳 110812;3.中国医科大学附属盛京医院外科,沈阳 110004)
·论著·
肥胖相关性肾小球病肾组织脂氧素A4受体的表达及其临床意义
刘思远1,2,李雷3,姜红堃1,姜红1
(1.中国医科大学附属第一医院儿科,沈阳 110001;2.沈阳军区第202医院儿科,沈阳 110812;3.中国医科大学附属盛京医院外科,沈阳 110004)
目的通过检测肥胖相关性肾小球病(ORG)小鼠肾组织中脂氧素A4受体(ALX)mRNA及蛋白的表达,探讨其在ORG发生发展中的作用。方法选取40只35 d龄C57BL/6雄性小鼠,按体质量随机分为ORG组和对照组(各20只),适应性喂养1周后,ORG组高脂高能量饲料喂养,对照组普通饲料喂养,2组分别喂养8周后留取尿液,ELISA法行尿微量系列蛋白检测;游离肾组织,光镜、电镜下观察肾组织病理学改变;qRT-PCR法检测肾组织ALX mRNA表达;Western blot法检测肾组织ALX蛋白表达;结果采用SPSS 17.0软件进行统计学处理。结果与对照组比较,ORG组尿微量蛋白明显增高,肾组织中ALX mRNA及蛋白的表达均明显增强,差异有统计学意义(P<0.05),病理检查显示ORG组肾小球普遍肥大,电镜下见肾小球囊腔增宽,足突部分融合,内皮细胞膜部分模糊,近端小管上皮细胞内见大量空泡变性线粒体。结论ORG肾组织中ALX表达的增强可能在ORG发生发展过程中发挥调节作用。
肥胖;肾小球病;脂氧素A4受体
近年来,随着世界范围肥胖发病率的持续上升,肥胖相关性肾小球病(obesity-related glomerulopathy,ORG)也日渐增多[1],其发病机制尚未完全阐明[2]。最近研究认为肥胖导致的慢性炎症与ORG的发生发展密切相关[3,4]。课题组前期通过动物模型研究证实,ORG小鼠血清及肾组织中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)显著升高[5]。ALX是脂氧素A4(lipoxin A4,LXA4)的主要受体,激活后能够转导LXA4,从而发挥抑制炎性反应、促进炎症消退的双重生物效应[6,7]。目前对ORG的治疗选择有限,且治疗效率低[8]。通过转化医学研究,比较动物模型试验和人体临床研究,可以加快ALX相关新药的研发和应用速度。本研究拟通过观察ORG小鼠肾组织中ALX表达的变化,探讨其在ORG发生发展过程中的意义,为药物治疗ORG探寻新的潜在途径。
1 材料与方法
1.1 动物模型制备
35 d龄C57BL/6雄性小鼠[上海西普尔-必凯实验动物有限公司,动物合格证号:SCXK(鄂)200320005],体质量(16±2)g。室温(22±3)℃,相对温度(50±5)%,12 h光照。研究期间,动物可自由摄取食物和水,摄食量、体质量每周记录1次。饲料采用合成饲料[高脂高能量饲料配方(g/100 g):基础饲料73.0,猪油20.0,酪蛋白7.0;营养成份(g/100 g)为蛋白质21.33,脂肪27.76,碳水化合物34.76]。按体质量随机分为ORG组(20只)和对照组(20只),于动物中心适应性喂养1周后,ORG组高脂高能量饲料喂养,对照组继续普通饲料喂养。8周末代谢笼留取尿液,置于-20℃冰箱冻存待检;游离肾组织,肾组织标本部分置于经焦炭酸二乙酯处理过的EP管中,立即转移至-80℃冰箱冻存待检;其余分别置于2.5%戊二醛及4%多聚甲醛溶液中进行病理检测。
1.2 尿微量蛋白检测
酶联免疫吸附(ELISA)法检测尿微量白蛋白(albumin,Alb)、转铁蛋白(transferrin,TRF)、尿视黄醇结合蛋白(retinol binding protein,RBP)、β2微球蛋白(β2-microglo bulin,β2-MG),ELISA试剂盒由南京建成生物技术有限公司提供,严格按照说明书操作。
1.3 实时定量聚合酶链反应(qRT-PCR)法检测肾组织ALX mRNA表达
1.3.1 引物设计与合成:目的基因ALX:上游5′-CAGCCGTCCTTTCCGAGTTC-3′,下游5′-AGTGAA GCCAAATTGGTTCTTGT-3′,产物长度318 bp;内参GAPDH:上游5′-AATGGATTTGGACGCATTGGT-3′,下游5′-TTTGCACTGGTACGTGTTGAT-3′,产物长度213 bp。以上引物均由上海生工生物工程公司根据GenBank的基因cDNA序列合成。
1.3.2 总RNA提取及cDNA合成:利用Trizol及RNA抽提试剂盒(美国Invitrogen公司)提取总RNA,经紫外分光光度计检测吸光度(A260/280)比值,得RNA的浓度和纯度,并经电泳检测RNA分子的完整性。用逆转录试剂盒(日本TaKaRa公司)将总RNA反转录成cDNA第一链,反应总体积20 L。在荧光定量实时PCR仪7500型(美国Applied Biosystems公司)上进行逆转录反应的条件:50℃30 min,95℃5 min,4℃5 min。合成的cDNA第一链立即置于-20℃冰箱保存。
1.3.3 qRT-PCR反应:应用SYBR Green PCR Master mix试剂盒(美国Applied Biosystems公司)进行ALX mRNA的qRT-PCR扩增。反应条件:Stage 1 95℃10 min,Stage 2(95℃5 s→59℃60 s)×40个循环,Stage 3 Dissociation。以GAPDH为内参,校正每个样本的Ct,采用thermal cycler软件包计算△Ct值,以2-△△Ct计算基因表达。
1.4 Western blot检测肾组织ALX蛋白表达
1.4.1 肾组织总蛋白的提取:取冷冻备用的肾组织100 mg,加入1 mL蛋白裂解液,于冰上超声波粉碎机下将组织粉碎,电动匀浆,取上清;按照蛋白抽提试剂盒(美国Sigma公司)使用说明进行蛋白抽提,应用Bradford法测定蛋白质含量。
1.4.2 电泳、转膜及封闭:取40 μg蛋白溶解物加样于100 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳4 h,半干法转移至聚偏二氟乙烯(PVDF)膜(美国Amersham公司)上,用50 g/L脱脂奶封闭1 h。
1.4.3 杂交及显色:加入兔抗鼠ALX多克隆抗体(1∶1 000稀释,美国Santa Cruz公司)4℃过夜。洗膜后再加入辣根过氧化物酶标记的山羊抗兔第二抗体(1∶1 000稀释,美国Santa Cruz公司)室温孵育1 h。再次洗膜后用ECL试剂(美国Amersham公司)显色并曝光成像于Kodak胶片,利用凝胶图像分析系统(美国Gene公司)扫描确定X片上杂交条带的相对吸光度值。
1.5 肾脏病理学观察
1.5.1 光镜下观察肾小球病变:肾组织4%多聚甲醛固定,常规石蜡包埋,切片,经苏木素-伊红(HE)染色,光镜下观察肾小球变化。
1.5.2 电镜下观察超微结构:每只小鼠肾组织经戊二醛固定,电镜包埋,1 mm超薄切片染色,10 000倍电子显微镜下观察并拍摄肾小球病理改变。
1.6 统计学分析
2 结果
2.1 尿微量蛋白的变化
与对照组比较,ORG组小鼠尿Alb、TRF、RBP、β2-MG显著增高,差异有统计学意义(t值分别为3.593,6.787,9.399和8.583,P<0.01),见表1。
表1 ORG组与对照组小鼠尿微量蛋白比较()Tab.1 Comparison of urinary micro proteins between ORG and control mice()

表1 ORG组与对照组小鼠尿微量蛋白比较()Tab.1 Comparison of urinary micro proteins between ORG and control mice()
2.2 qRT-PCR法检测肾组织ALX mRNA的表达
ORG组肾组织ALX mRNA表达较对照组明显增强,差异有统计学意义(P<0.05,图1A)。
2.3 Western blot分析肾组织ALX蛋白的表达
与对照组比较,ORG组肾组织ALX蛋白的表达明显增强,差异有统计学意义(P<0.05,图1B)。
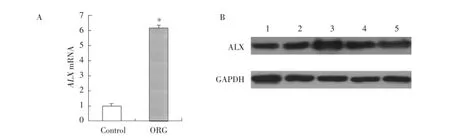
图1 2组肾组织中ALX mRNA及蛋白的表达Fig.1 Expression of ALX mRNA and protein in renal tissues of the two groups
2.4 肾脏病理学变化
ORG组小鼠均出现肾小球普遍肥大;电镜下可见肾小球囊腔增宽,脏层上皮部分脱落,足突部分融合,内皮细胞膜部分模糊,基底膜部分模糊,见图2A;近端小管上皮细胞内见大量空泡变性线粒体,刷状缘排列较整齐,见图2B。
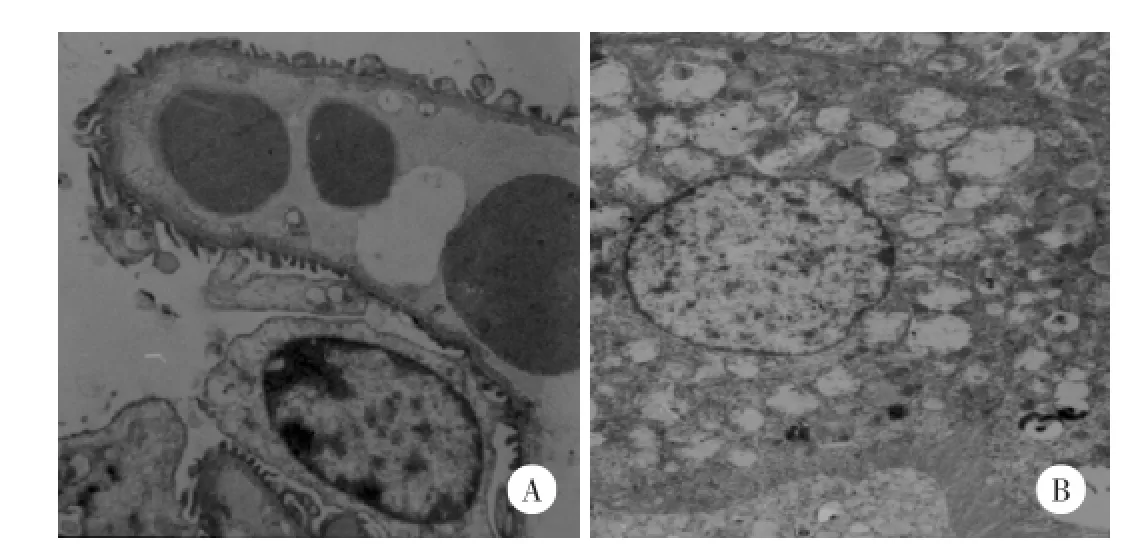
图2 电镜观察肥胖相关性肾小球病小鼠肾组织超微结构 ×10 000Fig.2 Ultrastructural changes of kidney tissue in mice with ORG by electron microscope×10 000
3 讨论
1974年Weisinger等[9]首次报道了4例严重肥胖患者并发肾病综合征,ORG由此得名。其临床特征多为非肾病性蛋白尿,病程进展缓慢,少数可发展为肾病综合征(nephrotic syndrome,NS)及终末期肾病(end stage renal disease,ESRD),其预后并不乐观[10,11]。虽然ORG病情进展缓慢,但鉴于当前肥胖问题的严峻形势及ORG发病率的增高趋势,探寻新的治疗ORG的有效手段显得十分迫切。本研究通过高脂高能量饲料喂养制作ORG小鼠模型[12],发现ORG小鼠早期即出现尿微量蛋白增高,提示肾小球及肾小管功能受损;电镜显示肾小球囊腔增宽,脏层上皮部分脱落,足突部分融合,内皮细胞膜部分模糊,基底膜部分模糊,提示肾小球结构异常;近端小管上皮细胞内见大量空泡变性线粒体,提示肾小管结构受损。
ORG只发生于肥胖患者,其发病机制尚未完全阐明,目前研究主要包括炎性反应、肾血流动力学改变、肾素-血管紧张素-醛固酮系统的激活、高脂血症、胰岛素抵抗、高瘦素血症、氧化应激等方面因素,而这些因素相互作用、相互影响,共同导致ORG的发生发展[13]。最新研究认为,肥胖诱导的炎性反应是ORG等慢性肾病的独立危险因素[14]。对ORG小鼠模型的研究也表明,足细胞中炎性因子的形成和活化,与肥胖相关性足细胞损伤的发展有重要联系[15]。课题组前期研究发现ORG小鼠血清及肾组织中肾脏疾病重要炎症相关因子(TNF-α)亦显著升高[5]。TNF-α可通过核因子κB(nuclear factor kappa B,NF-κB)途径降低肾细胞klotho蛋白的合成。最近,有研究提示α-klotho蛋白可能是拮抗肥胖肾损伤的一个因子[16]。炎性反应在ORG的发生发展中具有重要作用。因此,控制炎性反应、减轻炎性损伤可能是治疗ORG的有效途径。
LXA4是1984年Serhan等研究发现的人类白细胞中的花生四烯酸(arachidonic acid,AA)经脂氧合酶(lipoxidase,LO)催化合成的一类新的含氧衍生物,因具有强大的抗炎作用而被誉为炎性反应的“刹车信号”,被广泛研究[17]。LXA4的合成途径主要有2条:(1)AA经白细胞中的5-LO催化合成白三烯A4(Leukotriene A4,LTA4),而后转入血小板中的LTA4经12-LO催化合成LXA4;(2)AA在上皮细胞、单核细胞和嗜酸性粒细胞内被15-LO催化合成中间产物15S-羟过氧化二十碳四烯酸(15S-hydroxyeicosatetraenoic acid,15S-HETE),15S-HETE很快被多形核中性粒细胞(polymorphonuclear leukocytes,PMNs)吸收,并经5-LO再次催化合成LXA4[18]。研究显示,LXA4能促进心肌细胞中血红素加氧酶1(heme oxygenase-1,HO-1)的表达和激活,而减轻心肌细胞的缺氧/再氧化损伤[19]。肾脏疾病方面,单侧输尿管梗阻大鼠模型的研究显示,LXA4能通过减少TNF-α、干扰素γ(interferon-γ,IFN-γ)的表达,而减轻的肾纤维化,减少肾细胞凋亡[20]。LXA4还能通过抑制白三烯B4而发挥抗炎作用,促进急性链球菌感染后肾炎的恢复[21]。
ALX是G蛋白耦联受体超家族成员之一,具有7次跨膜结构,主要表达于人体脂肪组织、心肌组织、白细胞、肾小球系膜细胞等组织和细胞中;亦属于甲酰肽受体(formyl peptide receptor,FPR)家族的第2个成员,因此也被命名为甲酰肽样受体(FPR2)。ALX基因定位于人类染色体19q,含有2个外显子和2个内含子,其mRNA大小约2.1 kb。人、小鼠和大鼠ALX的cDNA阅读框全长均为1 051 bp,编码351个氨基酸残基,三者核苷酸序列同源性74%、氨基酸序列同源性65%。因此在进行转化医学研究时,可以比较参照小鼠、大鼠的动物模型试验和人体临床研究。ALX在炎性反应过程中可被IL-1β、IL-4、IL-6、IL-13、IFN-γ等多种细胞因子上调,是LXA4发挥生物学效应的主要受体,激活后能通过多种信号转导途径抑制NF-κB和活化蛋白1在核内的聚集,显著减少炎性因子的释放并减弱细胞毒作用。有研究显示,ALX可能通过对磷酸肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinase/ protein kinase B,PI3K/Akt)信号转导途径的调节,抑制TNF-α介导的NF-κB活化,进而抑制促炎介质的转录[22]。ALX能引起microRNA-146b表达的增强,从而抑制NF-κB的活化[23]。ALX通过促进巨噬细胞向炎症部位聚集并增强其非炎性吞噬作用,清除凋亡的中性粒细胞及其他损伤细胞,抑制巨噬细胞分泌促炎因子IL-1、IL-6,而促进抗炎因子IL-10的产生,使炎性反应的动态平衡向促进炎症恢复的方面发展[24]。临床研究显示,LXA4与鼻腔上皮细胞中的ALX结合后,可抑制NF-κB介导的炎性因子IL-8释放,而在上呼吸道炎症中发挥促恢复作用[25]。对呼吸机所致肺损伤大鼠模型的研究显示,使用ALX激动剂可以抑制NF-κB的活化和丝裂原蛋白活化激酶的活性,减少炎性因子IL-1β、IL-6、TNF-α的释放和支气管肺泡灌洗液中性粒细胞浸润,从而减轻肺损伤[26]。ALX还能结合并转导其他抗炎因子对肥胖导致的脂肪炎症的促恢复作用[27]。动物研究显示,马的正常肌腱组织不表达ALX,而亚急性和慢性损伤导致无菌性炎症的肌腱却表达ALX,促炎介质IL-1β和PGE2可诱导离体正常肌腱表达ALX[28]。以上实验和临床研究均表明ALX能够转导LXA4等抗炎因子,并通过多种信号途径减轻组织细胞的炎性损伤、促进炎症恢复。本研究通过观察ORG小鼠和对照组小鼠肾组织ALX的表达情况,发现ALX mRNA及蛋白水平在正常肾组织呈低度表达,而在ORG组肾组织中表达显著增强。说明发生损伤的ORG肾组织在进行免疫调节,利用ALX的高表达加强抗炎和自我修复能力,延缓肾脏疾病进展。
综上所述,肥胖诱导机体慢性炎性反应,大量炎性因子被激活,一方面导致肾脏炎性损伤,另一方面促进抑炎因子及其受体(如ALX)反应性增高。ALX表达的增高加强了受损肾组织对抗炎因子的敏感性,促进肾脏炎性损伤的修复,延缓肾脏炎性疾病的进展。对ALX调节肾脏炎症机制深入研究,将会为药物治疗ORG及慢性炎性肾病提供新的有效途径,并为治疗原发病及肾脏并发症赢得宝贵时间。
[1]Maric-Bilkan C.Obesity and diabetic kidney disease[J].Med Clin North Am,2013,97(1):59-74.
[2]de Vries AP,Ruggenenti P,Ruan XZ,et al.Fatty kidney:emerging role of ectopic lipid in obesity-related renal disease[J].Lancet Diabetes Endocrinol,2014,2(5):417-426.
[3]Ouchi N,Parker JL,Lugus JJ,et al.Adipokines in inflammation and metabolic disease[J].Nat Rev Immunol,2011,11(2):85-97.
[4]Egger G,Dixon J.Non-nutrient causes of low-grade,systemic inflammation:support for a‘canary in the mineshaft’view of obesity in chronic disease[J].Obes Rev,2011,12(5):339-345.
[5]姜红堃,李雷,姜红,等.肥胖相关性肾小球病小鼠肿瘤坏死因子α表达的变化[J].实用儿科临床杂志,2012,27(23):1791-1794.
[6]Freire MO,Van Dyke TE.Natural resolution of inflammation[J]. Periodontol,2000,2013,63(1):149-164.
[7]Cooray SN,Gobbetti T,Montero-Melendez T,et al.Ligand-specific conformational change of the G-protein-coupled receptor ALX/ FPR2 determines proresolving functional responses[J].Proc Natl Acad Sci USA,2013,110(45):18232-18237.
[8]Kanasaki K,Kitada M,Kanasaki M,et al.The biological consequence of obesity on the kidney[J].Nephrol Dial Transplant,2013,28(Suppl 4):S1-7.
[9]Weisinger JR,Kempson RL,Eldridge FL,et al.The nephrotic syndrome:a complication of massive obesity[J].Ann Intern Med,1974,81(4):440-447.
[10]Darouich S,Goucha R,Jaafoura MH,et al.Clinicopathological characteristics of obesity-associated focal segmental glomerulosclerosis[J].Ultrastruct Pathol,2011,35(4):176-182.
[11]Tsuboi N,Koike K,Hirano K,et al.Clinical features and long-term renal outcomes of Japanese patients with obesity-related glomerulopathy[J].Clin Exp Nephrol,2013,17(3):379-385.
[12]裴源源,杨敏,芮宏亮,等.肥胖相关性肾小球病小鼠模型的建立[J].中国中西医结合肾病杂志,2014,15(2):110-113.
[13]姜红堃,刘思远,姜红.肥胖相关性肾小球病与脂氧素A4的研究进展[J].中华实用儿科临床杂志,2014,29(17):1340-1341.
[14]Börgeson E,Sharma K.Obesity,immunomodulation and chronic kidney disease[J].Curr Opin Pharmacol,2013,13(4):618-624.
[15]Boini KM,Xia M,Abais JM,et al.Activation of inflammasomes in podocyte injury of mice on the high fat diet:effects of ASC gene deletion and silencing[J].Biochim Biophys Acta,2014,1843(5):836-845.
[16]杨敏,王国勤,芮宏亮,等.α-klotho蛋白与肥胖相关性肾小球病的相关研究[J].中华肾脏病杂志,2015,31(2):140-144.
[17]Serhan CN,Yacoubian S,Yang R.Anti-inflammatory and proresolving lipid mediators[J].Annu Rev Pathol,2008,3:279-312.
[18]Serhan CN,Chiang N,Van Dyke TE.Resolving inflammation:dual anti-inflammatory and pro-resolution lipid mediators[J].Nat Rev Immunol,2008,8(5):349-361.
[19]Chen XQ,Wu SH,Zhou Y,et al.Involvement of K+channel-dependant pathways in lipoxin A4-induced protective effects on hypoxia/ reoxygenation injury of cardiomyocytes[J].Prostaglandins Leukot Essent Fatty Acids,2013,88(5):391-397.
[20]Börgeson E,Docherty NG,Murphy M,et al.Lipoxin A4 and benzolipoxin A4 attenuate experimental renal fibrosis[J].FASEB J,2011,25(9):2967-2979.
[21]Wu SH,Liao PY,Yin PL,et al.Elevated expressions of 15-lipoxygenase and lipoxin A4 in children with acute poststreptococcal glomerulonephritis[J].Am J Pathol,2009,174(1):115-122.
[22]Odusanwo O,ChinthamaniS,MccallA,et al.Resolvin D1 prevents TNF-α-mediated disruption of salivary epithelial formation[J]. Am J Physiol Cell Physiol,2012,302(9):C1331-1345.
[23]Recchiuti A,Krishnamoorthy S,Fredman G,et al.MicroRNAs in resolution of acute inflammation:identification of novel resolvin D1-miRNA circuits[J].FASEB J,2011,25(2):544-560.
[24]Cattaneo F,Parisi M,Ammendola R.Distinct signaling cascades elicited by different formyl Peptide receptor 2(FPR2)agonists[J].Int J Mol Sci,2013,14(4):7193-7230.
[25]Shimizu S,Ogawa T,Seno S,et al.Pro-resolution mediator lipoxin A4 and its receptor in upper airway inflammation[J].Ann Otol Rhinol Laryngol,2013,122(11):683-689.
[26]Li H,Wu Z,Feng D,et al.BML-111,a lipoxin receptor agonist,attenuates ventilator-induced lung injury in rats[J].Shock,2014,41(4):311-316.
[27]Clària J,Dalli J,Yacoubian S,et al.Resolvin D1 and resolvin D2 govern local inflammatory tone in obese fat[J].J Immunol,2012,189(5):2597-2605.
[28]Dakin SG,Werling D,Hibbert A,et al.Macrophage sub-populations and the lipoxin A4 receptor implicate active inflammation during equine tendon repair[J].PloS One,2012,7(2):e32333.
(编辑 武玉欣)
Expression ofLipoxin A4 Receptor in RenalTissuesofthe Obesity-related Glomerulopathy and Its ClinicalSignificance
LIUSi-yuan1,2,LILei3,JIANGHong-kun1,JIANGHong1
(1.Department of Pediatrics,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Pediatrics,No.202 Hospital of PLA,Shenyang 110812,China;3.DepartmentofSurgery,Shengjing Hospital,China MedicalUniversity,Shenyang 110003,China)
Objective To detectthe expression oflipoxin A4 receptor(ALX)in renaltissues ofmice with obesity-related glomerulopathy(ORG),so asto explore itsrole and significance in the onsetand developmentofORG.MethodsThe clean grade C57BL/6 mice aged 35 days were randomly divided into ORGgroup and controlgroup(20 cases in each group).After1 week ofacclimation,the ORG group was fed with a high-fathigh-energy diet,while the control group was fed with a normal diet.After 8 weeks feeding,the two groups were assayed with enzyme linked immunosorbent assay(ELISA)for urinary microprotein.The renal tissue was fixed,and examined under both light and electron microscopy for histopathological changes.The quantitative real-time polymerase chain reaction(qRT-PCR)analysis was performed to measure the expression of ALX mRNA in renaltissues.ALX protein expression was determined by Western blotassay.The statisticaldifference between the two groups was analyzed using SPSS 17.0 software.ResultsCompared with the control group,the ORG group had significantly higher urinary protein;both ALX mRNA and protein expressions in renaltissues ofthe ORGgroup were significantly increased(P<0.05).Histopathologicalexamination found the ORG group had general glomerular hypertrophy.Electron microscope results revealed that glomerular cysts widened,part of the foot process fusion,part of the endothelial cell membrane indistinct,and a large number of mitochondria vacuolar degeneration were found in the proximal tubule epithelium.ConclusionIncreased expression ofALXmightplay a regulated role in the pathogenic mechanism and developmentofORG.
obesity;glomerulopathy;lipoxin A4 receptor
R725
A
0258-4646(2015)09-0775-05
国家自然科学基金(81300130;81373018);教育部高校博士点专项基金(20122104110001);辽宁省教育厅基金(L2012271)
刘思远(1980-),男,主治医师,硕士研究生.
姜红堃,E-mail:jianghongkun007@163.com
2014-11-28
网络出版时间:

