维生素C和维生素E的联合抗氧化活性研究
刘国安,李杰林,李双越,叶金凤,丁 兰
(西北师范大学生命科学学院,甘肃兰州 730070)
维生素C和维生素E的联合抗氧化活性研究
刘国安,李杰林,李双越,叶金凤,丁兰
(西北师范大学生命科学学院,甘肃兰州730070)
摘要:维生素C和维生素E具有多种生理活性,也是抗氧化剂,二者联合作用的生化机理研究鲜见报道.本文采用铁氰化钾法、甲基紫法、邻苯三酚自氧化法和DMPD法,检测了维生素C和维生素E单独及联合作用后的还原力、对DMPD·+自由基、羟自由基和超氧阴离子的清除能力;采用SDS-PAGE法和SCGE法检测了二者对蛋白质和细胞DNA氧化损伤的保护作用.结果表明,维生素C和维生素E在各个体系中具有较强的作用,并呈浓度依赖性.维生素C在还原能力、清除自由基能力方面比维生素E强,二者的联合作用大多强于单独作用,表现出一定的协同增效作用.同时,维生素C和维生素E在AAPH引起的蛋白质氧化损伤中也有很好的保护作用,二者联合后作用效果更明显,但在对细胞DNA 的氧化损伤中未见协同保护作用.
关键词:维生素C;维生素E;自由基;抗氧化活性;联合作用
维生素C(Vitamin C,VC)又名抗坏血酸,是水溶性维生素,主要用于预防和治疗坏血病.VC是一种强抗氧化剂,在清除自由基和抗氧化方面发挥重要作用[1,2].维生素E(Vitamin E,VE)又称生育酚,是脂溶性维生素,有抗不育、抗衰老等生理功能.VE也是强抗氧化剂,在体内外通过多种机制发挥抗氧化作用[3,4].尽管VC和VE的抗氧化作用在国内外有大量的报道,但大多是单独作用或是在单一体系下的检测,并且基本是在细胞体系或在整体水平的研究[5,6],而联合作用研究报道不多.作为具有抗氧化活性的水溶性维生素和脂溶性维生素,VC和VE的联合作用具有很大的应用潜力.
自由基(Free radical)是机体生命活动中各种生化反应产生的正常中间代谢产物,在生物体内发挥重要生理作用.在正常生理情况下,自由基的产生和消除处于动态平衡状态,但过量积聚时又会严重伤害生物膜、酶、维生素、蛋白质及活细胞功能,进而影响生物体的正常功能.衰老、癌症及许多疾病都与过量产生的自由基有关[7].
本文对VC和VE在多种体系下共同作用后的抗氧化活性进行了检测,以期揭示两种维生素抗氧化作用的互补性.实验通过检测VC和VE单独以及联合作用后的还原能力,对DMPD·+自由基、羟自由基、超氧阴离子的清除作用和对蛋白质和细胞DNA氧化损伤的保护作用,对二者的联合抗氧化机理的研究及其进一步应用提供一定的理论依据.
1材料与方法
1.1材料
牛血清白蛋白(Bovine serum albumin,BSA)(陕西华美生物科技有限公司产品);DMPD(N,N-二甲基-对苯二胺)、AAPH(2,2-偶氮二(2-脒基丙烷)二盐酸盐)、BHT(2,6-二叔丁基-4-甲基苯酚)、Tris(三羟甲基氨基甲烷)和SDS(均为Sigma公司产品).
1.2方法
1.2.1维生素E的乳化本文所有检测体系均为水体系,而VE为脂溶性化合物,故需对其进行乳化,以使其更好地参与反应.乳化方法参照沙棘油的乳化[8],以VE作油相,取1 mL VE与55 μL司盘80不断吸打,使分散均匀.水浴55~60 ℃保温60 min,在此期间每5 min吸打一次.另取115 μL吐温80、230 μL乳化剂OP-10和200 μL丙二醇溶于9 mL 55~60 ℃蒸馏水中,摇匀后缓慢加入上述保温60 min的油相中,继续每5 min吸打一次,使其分散均匀,10~15 min后制成初乳.
1.2.2还原力的测定还原剂将三价铁(Fe3+)还原成二价铁(Fe2+)后,Fe2+与铁氰化钾(K3Fe(CN)6)生成可溶性蓝色配合物KFe[Fe(CN)6],在700 nm处有最大光吸收.化合物还原力越强,形成的KFe[Fe(CN)6]越多,吸光度越大,故吸光度与还原力呈正比关系.
还原力的测定参照Oyaiuz[9]的实验方法,稍加修改.在1 mL样品溶液中分别加人2.5 mL 0.2 mol·L-1pH6.6的PBS和1%K3Fe(CN)6溶液后摇匀,50 ℃水浴20 min,然后加入2.5 mL 10%的三氯乙酸,混合物在4 000 r·min-1下离心10 min后取上清液2.5 mL,加入2.5 mL蒸馏水和1 mL 0.1%的三氯化铁溶液,静置10 min后在700 nm处测定吸光值,吸光值越大表明化合物还原力越强.
1.2.3清除DMPD·+自由基能力的测定DMPD在酸性条件下可被FeCl3、CuCl2或H2O2等氧化生成稳定有颜色的DMPD·+,它在505 nm处有最大吸收峰,而抗氧化剂能转移1个氢原子给DMPD·+使其溶液脱色,脱色程度越强,说明其抗氧化能力越强.
DMPD·+自由基清除能力根据刘国安等[10]的方法测定,取100 mmol·L-1的DMPD溶液和0.1 mol·L-1pH 5.25的醋酸盐缓冲液混匀,加入0.05 mol·L-1的FeCl3溶液启动反应后产生DMPD·+自由基溶液.取1 mL DMPD·+溶液,加0.5 mL样品溶液,25 ℃反应10 min,在505 nm处测吸光值.DMPD·+清除率=(1-A1/A2)×100%.其中,A2为DMPD·+初始浓度的吸光值;A1为加入待测样品后剩余DMPD·+浓度的吸光值.
1.2.4清除羟自由基能力的测定Fenton反应是以H2O2为氧化剂,以Fe2+为催化剂的氧化体系:Fe2++ H2O2→Fe3++OH-+·OH.产生的羟自由基(·OH)与甲基紫作用后使后者因氧化而吸光度降低,而抗氧化剂可清除·OH使其吸光度回升,故利用吸光值的变化可测定待测物对·OH的清除作用.
·OH清除能力的测定参照刘立明等[11]的方法.在试管中分别加入1 mL pH4.7的Tris-HCl、1 mL甲基紫溶液(1.03×10-5mol·L-1)、1 mL样品溶液、1 mL FeSO4溶液(1×10-3mol·L-1)和1 mL H2O2(1.6 mol·L-1)溶液,摇匀后放置5 min,在波长582 nm处测定吸光值.羟自由基清除率=[1-(A0-A2)/(A0-A1)]×100%,其中,A0为未加Fe2+和H2O2时的吸光值;A1为未加清除剂时的吸光值;A2为加入清除剂时的吸光值.


1.2.6对蛋白质氧化损伤的保护作用在自由基引发剂AAPH的作用下,BSA会被氧化降解,当有保护剂存在时可抑制这种降解作用.通过SDS-PAGE电泳检测蛋白质被降解的情况,可判断不同抗氧化剂对蛋白质氧化降解的保护能力.
实验根据Kwon等[13]的方法.取5 μg BSA溶于0.2 mol·L-1PBS中,由20 mmol·L-1AAPH启动氧化反应.处理组加入不同浓度的样品,对照组用PBS代替.37 ℃水浴孵育24 h后,加入0.02% BHT终止反应.产物进行常规SDS-PAGE电泳,考马斯亮蓝R-250染色制干板并照相.
1.2.7单细胞凝胶电泳检测对人外周血单核细胞DNA损伤的保护作用分离健康人外周血单核细胞,将样品与细胞置于37 ℃孵育20 min.用4 ℃ 50 μmol·L-1H2O2处理5 min,细胞于1 000 r·min-1离心8 min,用PBS洗2遍,制成细胞悬液.根据LIU等[14]的实验方法进行制片及电泳.在荧光显微镜下观察细胞损伤情况:DNA没有损伤的细胞呈圆形,损伤的细胞呈彗星状,随机选取视野统计损伤细胞数目,每样作3张片子,每张片子至少随机计50个细胞.细胞DNA损伤率=损伤细胞数/细胞总数×100%.保护剂对细胞的保护率=(A1-A2)/(A1-A0)×100%(A0为阴性对照损伤率,即未处理组;A1为阳性对照损伤率,即加入H2O2处理组;A2为实验组损伤率,即先加入被测试剂再加入H2O2处理组)
1.2.8数据处理所有实验重复至少3次,实验结果以均值±误差表示,用t检验进行差异显著性分析,P<0.05为有统计学意义.
2结果
2.1VC和VE的还原力
两种维生素的还原力结果见图1和图2.由图可知,VC(图1)的还原力比VE(图2)的还原力强,并且随着二者浓度的增加,吸光值不断升高,表明其还原能力不断增强,两者活性都呈浓度依赖性.VC在20μmol·L-1时吸光值为0.24,在140μmol·L-1时达到了1.79.而VE在浓度为16mmol·L-1时其吸光值仅有0.59.由表1可知,20μmol·L-1的VC和100μmol·L-1的VC分别与不同浓度的VE联合作用后,吸光值比单独作用时的吸光值明显增大,说明两者联合作用后还原力显著增强.
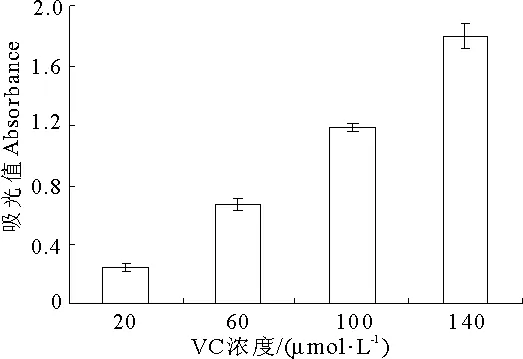
图1 VC的还原力

图2 VE的还原力
2.2VC和VE对DMPD·+的清除作用
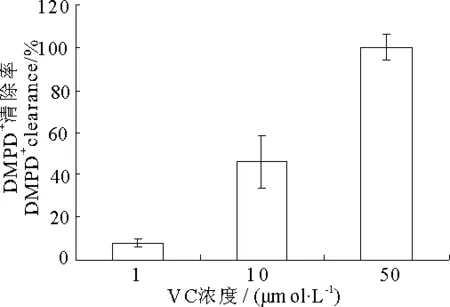
对DMPD·+自由基的清除作用见图3和图4,与还原力结果相似,VC(图3)对DMPD·+自由基的清除作用比VE(图4)强得多,50μmol·L-1时VC的清除率已经达到了100%,而2 750μmol·L-1的VE清除率才91%.

表1 VC和VE联合作用还原力
**P<0.01,与VC单独作用相比较(ComparedwithVCalone)
图3VC对DMPD·+自由基的清除作用
Fig3ScavengingactionofDMPD·+byVC
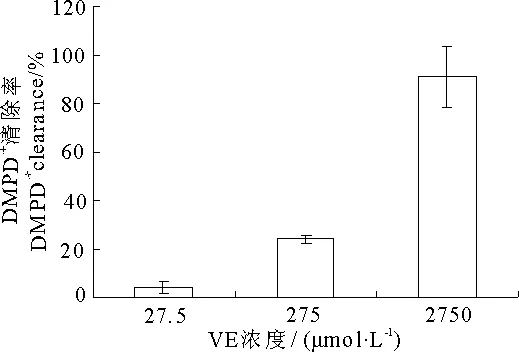
图4 VE对DMPD·+自由基的清除作用
由表2可知,1μmol·L-1的VC与27.5μmol·L-1的VE联合后的清除率为8%,与单独作用的清除率相比差别不大,10μmol·L-1VC与275μmol·L-1的VE联合后清除率为27%,比VC单独作用的清除率低.说明VC和VE联合作用后对DMPD·+自由基的清除没有明显的相互增效作用.
2.3VC和VE对羟自由基的清除作用
如图所示,VC(图5)对·OH具有很强的清除能力,并呈浓度依赖性.10μmol·L-1的VC清除率就达到了26%,随着浓度升高,清除作用增强,当浓度为150μmol·L-1时其清除率达到97%.而VE(图6)清除作用相对较弱,1mmol·L-1时清除率才达到70%.由表3可知,10μmol·L-1的VC和50μmol·L-1的VC分别与0.01mmol·L-1和0.05mmol·L-1的VE联合作用后清除率与VC单独作用的清除率相比没有显著差异,但0.25mmol·L-1的VE与VC联合后清除率显著增大,并且随着VE浓度增大清除作用显著增强,表现出了一定的协同效应.

表2 VC联合VE对DMPD·+自由基的清除作用
*P<0.05,**P<0.01与VC单独作用相比较(ComparedwithVCalone)

表3 VC联合VE对羟自由基的清除作用
*P<0.05,**P<0.01,与VC单独作用相比较(ComparedwithVCalone)2.4VC和VE对超氧阴离子清除作用
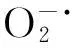
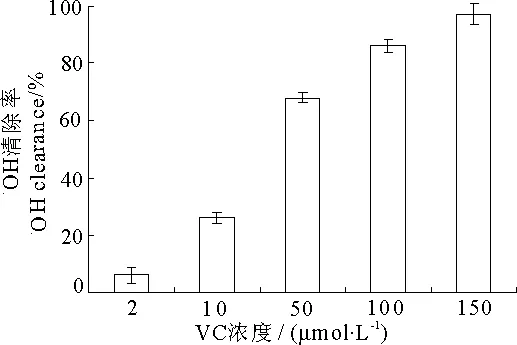
图5 VC对羟自由基清除作用
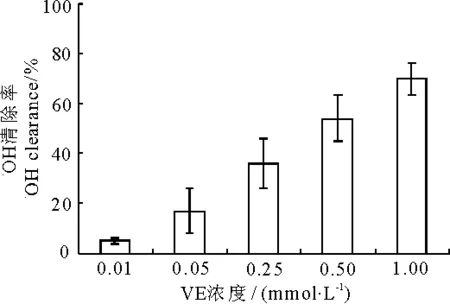
图6 VE对羟自由基清除作用
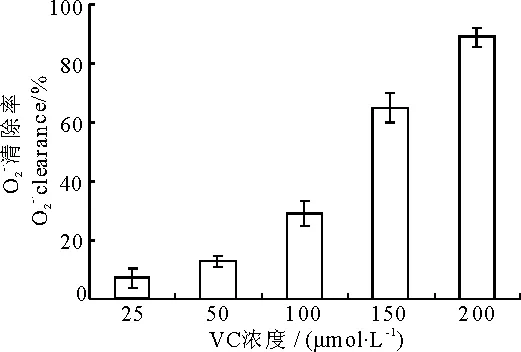
图7 VC对超氧阴离子的清除作用
由表4可知,50μmol·L-1的VC和100μmol·L-1的VC分别与0.75mmol·L-1的VE联合后,清除率分别为32%和50%,明显比它们单独作用的清除率高,并且随VE浓度增大,联合作用清除能力也显著增强,表现出协同清除作用.
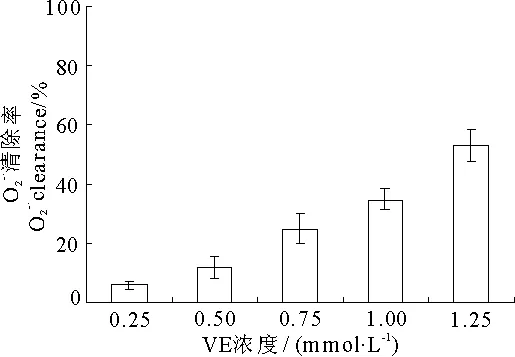
图8 VE对超氧阴离子的清除作用

浓度Concentration清除率Clearance/%浓度Concentration清除率Clearance/%50μmol·L-1VC13.3±1.4100μmol·L-1VC28.5±6.950μmol·L-1VC+0.25mmol·L-1VE15.0±3.1100μmol·L-1VC+0.25mmol·L-1VE30.3±6.650μmol·L-1VC+0.50mmol·L-1VE22.3±4.7*100μmol·L-1VC+0.50mmol·L-1VE37.6±4.450μmol·L-1VC+0.75mmol·L-1VE32.3±5.3**100μmol·L-1VC+0.75mmol·L-1VE50.1±6.0**50μmol·L-1VC+1.00mmol·L-1VE46.1±4.1**100μmol·L-1VC+1.00mmol·L-1VE56.6±2.7**50μmol·L-1VC+1.25mmol·L-1VE59.9±4.3**100μmol·L-1VC+1.25mmol·L-1VE69.8±6.1**
*P<0.05,**P<0.01与VC单独作用相比较(ComparedwithVCalone)
2.5VC和VE对AAPH引起牛血清白蛋白氧化损伤的保护作用
如图9所示,对照(泳道1)牛血清白蛋白条带清晰且颜色较深,用50mmol·L-1AAPH处理后蛋白质氧化降解,电泳后条带变浅或消失(泳道2),VC(图9:A)在低浓度时(0.1~0.001mmol·L-1)对蛋白质的保护作用不明显(泳道6~8),随着浓度的升高,保护作用加强,浓度为100mmol·L-1时几乎完全保护了蛋白质的氧化损伤(泳道3).VE(图9:B)的保护作用很弱,100mmol·L-1时表现出一定的保护作用(泳道3),浓度降低时(10~0.001mmol·L-1VE)只有很弱的作用(泳道5~8).VC和VE联合(图9:C)作用时,10mmol·L-1VC和不同浓度的VE(10~0.001mmol·L-1)联合作用后,蛋白质条带与对照相比差别不大,对蛋白质的保护作用很强(泳道3~7).而浓度为1mmol·L-1的VC和VE联合后,较高浓度的VE(10mmol·L-1)作用较强(泳道8),随着VE浓度降低蛋白质条带与对照相比颜色变浅(泳道8~12),说明对蛋白质保护作用减弱.相比于VC、VE单独保护作用,VC和VE联合保护作用更强.

图9VC和VE对由AAPH引起的BSA氧化降解的保护作用
Fig9TheinhibitioneffectofvitaminCandEonBSAoxidativefragmentationinducedbyAAPH
A.1.50μgBSA;2.50μgBSA+50mmol·L-1AAPH
3~8.50μgBSA+50mmol·L-1AAPH+100,10,1,0.1,0.01,0.001mmol·L-1VC
B.1.50μgBSA;2.50μgBSA+50mmol·L-1AAPH
3~8.50μgBSA+50mmol·L-1AAPH+100,10,1,0.1,0.01,0.001mmol·L-1VE
C.1.50μgBSA;2.50μgBSA+50mmol·L-1AAPH
3~7.50μgBSA+50mmol·L-1AAPH+10mmol·L-1VC+10,1,0.1,0.01,0.001mmol·L-1VE
8~12.50μgBSA+50mmol·L-1AAPH+1mmol·L-1VC+10,1,0.1,0.01,0.001mmol·L-1VE
2.6SCGE检测VC和VE对H2O2引起的人单核细胞DNA损伤的保护作用
由表5结果可知,VC和VE在低浓度时均对由H2O2引起的人单核细胞DNA损伤有一定的保护作用,VC在低浓度时(5,10μmol·L-1)随着浓度的增加对DNA的保护作用增强,但在高浓度时(50,500μmol·L-1)随浓度的增加保护作用消失,并具一定损伤作用;VE在低浓度时(2.5,5,10mmol·L-1)也对DNA有一定的保护作用,但未见到呈浓度依赖性,浓度为25mmol·L-1时,表现出损伤作用.不同浓度的VC和VE联合作用对DNA没有保护作用反而有损伤作用(数据未显示).

表5 VC和VE对细胞DNA氧化损伤的保护作用
3讨论
研究发现氧化胁迫可引起衰老、癌症、心脑血管疾病、老年痴呆症等疾病的发生和发展.而抗氧化剂可清除氧自由基,抑制脂质过氧化和多元不饱和脂肪酸的氧化变性,从而维持生物膜结构和功能的完整,降低了由氧化损伤引起的多种疾病的发生,因此,抗氧化剂的使用可能会预防和治疗与此相关的疾病.VC和VE分别是水溶性和脂溶性的抗氧化维生素,它们都具有很强的抗氧化能力.动物实验表明,VC、VE和半胱氨酸或NAC共同作用明显降低豚鼠体内黑色素的生成和B16细胞中黑色素的含量,而且联合作用活性远大于VC单独作用[15].VC和VE联合使用可明显增加大鼠肝脏和肌肉中过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和谷胱甘肽过氧化物酶(GPx)的活性,并且效果比单独作用更显著[16].VC和VE联用在有些体系中能有效缓解机体的氧化胁迫状态,但联用是如何发挥作用,其生化机制未见报道.
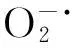
上述实验结果表明,VC和VE联合作用后,总体来看抗氧化活性比单独作用强,表现出一定的协同效应.VC和VE之间的相互作用和协同效应可能是在清除自由基过程中,VE可与自由基结合成生育酚自由基,而生育酚自由基又可与另一自由基反应生成非自由基产物-生育醌,进而发挥其抗氧化作用;而VC除了可以与自由基直接反应外,还可以把氧化型的维生素E还原成还原型维生素E,使其继续发挥抗氧化作用[20],这可能是两者产生协同作用的重要原因.VC和VE联用在不同体系中表现出优异的抗氧化活性且效果强于单独作用,这一结果对于揭示VC和VE联合抗氧化机理、分析不同比例的VC和VE的联用效果及其在临床上的进一步应用会有所帮助.同时,随着对其活性研究的深入,相信其在医药、保健食品及临床应用等领域将具有更加广泛的应用.
参考文献:
[1]ARRIGONIO,DETULLIOMC.Ascorbicacid:muchmorethanjustanantioxidant[J].Biochim Biophys Aeta,2002,1569(1-3):1-9.
[2]BOYACIOGLUM,SEKKINS,KUMC,etal.TheprotectiveeffectsofvitaminContheDNAdamage,antioxidantdefensesandaortahistopathologyinchronichyperhomocysteinemiainducedrats[J].Experimental and Toxicologic Pathology,2014,66(9-10):407-413.
[3]ETSUON.RoleofvitaminEasalipid-solubleperoxylradicalscavenger:invitroandinvivoevidence[J].Free Radical Biology and Medicine,2014,66(8):3-12.
[4]KALENDERS,KALENDERY,OGUTCUA,etal.Endosulfan-inducedcardiotoxicityandfreeradicalmetabolisminrats:theprotectiveeffectofvitaminE[J].Toxicology, 2004,202(3):227-35.
[5]BAUTISTA-ORTEGAJ,CORTES-CUEBASA,ELLISEA,etal.SupplementalL-arginineandvitaminsEandCpreservexanthineoxidaseactivityinthelungofbroilerchickensgrownunderhypobarichypoxia[J].Poult Sci,2014,93(4):979-88.
[6]PRABUSM,SHAGIRTHAK,RENUGADEVIJ.Quercetinincombinationwithvitamins(CandE)improveoxidativestressandhepaticinjuryincadmiumintoxicatedrats[J].Biomedicine & Preventive Nutrition,2011,1(1):1-7.
[7]ROWELORIA,DEGTYAREVAN,DOETSCHPW.DNAdamage-inducedreactiveoxygenspecies(ROS)stressresponseinSaccharomycescerevisiae[J].Free Radical Biology and Medicine,2008,45(8):1167-1177.
[8]张学明,胡新颖.沙棘油乳剂的制备研究[J].实用中医药杂志,2007,23(4):261.
[9]OYAIZUM.Studiesonproductsofbrowningreactions:Antioxidativeactivitiesofproductsofbrowningreactionpreparedfromglucosamine[J].Japanese Journal of Nutrition,1986,44(6):307-315.
[10]刘国安,孙志鹏,杨庆明,等.大麦提取物抗氧化活性测定[J].西北师范大学学报:自然科学版,2013,49(2):80-83.
[11]刘立明,刘丽虹,宋功武,等.分光光度法测定Fenton反应产生的羟自由基[J].湖北大学学报:自然科学版,2002,24(4):326-328.
[12]陈美珍,余杰,龙梓洁,等.龙须菜多糖抗突变和清除自由基作用的研究[J].食品科学,2005,26(7):219-222.
[13]KWONHY,CHOISY,WONMH,etal.OxidativemodificationandinactivationofCu,Zn-superxidedismutaseby2,2′-azobis(2-amidinopripane)dihydrochloride[J].Biochim Biophys Acta,2000,1543(1):69-76.
[14]LIUGA,ZHENGRL.ProtectionagainstdamagedDNAinsinglecellbypolyphenols[J].Die Pharmazie,2002,57(12):852-854.
[15]FUJIWARAY,SAHASHIY,ARITROM,etal.EffectofsimultaneousadministrationofvitaminC,L-cysteineandvitaminEonthemelanogenesis[J].Biofactors,2004,21(1-4):415-8.
[18]WANG H L,ZHANG D F,LUO ZH F.In vitro study on the genotoxicity of dichloromethane extracts of valerian(DEV) in human endothelial ECV304 cells and the effect of vitamins E and C in attenuating the DEV-induced DNA damage[J].ToxicolgyandAppliedPharmacology,2003,188(1):36-41.
[19]LAMBERT J D,ELIAS R J.The antioxidant and pro-oxidant activities of green tea polyphenols:a role in cancer prevention[J].ArchivesBiochemistryandBiophysics,2010,501(1):65-72.
[20]PADAYATTY S J,KATZ A,WANG Y,et a1.Vitamin C as an antioxidant:evaluation of its role in disease prevention[J].JAmCollegeNutr,2003,22(1):18-35.
(责任编辑俞诗源)
E-mail:liuguoan@nwnu.edu.cn
Antioxidant activity studies of vitamin C and vitamin E
LIU Guo-an,LI Jie-lin,LI Shuang-yue,YE Jin-feng,DING Lan
(College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China)
Abstract:Vitamin C and Vitamin E have many physiological activities,and both are antioxidant.However,their combinative actions in biochemistry system are rarely reported.In this paper,the methods of K3Fe(CN)6, methyl violet,pyrogallol autoxidation and DMPD·+are used to measure the reducing activity,the scavenging ability on hydroxyl radical,superoxide anion and DMPD·+of vitamin C and vitamin E treatment alone or combination.Moreover,the methods of SDS-PAGE and SCGE are used to detect the protein oxidative degradation and cell DNA damage.The results indicate that vitamin C and vitamin E exhibits significant antioxidant activities in different antioxidant systems,and the effect shows a concentration-dependent manner.Vitamin C exhibit stronger abilities of reducing and scavenging free radical than Vitamin E.The combination effect of two Vitamins shows stronger action than anyone alone in most systems,which presents synergistic interaction.In addition,both Vitamin C and Vitamin E play an important role in protecting protein from oxidative damage caused by AAPH,the effect become obvious when two compounds are combined.But their combinative protect actions have not been observed in cell DNA oxidative damage.
Key words:Vitamin C;Vitamin E;free radical;antioxidant activity;combinative action
中图分类号:Q 564;Q 566
文献标志码:A
文章编号:1001-988Ⅹ(2015)02-0066-07
作者简介:刘国安(1964—),女,河北滦南人,教授,博士,硕士研究生导师.主要研究方向为生物化学与药理学.
基金项目:国家自然科学基金资助项目(30960464);教育部留学回国人员科研启动基金资助项目 国家自然科学基金资助项目(81060180,81360333)
收稿日期:2014-09-21;修改稿收到日期:2014-11-14 2014-05-12;修改稿收到日期:2014-12-16 2014-10-10;修改稿收到日期:2014-11-19

