前、后循环脑梗死患者脑微出血灶分布的比较研究
孔敏露 曹志坚 章正祥 王珏 秋超 陈强 邓玉 侯群
前、后循环脑梗死患者脑微出血灶分布的比较研究
孔敏露 曹志坚 章正祥 王珏 秋超 陈强 邓玉 侯群
脑微出血是一种亚临床的终末期微小血管病变导致的含铁血黄素沉积,广泛存在于脑血管疾病、阿尔茨海默病、血管认知障碍患者以及正常老年人群中[1]。MRI对于脑部疾病的诊断具有重大意义,而当前的研究对于前、后循环脑梗死患者脑微出血灶分布特点及其高危因素的阐述,仍不是很清楚。磁敏感加权成像(SWI)采用高分辨率三维扰相梯度回波(GRE)序列可较常规MRI更充分显示脑微出血灶,弥补了MRI传统序列的不足[2]。我们采用基于MRI的SWI对前、后循环脑梗死患者脑微出血灶的特点及其相关高危因素进行研究,现将结果报道如下。
1 对象和方法
1.1 对象 收集2012年5月至2013年12月我院收治的急性脑梗死患者21例,男10例,女11例,年龄38~86(65.33±12.86)岁。脑梗死灶位于基底核-侧脑室即前循环(基底核-侧脑室组)15例,其中男8例,女7例,年龄38~86(65.87±12.46)岁;发病时间1~7(2.67±2.23)d;脑梗死灶位于脑桥即后循环(脑桥组)6例,其中男2例,女4例,年龄48~86(64.00±14.97)岁;发病时间1~10(5.00±3.52)d。纳入标准:(1)经我院临床及影像学确诊为原发性脑梗死;(2)发病时间14d以内;(3)患者一般状况良好。排除标准:(1)其他原因,如药源性、外伤性及不明原因等引起的急性脑梗死;(2)有严重心血管疾病、肝肾功能障碍等;(3)体内有金属植入物,如手术闭合器、金属标记物、心脏支架、起搏器、心脏人工瓣膜等。
1.2 方法
1.2.1 入院美国国立卫生研究院卒中量表(NIHSS)评分 对纳入研究的患者在其入院后即进行NIHSS评分,逐项评定,计算总分。NIHSS评分包含意识、眼球运动、视野、面瘫、上下肢运动、共济、感觉、语言、构音障碍、忽视症等项目。该量表用于评估脑卒中患者神经功能缺失程度及预测其预后。
1.2.2 MRI检查方法 检查前向患者交代检查持续时间,消除其紧张情绪,告知患者不要移动体位,避免因体位变化产生运动伪影,影响图像采集。采用德国西门子公司的MAGNETOM Verio3.0T超导型MRI扫描仪,选用32通道头相控阵线圈。对所有患者行常规横断面T1WI、T2WI、弥散加权成像(DWI)扫描及SWI扫描。T1WI、T2WI:采用FSE序列进行扫描。DWI:采用单次激发回波平面成像(SE-EPI)技术进行扫描。SWI:采用GRE序列进行扫描,扫描参数:重复时间28ms,回波时间20ms,各向异性分数15°,层厚/层间距1.2/0.5,扫描野256×256 mm2,矩阵320×240。
1.2.3 图像后处理 所有图像均使用SPIN软件进行处理。处理后可得到4组图像:幅度图、相位图、SWI图及最小密度投影图(MIP)。
1.2.4 图像观察与分析 首先应用SWI观察脑微出血灶:表现为均一、圆形、边界清楚、直径在2~5mm之间周围无水肿的低信号区。结合相位图排除脑内点状钙化灶(点状钙化灶与脑微出血灶在相位图上呈现相反的信号特征),结合MIP排除大脑各动脉远端分支横断面的流空影(血管为连续性走形),同时排除苍白球区域两侧对称的代表着钙化的低信号影、血管瘤及血管畸形。脑微出血灶按照皮质-皮质下区、基底核-丘脑区和幕下区分别计数。
1.3 统计学处理 采用SPSS12.0统计软件,计量资料以表示,组间比较采用独立样本t检验。计数资料以百分率表示,组间比较采用χ2检验。等级资料采用秩和检验。相关性分析采用Spearman相关分析。
2 结果
2.1 两组患者临床特征的比较 见表1。

表1 两组患者临床特征的比较
由表1可见,两组患者的临床特征比较均无统计学差异(均P>0.05),说明各组间有可比性。
2.2 两组不同部位的脑梗死患者脑微出血灶部位及个数的比较 见表2。
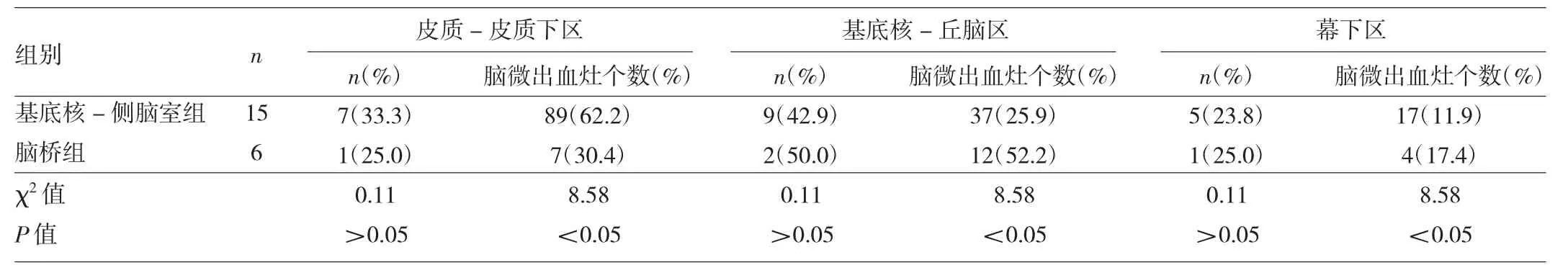
表2 两组不同部位的脑梗死患者脑微出血灶部位及个数的比较
由表2可见,两组皮质-皮质下区、基底核-丘脑区及幕下区发生脑微出血的患者例数比较差异均无统计学意义(均P>0.05)。但两组皮质-皮质下区、基底核-丘脑区及幕下区发生脑微出血灶的个数比较差异均有统计学意义(均P<0.05)。其中,基底核-侧脑室组中皮质-皮质下区脑微出血灶个数最多(89/143),脑桥组中基底核-丘脑区脑微出血灶个数最多(12/23)。2.3 发生脑微出血的危险因素分析 Spearman相关分析显示,脑微出血的发生与年龄、责任病灶(基底节-侧脑室组、脑桥组)、入院至发病时间、入院NIHSS评分、高血压级别、收缩压、舒张压、有无糖尿病、有无高脂血症、脑白质病变分级,均无明显相关性(r=-0.20、0.37、0.25、-0.25、-0.09、-0.08、0.15、-0.28、-0.35、-0.30,均P> 0.05)。
3 讨论
脑微出血泛指<5 mm的小出血灶[3]。局限于皮质区的脑微出血主要与淀粉样血管病有关;深部脑微出血多与高血压或动脉粥样硬化所致的小血管病变相关[4-6]。脑微出血灶吸收后,在出血的位置会有含铁血黄素残留,含铁血黄素是一种顺磁性物质[7]。梯度回波T2WI与SWI可以显示脑微出血灶。SWI对静脉结构、血液代谢物、铁质沉积的改变十分敏感[8],能更好地显示出血、铁沉积和静脉血管,甚至可以检测到小于一个体素的血管,较梯度回波T2WI具有更多优势。
临床研究表明脑微出血的发生与卒中相关危险因素,如:高龄、吸烟、饮酒、高血压、颈动脉内膜增厚、脑白质病变等密切相关。高血压病、糖尿病、高脂血症是影响脑微出血发生的显著因素[9]。高血压患者血管危险分级与脑微出血灶数量存在着正相关,脑微出血灶在脑内各个区域都有分布,以基底核区及丘脑区好发[10]。脑微出血的发生与纤维蛋白原含量、腔隙性脑梗死数目以及脑白质疏松程度相关[11-13]。脑梗死病史是深部脑微出血发病的独立危险因素[14]。对老年期极高危型脑梗死患者,40mg组、20mg组降脂治疗前后脑微出血灶数量差异均无统计学意义(均P>0.05)[15]。本研究表明,脑微出血的发生与年龄、责任病灶(基底核-侧脑室组、脑桥组)、入院至发病时间、入院时NIHSS评分、高血压级别、收缩压、舒张压、有无糖尿病、有无高脂血症、脑白质病变分级等因素的相关分析无统计学意义。不同责任血管病变导致的脑微出血可能有其独特的发病机制,有待于进一步研究。
脑微出血的解剖评定量表按传统解剖学将脑微出血分为脑叶、深部和幕下3级[16]。脑叶包括皮质和皮质下白质;深部包括基底核、丘脑、内囊、外囊和胼胝体、深部和室周脑白质;幕下包括脑干和小脑。脑微出血好发部位依次为皮质-皮质下区(37.0%)、基底核(30.7%)、丘脑(14.8%),脑干(11.5%),小脑(6.1%)[17]。本研究发现基底核-侧脑室组中脑微出血好发部依次为皮质-皮质下区(89/143)、基底核-丘脑区(37/143)、幕下区(17/ 143);脑桥组中脑微出血好发部位依次为基底核-丘脑区(12/23)、皮质-皮质下区(7/23)、幕下区(4/23)。基底核-侧脑室组中脑微出血好发部位与之前的报道基本上一致,而脑桥组脑微出血好发部位与基底核-侧脑室组不同。
脑微出血的发生与年龄密切相关,61~70岁人群脑微出血好发于基底核-丘脑区和皮层-皮层下区,70岁以上的人群脑微出血好发于幕下区[18]。本研究主要针对于年龄为38~86(65.33±12.86)岁的急性脑梗死患者的脑微出血灶分布特点进行研究,前、后循环脑梗死患者的脑微出血均好发于皮质-皮质下区和基底核-丘脑区。
临床研究已表明,脑微出血与老年人记忆力下降、思维迟缓等认知功能下降有关,而MRI的SWI则可用于脑微出血的早期诊断。同时对其危险因素进行及时控制,对减少脑微出血的发生及延缓认知功能障碍有积极意义。另外,本研究总结了急性脑梗死患者脑微出血的好发部位,为其发病机制的进一步研究提供了坚实的依据。但是由于时间和经验有限,样本量相对较少,研究结果有待于进一步验证,今后将增加样本量进一步完善不同血管支配的脑梗死所致脑微出血灶区域分布研究。
[1] 肖露露,杜娟,朱武生.脑微出血预测颅内出血的研究进展[J].中国脑血管病杂志,2012,9(11):600-603.
[2] 郑玲,刁强,李林,等.磁共振磁敏感加权成像技术在颅内微出血中的应用价值[J].医学研究生学报,2010,23(5):511-513.
[3] 张琳,漆剑频,朱文珍,等.磁敏感成像在脑微出血诊断中的应用价值[J].放射学实践,2009,24(1):19-22.
[4] Hawkes C A,Sullivan P M,Hands S,et al.Disruption of arterial perivascular drainage of amyloid-β from the brains of mice expressing the human APOEε4 allele[J].PloS one,2012,7(7):e41636.
[5] Dierksen G A,Skehan M E,Khan M A,et al.Spatial relation between microbleeds and amyloid deposits in amyloid angiopathy [J].Annals of neurology,2010,68(4):545-548.
[6] Charidimou A,Werring D J.Cerebral microbleeds:detection, mechanisms and clinicalchallenges[J].Future Neurology,2011,6 (5):587-611.
[7] Fazekas F,Kleinert R,Roob G,et al.Histopathologic analysis of foci of signal loss on gradient-echo T2*-weighted MR images in patients with spontaneous intracerebral hemorrhage:evidence of microangiopathy-related microbleeds[J].AJNR Am J Neuroradiol,1999,20(4):637-642.
[8] Haacke E M,Mittal S,Wu Z,et al.Susceptibility-weighted imaging: technical aspects and clinical applications,part 1[J].AJNR Am J Neuroradiol,2009,30(1):19-30.
[9] 徐劲,张驰,马慧,等.脑微出血与脑卒中相关性的临床研究[J].中风与神经疾病杂志,2014,31(3):219-221.
[10] 张国华,郑素君,郑海澜,等.SWI评估高血压患者心血管危险分层与脑内微出血相关性的研究[J].医学影像学杂志,2014,24(1):25-28.
[11] 侯晶晶,李尧,吴继星,等.急性缺血性卒中患者脑微出血相关因素分析[J].中国卒中杂志,2013,8(7):544-550.
[12] 范刚峰,张微微,黄勇华.影响脑微出血严重程度的危险因素分析[J].中国脑血管病杂志,2013,10(9):472-476.
[13] 邵璐斐,刘金芳,刘燕鹏,等.急性缺血性卒中患者脑微出血的危险因素研究[J].宁夏医科大学学报ISTIC,2014,36(7):775-778.
[14] 陈颖.老年脑微出血分布特点及相关危险因素的分析[J].中国当代医药,2013,20(36):55-56.
[15] 钟静玫,白洁,丁里,等.不同强化降脂治疗对老年脑梗死安全性的比较[J].中国老年学杂志,2014,34(18):5095-5097.
[16]Gregoire S,Chaudhary U,Brown M,et al.The Microbleed Anatomical Rating Scale (MARS)Reliability of a tool to map brain microbleeds[J].Neurology,2009,73(21):1759-1766.
[17] 林莉,纪建松,韦铁民,等.高血压脑卒中患者的脑微出血临床特点[J].中华高血压杂志,2013,21(3):227-231.
[18] 孔庆奎,苏慧,段鲁勤.脑微出血与年龄的相关性研究[J].泰山医学院学报,2012,33(5):321-324.
2015-03-03)
(本文编辑:杨丽)
310053 杭州,浙江中医药大学附属第一医院神经内科(孔敏露系浙江中医药大学第一临床医学院硕士研究生)
侯群,E-mail:houqun168@163.com

