盐酸埃克替尼治疗晚期非小细胞肺癌的临床研究
庞林荣 陈俊 黄佳 徐彩虹 李晖 郑宏瑜
盐酸埃克替尼治疗晚期非小细胞肺癌的临床研究
庞林荣 陈俊 黄佳 徐彩虹 李晖 郑宏瑜
目的钼观察和评价表皮细胞生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)类药物盐酸埃克替尼单药治疗晚期非小细胞肺癌(NSCLC)的疗效及毒副反应,并分析影响疗效的相关因素。 方法 分析72例ⅢB期及Ⅳ期NSCLC患者,所有患者均口服盐酸埃克替尼125mg,3次/d,分析患者临床特点及其与客观有效率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)的关系,以及症状缓解、毒副反应情况。 结果 72例患者中有4例因毒副反应或其他原因而停药。余下68例患者中,部分缓解30例(44.1%),疾病稳定19例(27.9%),疾病进展19例(27.9%)。ORR为44.1%,DCR为72.0%,中位PFS 6.0个月。ORR及DCR在不同性别、不同美国东部肿瘤协作组(ECOG)评分、不同病理类型、不同EGFR突变状态及不同皮疹状态之间的比较差异均有统计学意义(P<0.05或0.01)。Kaplan-Meier法生存分析显示PFS在不同TNM分期、病理类型、EGFR突变状态以及皮疹状态患者间的比较差异有统计学意义(P<0.05)。全组有42例(61.8%)患者在治疗后有不同程度的症状缓解。治疗相关毒副反应主要为皮疹34例(50.0%),腹泻16例(23.5%),其他毒副反应包括转氨酶升高、食欲不振、乏力、恶心、呕吐、头晕等。 结论 盐酸埃克替尼单药治疗晚期NSCLC疗效肯定,对于EGFR突变患者有效率更高,治疗相关毒副反应较轻,患者耐受性好,为晚期NSCLC患者治疗带来新希望。
盐酸埃克替尼 非小细胞肺癌 临床疗效 毒副反应
肺癌是目前威胁人类健康的主要癌症之一[1]。其中80%~85%为非小细胞肺癌(NSCLC),且多数患者确诊时已处于晚期(ⅢB期或Ⅳ期)。化疗一直是晚期NSCLC的基本治疗方式,但疗效有限,患者的中位生存时间仅约10个月[2]。化疗药物毒副反应、耐药等问题使患者生活质量下降,治疗效果受限。近年来,小分子靶向药物的出现使NSCLC的治疗进入了个体化治疗模式。表皮细胞生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)类药物的问世,显著改善了NSCLC的临床疗效。目前EGFR-TKIs的代表药物吉非替尼及厄洛替尼已广泛应用于晚期NSCLC的治疗。2011年8月我国第一个具有自主知识产权的新型小分子靶向药——盐酸埃克替尼正式应用于晚期NSCLC患者的治疗。笔者对本院近年来采用盐酸埃克替尼治疗的NSCLC患者的疗效及安全性进行了观察和分析,现将结果报道如下。
1 资料和方法
1.1 一般资料 选取本院2012年9月至2013年9月治疗的NSCLC患者72例,其中男38例,女34例,年龄35~79(59.12±16.91)岁;根据国际肺癌研究协会(IASLC)第7版NSCLC TNM临床分期标准,ⅢB期25例,Ⅳ期47例;有肺外转移38例,主要为骨转移(25例)及脑转移(11例)。腺癌60例,鳞癌12例;行EGFR突变检测51例(手术标本29例,活检标本17例,其它组织标本5例),采用焦膦酸测序法测得突变型33例(其中外显子19缺失突变19例,外显子21 L858R突变14例),野生型18例;美国东部肿瘤协作组(ECOG)评分0~1分31例,2分30例,3分11例。既往未曾行其他治疗(一线治疗)的患者15例,曾行一种或多种治疗方案但治疗失败的患者(二线治疗)57例。纳入标准:(1)组织学或细胞学检查确诊NSCLC的ⅢB期或Ⅳ期;(2)血常规、肝肾功能及心电图均正常。排除标准:(1)无可测量的临床病灶;(2)服用盐酸埃克替尼过程中伴有其它可能影响患者疗效评价的治疗手段,如放疗、介入治疗等;(3)未控制的中枢神经系统症状;(4)5年内患有其他恶性肿瘤;(5)患有严重感染、充血性心力衰竭、间质性肺炎等全身系统疾病;(6)有EGFR靶向药物治疗史及间质性肺炎病史。
1.2 方法
1.2.1 盐酸埃克替尼治疗 所有患者均接受盐酸埃克替尼(商品名:凯美纳,浙江贝达药业有限公司产品,批号20120205-20130406)治疗。服用方法为口服125mg,3次/d,连续服用至疾病出现进展(所有靶病灶的长径总和增加至少20%,并且长径总和增加的绝对值在5mm以上;或是出现新的病灶)或不能耐受毒副反应时终止治疗。服药期间禁用其他抗肿瘤治疗。所有患者均为自愿接受治疗,本研究经我院伦理委员会批准。
1.2.2 疗效评估实施方法 治疗开始前1周,对患者进行全面基础情况检查,包括胸腹部CT、骨ECT、头颅MRI等,治疗开始1个月后每2个月接受1次CT和其它影像学检查进行疗效评价,分别与治疗前1周基线检查结果进行对比以判定疗效。
1.2.3 疗效评价标准 根据实体瘤疗效评价标准(RECIST 1.1)进行疗效评价,将疗效分为4级:完全缓解、部分缓解、疾病稳定、疾病进展。客观有效率(ORR)=(完全缓解+部分缓解)/全部患者×100%。疾病控制率(DCR)=(完全缓解+部分缓解+疾病稳定)/全部患者× 100%。患者近期疗效以ORR及DCR反映,分析近期疗效与临床特征的关系。
1.2.4 生存期的定义及获得方法 患者无进展生存期(PFS)及总生存期(OS)通过门诊或住院随访获得,随访时间为患者开始服用盐酸埃克替尼至患者死亡或2014年1月31日,进一步分析患者PFS、OS与临床特征的关系。PFS为从首次服药到出现终点事件(客观证据证实疾病进展或任何原因引起死亡)的时间。OS为首次服药开始至出现终点事件(患者死亡或末次随访)的时间。1.2.5 症状缓解情况 统计在治疗后症状(包括咳嗽、喘憋、疼痛、声嘶、咯血等)发生不同程度缓解的患者,以及ECOG评分改善情况、症状缓解和ECOG评分改善出现时间。
1.2.6 毒副反应评价标准 毒副反应按照美国国家癌症研究所(NCI)制定的毒副反应标准(CTC第3版)评价毒副反应,统计随访期间发生毒副反应患者的例数,按毒副反应严重程度分为0~Ⅳ度共5个等级。
1.3 统计学处理 采用SPSS17.0统计软件,不同临床特征中的客观有效率及疾病控制率比较采用χ2检验或Fisher精确概率法,PFS以中位数表示,采用Kaplan-Meier法绘制生存曲线,不同临床特征患者间的比较采用log-rank检验。
2 结果
2.1 治疗完成情况 由于不能耐受药物毒副反应或其他非药物原因自行停药者4例,因此获得有效随访68例。其中,无完全缓解病例,部分缓解30例(44.1%),疾病稳定19例(27.9%),疾病进展19例(27.9%)。由此得出ORR为44.1%,DCR为72.0%。截至随访结束,共33例患者死亡,其中EGFR突变患者13例,野生型患者9例,突变状态未知患者11例。发生PFS终点事件患者占病例数的97.1%(66/68),全组中位PFS 6.0个月(95%CI 4.90~7.10个月)。EGFR突变患者中因超过半数尚未达到OS终点事件,故尚无法统计中位OS值。17例野生型患者的中位OS时间为9.2个月。
2.2 68例患者临床特征与盐酸埃克替尼治疗近期疗效的关系 见表1。
由表1可见,女性、EGFR突变患者的ORR、DCR分别优于男性、野生型或突变状态未知的患者,比较差异均有统计学意义(P<0.05或0.01)。ECOG评分为0~1分、腺癌患者的DCR分别优于评分为2~3分、鳞癌的患者,差异均有统计学意义(均P<0.05)。皮疹患者的ORR优于无皮疹的患者,差异有统计学意义(P<0.01)。不同年龄、TNM分期、是否为一线治疗及是否有吸烟史、脑转移、骨转移、腹泻的ORR、DCR比较差异均无统计学意义(均P>0.05)。此外,外显子19缺失突变患者的ORR、DCR分别为89.5%(17/19)及100%(19/19),外显子21 L858R突变患者的ORR、DCR分别为46.2%(6/ 13)及92.3%(12/13)。两者的ORR比较,差异有统计学意义(P<0.05),两者的DCR比较,差异无统计学意义(P>0.05)。

表1 68例患者临床特征与盐酸埃克替尼治疗近期疗效的关系
2.3 临床特征与盐酸埃克替尼治疗的PFS关系 见表2。
由表2可见,TNM分期ⅢB期、腺癌、EGFR突变及服药后出现皮疹的患者的中位PFS分别优于Ⅳ期、鳞癌、EGFR野生型、未出现皮疹的患者(P<0.05或0.01)。不同TNM分期、病理类型、EGFR及皮疹状态患者的生存曲线见图1-4。不同性别、年龄是否≥65岁、不同ECOG评分、是否为一线治疗及是否有吸烟史、脑转移、骨转移及腹泻情况的PFS比较差异均无统计学意义(均P>0.05)。此外,外显子19缺失突变患者的中位PFS为9.0(7.74~10.27)个月,外显子21 L858R突变患者的中位PFS为7.6(5.40~9.80)个月,两者比较差异无统计学意义(χ2=2.17,P>0.05)。

表2 临床特征与盐酸埃克替尼治疗PFS的关系

图1 不同TNM分期患者的生存曲线
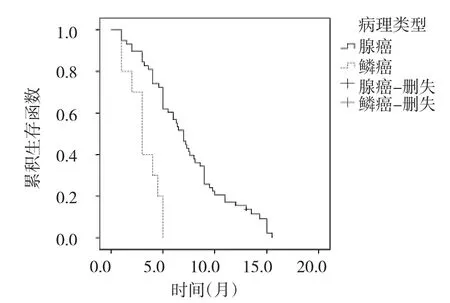
图2 不同病理类型患者的生存曲线

图3 不同EGFR状态患者的生存曲线

图4 不同皮疹状态患者的生存曲线
2.4 症状缓解情况 全组有42例(61.8%)患者在治疗后有不同程度的症状缓解,主要为咳嗽、喘憋、疼痛、声嘶等。服药2~16d症状改善,中位起效时间为10d。在治疗1个月后ECOG评分上升5例,评分下降37例,评分无变化26例。
2.5 盐酸埃克替尼治疗NSCLC的毒副反应情况 见表3。

表3 盐酸埃克替尼治疗NSCLC的毒副反应情况[例(%)]
由表3可见,68例患者出现的主要毒副反应为皮疹和腹泻,多数表现为Ⅰ~Ⅱ度。皮疹和腹泻经对症处理后好转。其他少见毒副反应包括转氨酶升高、食欲不振、乏力、恶心、呕吐、头晕等,均为Ⅰ~Ⅱ度,多无需特殊处置。无间质性肺炎出现。
3 讨论
与化疗或安慰剂相比,EGFR-TKIs极大地提高了NSCLC治疗的临床疗效和安全性[3-4]。EGFR基因突变能提高肿瘤对EGFR-TKIs的治疗敏感性[5-6],而亚洲人群中的EGFR基因突变率(40%~50%)高于白种人群(10%)[7-9],因此亚洲人群能明显受益于EGFR-TKIs治疗,其中位生存时间在EGFR突变患者中已经超过2年[3,10]。
盐酸埃克替尼是我国自主研发的EGFR-TKIs药物,也是继吉非替尼和厄洛替尼后第3种EGFR-TKIs药物。1项纳入103例患者、包含10个剂量组的Ⅱ期剂量递增研究进一步证实了盐酸埃克替尼的临床疗效。该研究中29.2%的患者获得客观缓解,疾病控制率达到78.1%,有3例患者获得完全缓解[11]。2009年,Mok等[12]在IPASS临床研究中,共有609例患者接受吉非替尼靶向治疗,ORR达43.0%,明显高于同期化疗组(32.2%),EGFR突变人群的ORR(71.2%)明显优于化疗(47.3%),无进展生存期较化疗组显著延长(9.5个月和6.3个月,P<0.0001),而EGFR野生型患者刚好相反,吉非替尼组的无进展生存期(1.6个月)短于化疗组(5.5个月,P<0.0001),研究结果提示亚裔、腺癌、不吸烟及女性患者是靶向治疗的优势人群。ICOGEN是第一个头对头比较盐酸埃克替尼与吉非替尼疗效的Ⅲ期临床研究。结果显示,两药疗效相近,盐酸埃克替尼组与吉非替尼组的ORR分别为27.6%、27.2%,差异无统计学意义[13-14]。但盐酸埃克替尼毒副反应低于吉非替尼。本组患者ORR为44.1%,优于ICOGEN(27.6%),可能与本研究中EGFR突变、女性和腺癌的患者比例高于ICOGEN研究有关,也与治疗过程中医师的优势人群选择偏倚有关。本组DCR与ICOGEN研究相似(72.0%vs 75.4%)。
ICOGEN的亚组分析中,盐酸埃克替尼治疗晚期NSCLC的疗效与临床分期、性别、病理类型、吸烟史及ECOG评分有关,差异有统计学意义。多项研究显示,EGFR突变的患者接受EGFR-TIKs治疗的生存期或临床缓解率优于野生型患者[5-6,15]。在ISEL研究中,接受吉非替尼治疗的EGFR突变患者的客观缓解率高于野生型患者[6/16例(37.5%)vs 3/116例(2.6%)][16]。本研究结果显示,盐酸埃克替尼的疗效与性别、ECOG评分、病理类型、EGFR突变状况及是否存在皮疹相关,女性患者、EGFR突变患者的ORR及DCR分别优于男性及EGFR野生型患者,ECOG评分为0~1的患者、腺癌患者的DCR分别优于ECOG评分为2~3分患者、鳞癌患者,有皮疹患者的ORR优于无皮疹患者。外显子19缺失突变和外显子21 L858R突变是目前最主要的两种突变类型。有研究显示外显子19缺失突变患者服用EGFR-TKIs的疗效好于外显子21 L858R突变患者[17]。ICOGEN研究中,外显子19缺失与外显子21 L858R错义突变患者的ORR分别为88%比22%[14]。本研究结果同样提示外显子19缺失患者的ORR好于外显子21 L858R突变的患者。
本研究通过68例NSCLC患者服用盐酸埃克替尼的疗效分析表明,患者的中位PFS达到6.0个月,略高于ICOGEN中盐酸埃克替尼治疗组(4.6个月),可能与突变比例较高有关。IPASS研究提示EGFR突变人群中,吉非替尼组的PFS要长于化疗组。ICOGEN研究中29例具有EGFR突变的患者服用盐酸埃克替尼,中位PFS为7.8个月,本研究为8.6个月。本研究17例EGFR野生型患者中位PFS为3.0个月,与TAILOR研究的野生型患者2.4个月的中位PFS接近[18],这提示盐酸埃克替尼对野生型患者有一定疗效。可能与肿瘤异质性、检测的假阴性或化疗后EGFR突变状态的改变及可能同时存在其他少见的未知EGFR-TKIs敏感性分子生物学机制有关。
BR.21试验中生存期影响因素为病理类型、吸烟状态和是否为亚裔有关[3]。本研究中单因素分析显示,患者中位PFS与肿瘤TNM分期、病理类型、EGFR状态及皮疹相关,差异有统计学意义。本研究中ⅢB期患者的中位PFS要优于Ⅳ期患者,可能与本研究ⅢB期患者中EGFR突变患者比例较高有关。本研究影响盐酸埃克替尼治疗的无进展生存期的单因素分析中显示,患者皮疹的发生可能可以延长PFS。发生皮疹的患者的中位PFS为7.0个月,而无皮疹的患者中位PFS为4.5个月。目前,对于皮疹的发生和EGFR-TKIs药物的临床疗效的关系还在研究中。Emery等[19]研究表明尽管皮疹的发生与厄洛替尼的临床疗效有关,但在吉非替尼的治疗中没有出现。故皮疹的发生与盐酸埃克替尼的临床疗效之间的关系仍有待于探讨。Jackman等[20]报道在接受EGFRTKIs治疗的EGFR突变患者中,外显子19缺失患者较外显子21 L858R突变者的生存期延长,本研究结果提示外显子19缺失患者中位PFS较外显子21 L858R突变患者有延长趋势,但差异无统计学意义,可能与本研究样本量偏少有关。
本研究显示盐酸埃克替尼治疗后,患者的临床症状明显好转,症状缓解的中位起效时间为10d,缓解程度较明显,主要缓解的症状为咳嗽、喘憋、疼痛、声嘶等。服用盐酸埃克替尼能有效的使患者的生活质量明显提高,与文献报道一致。
盐酸埃克替尼作为全球第3个被批准上市的EGFR-TKIs药物,其作用机制与吉非替尼、厄洛替尼相同,但由于结构式、药代动力等方面的差异,盐酸埃克替尼体现出了安全性更好和治疗窗口更大这一特点和优势。盐酸埃克替尼良好的安全性可能与其治疗窗较大,以及对激酶的高度选择性有关。此外,相较于仅由一种酶代谢的药物,盐酸埃克替尼通过多种酶代谢,如CYP2C19、CYP3A4、CYP2E1等[21]。本研究中盐酸埃克替尼治疗相关毒副反应主要为皮疹(50.0%)、腹泻(23.5%),其他少见毒副反应为转氨酶升高、食欲不振、乏力、恶心、呕吐、头晕等。根据ICOGEN在安全性方面的研究,盐酸埃克替尼毒副反应的发生率为60.5%,明显低于吉非替尼组70.4%,差异有统计学意义[14]。两者皮疹发生率分别为40%和49.2%;腹泻发生率分别为18.5%和27.6%。该研究有4例患者因不能耐受毒副反应而退出研究,均为吉非替尼组。本研究毒副反应发生率与严重程度较ICOGEN的相近,有2例患者因毒副反应不能耐受而停止服药,考虑和患者的耐受性不同有关。TRUST试验结果提示,5 015例患者安全性资料中期分析结果发现厄洛替尼主要毒副反应为皮疹,发生率为70%,多为轻、中度,Ⅲ、Ⅳ级皮疹为16%[22]。厄洛替尼相关严重不良事件发生率为5%,证明盐酸埃克替尼毒副反应的发生率和严重程度均低于吉非替尼和厄洛替尼。
综上所述,盐酸埃克替尼是由中国研发的具有自主知识产权的一种EGFR-TIKs类药物,临床研究结果显示,其单药治疗晚期NSCLC疗效肯定,与其他EGFR-TKIs相比安全性更优,可为晚期NSCLC患者的治疗带来曙光。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2] Schiller J H,Harrington D,Belani C P,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N EnglJ Med,2002,346(2):92-98.
[3] Shepherd F A,Rodrigues Pereira J,et al.Erlotinib in previously treated non-small-celllung cancer[J].N EnglJ Med,2005,353(2): 123-132.
[4] Kim E S,Hirsh V,Mok T,et al.Gefitinib versus docetaxel in previously treated non-small-cell lung cancer(INTEREST):a randomised phase IIItrial[J].Lancet,2008,372(9652):1809-1818.
[5] Lynch T J,Bell D W,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004, 350(21):2129-2139.
[6] Pao W,Miller V,ZakowskiM,et al.EGF receptor gene mutations are common in lung cancers from"never smokers"and are associated with sensitivity of tumors to gefitinib and erlotinib[J].Proc Natl A-cad SciU S A,2004,101(36):13306-13311.
[7] Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC):a multicentre,open-label,randomised phase 3 trial[J]. Lancet Oncol,2012,13(3):239-246.
[8] Shigematsu H,Lin L,Takahashi T,et al.Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J].J NatlCancer Inst,2005,97(5):339-346.
[9] Hirsch F R,Bunn P A Jr.EGFR testing in lung cancer is ready for prime time[J].Lancet Oncol,2009,10(5):432-433.
[10] Thatcher N,Chang A,Parikh P,et al.Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer:results from a randomised,placebo-controlled,multicentre study(Iressa Survival Evaluation in Lung Cancer)[J].Lancet,2005,366(9496):1527-1537.
[11] 谭芬来,张力,赵琼,等.国家一类新药盐酸埃克替尼的药理与临床评价[J].中国新药杂志,2009,18(18):1691-1694.
[12] Mok T S,Wu Y L,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957.
[13] Sun Y,Shi Y,Zhang L,et al.A randomized double-blind phase III study of icotinib versus gefitinib in patients with advanced non-smal cell lung cancer(NSCLC)previously treated with chemotherapy(ICOGEN)[J].J Clin Oncol,2011,29(suppl):7522.
[14] Shi Y,Zhang L,Liu X,et al.Icotinib versus gefitinib in previously treated advanced non-small-celllung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial[J].TheLancet Oncology,2013,14(10):953-961.
[15] Zhu C Q,da Cunha Santos G,Ding K,et al.Role of KRAS and EGFR as biomarkers of response to erlotinib in National Cancer Institute of Canada Clinical Trials Group Study BR.21[J].J Clin Oncol,2008,26(26):4268-4275.
[16] Hirsch F R,Varella-Garcia M,Bunn P A Jr,et al.Molecular predictors of outcome with gefitinib in a phase III placebo-controlled study in advanced non-small-cell lung cancer[J].J Clin Oncol,2006,24(31):5034-5042.
[17] Costa D B,KobayashiS.Are exon 19 deletions and L858R EGFR mutations in non-small-cell lung cancer clinically different?[J]. Br J Cancer,2007,96(2):399.
[18] Garassino M C,Martelli O,Bettini A,et al.TAILOR:A phase III trial comparing erlotinib with docetaxel as the second-line treatment of NSCLC patients with wild-type(wt)EGFR[J].J Clin Oncol,2012,30(suppl):7501.
[19] Emery I F,Battelli C,Auclair P L,et al.Response to gefitinib and erlotinib in Non-smallcelllung cancer:a restrospective study[J]. BMC Cancer,2009,18(9):333.
[20] Jackman D M,Miller VA,Cioffredi L A,et al.Impact of epidermal growth factor receptor and KRAS mutations on clinicaloutcomes in previously untreated non-small cell lung cancer patients:results of an online tumor registry of clinical trials[J].Clin Cancer Res,2009,15(16):5267-5273.
[21] Liu D,Jiang J,Zhang L,et al.Metabolite characterization of a novel anti-cancer agent,icotinib,in humans through liquid chromatography/quadrupole time-of-flight tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2011,25(15): 2131-2140.
[22] Gatzemeier U,ArdizzoniA,Horwood K,et al.Erlotinib in nonsmall cell lung cancer(NSCLC):Interim safety analysis of the TRUST study[J].J Clin Oncol,2007,25(18S):7645.
Icotinib hydrochloride monotherapy for patients with advanced non-small cell lung cancer
PANG Linrong,CHEN Jun,HUANG Jia,et al.Chemoradiotherapy Center,Yinzhou People's Hospital,Ningbo 315040,China
【 Abstract】 Objective To evaluate the efficacy and toxicity of icotinib hydrochloride monotherapy for patients with advanced non-small cell lung cancer(NSCLC). Methods Seventy two patients withⅢB or IVNSCLC were enrolled in this study from September 2012 to September 2013.All patients received Icotinib 125mg t.i.d.The objective response rate(ORR),disease control rate(DCR),progression free survival(PFS)and their influencing factors were analyzed.The symptoms relief,or adverse events were also analyzed. Results Among 72 patients,4 dropped from study due to side events or other reason.Among 68 evaluable patients,30(44.1%)had partial response,19(27.9%)had stable disease and 19(27.9%)had progressive disease. The objective response rate was 44.1%,the disease control rate was 72.0%,and the median progression free survival was 6 months.The ORR and DCR were correlated with gender,ECOG scores,pathological type,EGFR mutation status and rash(P<0.05).Kaplane-Meier survival analysis showed that PFS was significantly correlated to TNM stage,pathological type,EGFR mutation status and rash(P<0.05).Forty two patients(61.8%)had symptom relief after treatment.Skin rash was the most common drug-related adverse event,which occurred in 34 patients(50.0%),including gradeⅠtoⅡin 31 and gradeⅢtoⅣin 3. Diarrhea occurred in 16 patients(23.5%),including gradeⅠtoⅡin 15 and gradeⅢtoⅣin 1.Other toxic reactions included elevated transaminase,loss of appetite,fatigue,nausea and vomiting and dizzy. Conclusion Monotherapy with icotinib hydrochloride is effective and tolerable for patients with advanced NSCLC,especially for those with EGFR mutation.
Icotinib hydrochloride Non-small cell lung cancer Clinical effect Adverse effect
2014-06-17)
(本文编辑:杨丽)
315040 宁波市鄞州人民医院肿瘤放化疗中心
陈俊,E-mail:plr163@163.com

