秦巴蛹虫草原生质体的制备及再生条件研究
马跃腾,杜双田,丁 建,纪晓朋,鲍 蕊,李 珍
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
秦巴蛹虫草原生质体的制备及再生条件研究
马跃腾,杜双田,丁 建,纪晓朋,鲍 蕊,李 珍
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
【目的】 研究秦巴蛹虫草原生质体制备及再生的最适条件,建立高效制备和再生原生质体的方法。【方法】 以秦巴蛹虫草无性型菌株CM-16为材料,研究细胞壁裂解酶种类、酶解时间、酶解温度、菌丝体菌龄及稳渗剂种类对原生质体制备及再生效果的影响,并在单因素试验结果基础上进行正交优化试验。【结果】 (1)以0.6 mol/L NaCl为稳渗剂,用混合酶(质量分数1%纤维素酶和质量分数0.5%蜗牛酶按1∶1体积比混合)在(26±1) ℃对菌龄6 d的菌丝酶解3 h,原生质体的产量最高。(2)以0.6 mol/L甘露醇为稳渗剂,用混合酶(质量分数1%纤维素酶和质量分数0.5%蜗牛酶按1∶1体积比混合)在(26±1) ℃对菌龄5 d的菌丝酶解2 h,原生质体的再生率最高;验证试验结果表明,在此条件下,原生质体再生率平均为25.7%,此时原生质体平均产量为83.42×105mL-1。【结论】 对酶解温度、酶解时间、菌丝体菌龄、稳渗剂及酶系种类等条件的优化,可提高秦巴蛹虫草原生质体的产量及再生率。
秦巴蛹虫草;原生质体;原生质体制备;原生质体再生
原生质体技术是细胞生物工程育种新技术[1],围绕原生质体技术衍生出了很多新技术,如原生质体再生无性系[2-5]、单核原生质体技术[6-7]、原生质体诱变技术、原生质体融合以及原生质体技术与分子生物学相结合的方法。目前,除驯化野生菌种外,理化诱变和原生质体技术仍是食用菌菌种选育的重要手段[8]。据报道,通过原生质体技术可保持菌种优良性状,或进一步提高原始菌株的菌种活力,还可提供新优的变异材料[8-11]。
秦巴蛹虫草(Cordycepsmilitaris)是麦角菌科(Clavicipitaceae)虫生真菌,生长在陕西秦巴山区,其形态结构和活性成分与冬虫夏草相近[12-13],前人对秦巴蛹虫草的研究主要集中于其药理成分、人工培养等方面[12-14],迄今未见有关秦巴蛹虫草原生质体研究的资料报道。本试验采用菌丝体酶解法,对秦巴蛹虫草原生质体制备及再生的最适条件进行研究,以期建立较完善的秦巴蛹虫草原生质体遗传转化系统,为秦巴蛹虫草的菌种复壮、改良和诱变育种奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌种与培养基 菌种:秦巴蛹虫草无性型(Cordycepsmilitaris),菌株编号CM-16,由西北农林科技大学生命科学学院提供。
稳渗剂:将NaCl、MgSO4、甘露醇和葡萄糖分别以3.51,7.20,10.92,10.80 g溶解于100 mL磷酸缓冲液中,配制成0.6 mol/L溶液,高压灭菌30 min,4 ℃保存备用。
酶液:质量分数为1%的纤维素酶、质量分数为0.5%的蜗牛酶及二者的混合酶(体积比1∶1)。将固体酶按比例称好后溶于稳渗剂中,0.22 μm微孔滤膜过滤除菌,4 ℃保存备用。
母种培养基:马铃薯200 g/mL,蛋白胨2.0 g/mL,葡萄糖10 g/mL,蔗糖10 g/mL,KH2PO41.0 g/mL,MgSO40.5 g/mL,琼脂12 g/mL,H2O 1 000 mL,pH 7.0。
液体培养基:蛋白胨10 g/mL,葡萄糖10 g/mL,蔗糖10 g/mL,KH2PO41.0 g/mL,MgSO40.5 g/mL,柠檬酸铁铵0.5 g/mL,H2O 1 000 mL,pH 7.0,采用250 mL的三角瓶,每瓶装80 mL,瓶中放少量玻璃珠。
原生质体再生培养基:在母种培养基中加入稳渗剂 NaCl,使其终浓度为0.6 mol/L,pH 7.0。
1.1.2 试 剂 纤维素酶(MP Biomedicals安倍医疗器械公司)及蜗牛酶(Wolsen热默尔生物科技有限公司)购于陕西杨凌宇晨化玻站,其他化学试剂为国产分析纯。
1.2 方 法
1.2.1 液体菌种的培养 取活化的秦巴蛹虫草斜面菌种接于液体培养基中,在180 r/min、23 ℃下培养7 d。
1.2.2 原生质体的制备 原生质体的制备及纯化参照张银萍等[15]的方法。准备50 mL离心管,称质量并记录。将培养好的液体菌种倒入无菌离心管中,6 000 r/min离心10 min,吸出上清液,用稳渗剂洗涤沉淀2次再次离心,收集菌丝体并称质量。根据菌丝体质量,在无菌条件下按1∶1(菌丝体质量(g)∶酶液体积(mL))比例加入酶液,于25~30 ℃下酶解2.5~3 h,间歇振荡,整个过程需无菌操作。
1.2.3 原生质体的纯化 将酶解液6 000 r/min离心10 min,弃去酶液,沉淀为原生质体及细胞碎片的混合物,用稳渗剂清洗沉淀3次以除去酶液;再用稳渗剂重新悬浮沉淀,2 500 r/min离心10 min,取上清液,弃去沉淀,沉淀为大部分细胞碎片。将上清液于6 000 r/min离心10 min,弃上清液,沉淀即为原生质体,加入与酶液等体积的稳渗剂悬浮沉淀,即得到纯化的原生质体悬液,用血球计数板计数。用稳渗剂将原生质体悬液稀释至106~108mL-1。
1.2.4 原生质体的再生 吸取0.2 mL原生质体稀释液涂布于再生培养基上,23 ℃避光培养5~8 d,待菌落数稳定后计数,计算原生质体再生率。对照组用无菌水稀释后涂布于再生培养基。每个试验重复5次,结果取5次的平均值。
原生质体再生率=(原生质体再生菌落数-对照组菌落数)/原生质体总数×100%。
1.2.5 单因素对蛹虫草原生质体制备及再生的影响 (1) 裂解酶种类。以0.6 mol/L NaCl为稳渗剂,在pH 7.0、(26±1) ℃条件下对菌龄为5 d的菌丝体酶解2.5 h,裂解酶分别为质量分数1%的纤维素酶、质量分数0.5%的蜗牛酶及二者体积比1∶1的混合酶,并再生培养原生质体,研究裂解酶种类对原生质体产量及其再生率的影响。
(2)酶解时间。以0.6 mol/L NaCl为稳渗剂,在pH 7.0、(26±1) ℃条件下,利用混合酶酶解菌龄为5 d的菌丝体,酶解时间分别为1,2,3,4和5 h,并再生培养原生质体,研究酶解时间对原生质体产量及其再生率的影响。
(3)酶解温度。以0.6 mol/L NaCl为稳渗剂,利用混合酶对菌龄为5 d的菌丝体酶解2.5 h,酶解温度分别为15,20,25,30和35 ℃,pH 7.0,并再生培养原生质体,研究酶解温度对原生质体产量及其再生率的影响。
(4)菌丝体菌龄。以0.6 mol/L NaCl为稳渗剂,在pH 7.0、(26±1) ℃条件下用混合酶对菌丝体酶解2.5 h,菌丝体菌龄分别为4,5,6,7和8 d,并再生培养原生质体,研究菌龄对原生质体产量及其再生率的影响。
(5)稳渗剂种类。在pH 7.0、(26±1) ℃条件下,用混合酶对菌龄为5 d的菌丝体酶解2.5 h,稳渗剂分别是NaCl、葡萄糖、甘露醇和MgSO4,浓度均为0.6 mol/L,再生培养原生质体,研究稳渗剂种类对原生质体产量及其再生率的影响。
1.2.6 蛹虫草原生质体制备及再生的正交试验 依据单因素试验结果筛选出各因素的适宜范围进行正交组合试验,确定秦巴蛹虫草原生质体制备及再生的最佳条件;对秦巴蛹虫草原生质体再生的最佳条件进行验证,观察并记录原生质体产量、再生率及再生菌落特征。
2 结果与分析
2.1 单因素对蛹虫草原生质体制备及再生的影响
2.1.1 裂解酶种类 由图1可见,用混合酶制备原生质体的效果最好,同时原生质体再生率也最高。与蜗牛酶相比,单独使用纤维素酶制备原生质体的效果相对最差,同时其原生质体的再生率也较低。此结果说明:(1)原生质体产量较高时,再生率也较高;(2)混合酶比单一酶制备原生质体的效果好;(3)蜗牛酶酶解效果优于纤维素酶。这是因为蜗牛酶是含有纤维素酶、果胶酶、蛋白酶等20多种酶的复合酶,而纤维素酶主要由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等组成,由于高等真菌的细胞壁成分比较复杂,因此蜗牛酶酶解细胞壁的效果更好。
2.1.2 酶解时间 酶解时间对秦巴蛹虫草原生质体产量及再生率的影响见图2。

图1 裂解酶种类对秦巴蛹虫草原生质体产量及再生率的影响Fig.1 Effect of lyase type on protoplasts yield and regeneration rate of Cordyceps militaris

图2 酶解时间对秦巴蛹虫草原生质体产量及再生率的影响Fig.2 Effect of enzymolysis time on protoplasts yield and regeneration rate of Cordyceps militaris
从图2可以看出:(1)随着酶解时间的延长,原生质体产量逐渐增加,在3 h左右时,原生质体产量达到最大值;之后,随着酶解时间的延长,原生质体产量迅速下降。(2)酶解时间对原生质体的再生率也有明显影响,随着酶解时间的延长,原生质体再生率迅速增加,2 h左右时,原生质体再生率达到最大值;超过2 h后,原生质体再生率迅速降低。因为随着酶解时间的延长,细胞壁裂解程度逐渐加深,原生质体产量逐渐增加,超过一定限度后,会影响细胞膜的稳定性,易引起原生质体不稳定或破裂,其再生率有所下降。
2.1.3 酶解温度 由图3可见,随着酶解温度的升高,原生质体产量迅速增加,在25~28 ℃时较高,随着酶解温度的进一步升高,原生质体产量急剧下降。在25 ℃左右时,原生质体再生率也达到最大值。从曲线的变化趋势可见,酶解温度对原生质体产量及再生率的影响较大。因为酶活性对温度较敏感,在适宜温度下酶活性高,有利于提高原生质体产量,温度过高或过低时细胞壁分解较慢,不利于原生质体产量的提高。本试验采用蜗牛酶与纤维素酶的混合酶进行酶解,一般情况下,蜗牛酶的最适温度在30~37 ℃,而纤维素酶的最适温度在35 ℃左右。虽然在35 ℃左右,二者的混合酶能保持较高的活性,但对于蛹虫草细胞而言,温度过高易导致细胞内部代谢紊乱,从而导致再生困难;而在25 ℃左右时原生质体产量及再生率均较高。
2.1.4 菌丝体菌龄 由图4可见,菌丝体菌龄为5 d时,原生质体产量最大,随着菌龄的增大,原生质体产量逐渐降低,原因可能是老化的菌丝细胞壁不易酶解从而导致原生质体产量下降。原生质体的再生率与菌丝体菌龄也有密切关系,菌龄为4 d时,原生质体再生率较低,可能是因为菌丝过于幼嫩,酶解后原生质体不稳定,再生困难;菌龄为5 d时,原生质体再生率基本达到最大值;之后随着菌龄的增大,原生质体再生率呈下降趋势,原因是随着菌龄加大,菌丝细胞壁加厚,次生物质增多,原生质体的产量下降,再生率也随之降低。

图3 酶解温度对秦巴蛹虫草原生质体产量及再生率的影响Fig.3 Effect of enzymolysis temperature on protoplasts yield and regeneration rate of Cordyceps militaris

图4 菌丝体菌龄对秦巴蛹虫草原生质体产量及再生率的影响Fig.4 Effect of spawn age on protoplasts yield and regeneration rate of Cordyceps militaris
2.1.5 稳渗剂种类 稳渗剂种类对蛹虫草原生质体产量及再生率的影响见图5。
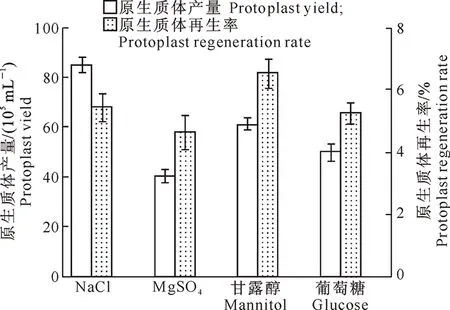
图5 稳渗剂种类对蛹虫草原生质体产量及再生率的影响
由图5可见,0.6 mol/L NaCl作为稳渗剂制备原生质体时产量最高,其次为甘露醇,葡萄糖和MgSO4均较低;0.6 mol/L甘露醇作为稳渗剂制备原生质体时再生率最高,其次是NaCl,葡萄糖和MgSO4均较低。
2.2 蛹虫草原生质体制备及再生条件优化的正交试验结果
根据单因素试验结果可知,酶解温度在25 ℃左右时,原生质体产量及再生率均较高,因此进行正交组合试验时,采用(26±1) ℃进行酶解,并对酶解时间、菌丝体菌龄、稳渗剂种类、裂解酶种类4个因素采用L16(43×3)正交组合设计试验,具体见表1。
秦巴蛹虫草原生质体制备及再生条件优化的正交试验结果见表2。经极差分析发现,对秦巴蛹虫草原生质体的产量而言,4个因素影响的大小顺序为:酶解时间>裂解酶种类>菌丝体菌龄>稳渗剂种类,即酶解时间对原生质体产量的影响最大,其次是裂解酶种类,菌丝体菌龄和稳渗剂种类均较低,各因素的最优水平组合为A3B3C4D3。对秦巴蛹虫草原生质体再生率而言,各因素作用的大小顺序为:酶解时间>菌丝体菌龄>裂解酶种类>稳渗剂种类,各因素的最优水平组合为A2B2C3D3。

表1 蛹虫草原生质体制备及再生条件优化的正交试验因素与水平Table 1 Factors and levels of orthogonal test of protoplasts yield and regeneration rate of Cordyceps militaris

表2 蛹虫草原生质体制备及再生条件优化的正交试验结果Table 2 Orthogonal test results of protoplasts yield and regeneration rate of Cordyceps militaris
注:*表中括号外数据为原生质体产量的系数,括号内数据为原生质体再生率的系数。
Note:The data out of brackets are protoplast yields,and in brackets are protoplast regeneration rates.
经方差(表3和表4)分析发现,酶解时间对秦巴蛹虫草原生质体产量及再生率均有显著影响。

表3 秦巴蛹虫草原生质体制备条件优化正交试验结果的方差分析表Table 3 Variance analysis of orthogonal test of protoplast yield of Cordyceps militaris
注:*:F0.01(3,6)=9.78,F0.05(3,6)=4.76;F0.01(2,6)=10.9,F0.05(2,6)=5.14,*表示影响显著(P<0.05),** 表示影响极显著(P<0.01)。下表同。
Note:F0.01(3,6)=9.78,F0.05(3,6)=4.76;F0.01(2,6)=10.9,F0.05(2,6)=5.14,* Indicates significant level (P<0.05),** Indicates very significant level (P<0.01).The same below.

表4 蛹虫草原生质体再生条件优化正交试验结果的方差分析Table 4 Variance analysis of orthogonal test of protoplast regeneration rate of Cordyceps militaris
综合比较原生质体产量和再生率的分析结果可知,原生质体制备最佳组合的选择要根据试验目的进行,若是为了得到高产原生质体,可采用A3B3C4D3组合;若是为了获得更多的原生质体再生株可采用A2B2C3D3组合。此外,酶解时间以及稳渗剂氯化钠和甘露醇成本的均衡,也应考虑在内。
为获得较多原生质体再生株,本研究选择A2B2C3D3组合多次制备秦巴蛹虫草原生质体并再生。结果表明,在最优(A2B2C3D3)条件下,原生质体再生率平均为25.7%,产量平均为83.42×105mL-1,且大部分再生菌株的菌丝转色快,菌落长势旺盛,明显优于原始菌株。
3 讨 论
原生质体的制备和再生是两个互相联系的过程。通常原生质体化程度较高时,再生率也较高,但细胞壁的过度酶解会导致原生质体损坏或破裂,因此获得高产量原生质体的同时又能得到较多的再生菌株是研究的关键。由于高等真菌的细胞壁成分较复杂,因此混合酶比单一酶更适合原生质体的制备[16-18]。酶解时间的长短很大程度上影响着原生质体的产量及再生率,酶解时间过短细胞壁不能完全裂解,原生质体得不到充分释放;酶解时间过长,原生质体不稳定而影响其再生。酶解温度影响裂解酶的活性,同时也影响原生质体的代谢效率[16,18],适宜的酶解温度有助于裂解酶发挥最佳的裂解作用,同时保证原生质体正常的代谢活动,从而提高细胞壁裂解率。菌丝体的菌龄也很关键,老化的菌丝体细胞壁较厚、次生物质多,酶解相对不易,导致原生质体产量下降;幼嫩的菌丝易被过度酶解,再生率相对较低。

本研究经大量试验发现,大部分秦巴蛹虫草再生菌株的菌丝长势旺、转色快,具有显著的复壮现象,其原因可能与去壁的原生质体吸收了某些外源物质有关[24],其机理有待进一步研究。表明原生质体无性系技术可作为蛹虫草菌种复壮的一种方法。本试验对秦巴蛹虫草原生质体制备及再生最适条件的研究具有重要意义。利用原生质体技术建立秦巴蛹虫草遗传转化系统,是从分子水平进一步了解秦巴蛹虫草遗传背景,利用诱变技术、原生质体融合技术和基因工程进行优良菌株选育的基础工作。
4 结 论
1)酶解温度、酶解时间、菌丝体菌龄、稳渗剂种类及不同酶系是影响秦巴蛹虫草原生质体产量及其再生率的关键因素。
2)秦巴蛹虫草原生质体制备的最优条件为:采用0.6 mol/L NaCl作为稳渗剂,在(26±1) ℃下利用混合酶对菌龄6 d的菌丝酶解3 h;原生质体再生的最佳条件为:采用0.6 mol/L甘露醇作为稳渗剂,在(26±1) ℃下用混合酶对菌龄为5 d的菌丝酶解2 h。
[1] 王海英,华秀英,钮旭光,等.原生质体技术在食用菌育种上的应用 [J].沈阳农业大学学报,2000,31(3):300-303.
Wang H Y,Hua X Y,Niu X G,et al.Application of protoplast technology in the breeding of edible mushroom [J].Journal of Shenyang Agricultural University,2000,31(3):300-303.(in Chinese)
[2] 路等学,李成一,段晓红,等.侧耳与香菇原生质体无性再生株性状研究 [J].食用菌学报,1997,4(3):1-6.
Lu D X,Li C Y,Duan X H,et al.Studies on characters of asexual regenerative strains from protoplasts ofPleurotusandLentinulaedodes[J].Acta Edulis Fungi,1997,4(3):1-6.(in Chinese)
[3] 何培新,罗信昌,郝保军,等.光木耳原生质体无性系繁殖的研究 [J].河南职业技术师范学院学报,1998,26(4):45-48.
He P X,Luo X C,Hao B J,et al.Studies on protoplastation ofAuriculariaauricular[J].Journal of Henan Vocation-Technical Teachers College,1998,26(4):45-48.(in Chinese)
[4] 邢 蕾.平菇原生质体再生及无性变异株的初筛 [D].河北保定:河北农业大学,2008.
Xing L.Selection ofPleurotusostreatusasexual regenerative strains by protoplast regeneration [D].Baoding,Hebei:Agricultural University of Hebei,2008.(in Chinese)
[5] 路等学,李成一,卢洪英,等.食用真菌原生质体无性繁殖株产菇优势及出菇性状研究 [J].甘肃科学学报,1994(2):68-72.
Lu D X,Li C Y,Lu H Y,et al.Studies on yield superiority and fruiting characters of asexual regenerative strains from protoplasts of edible fungi [J].Journal of Gansu Sciences,1994(2):68-72.(in Chinese)
[6] 潘迎捷,陈明杰,汪昭月,等.单核和同核原生质体技术在食用菌遗传育种上的应用 [J].食用菌学报,1994,1(2):56-62.
Pan Y J,Chen M J,Wang Z Y,et al.Application of monokaryon and homokaryon protoplast technology in genetic and breeding of edible mushroom [J].Acta Edulis Fungi,1994,1(2):56-62.(in Chinese)
[7] 潘迎捷,廖汉泉,张树庭,等.异宗结合食用菌的原生质体单核化 [J].上海农业学报,1993,9(2):1-5.
Pan Y J,Liao H Q,Zhang S T,et al.A study on monokaryotization by protoplasting of heterokaryotic mushrooms [J].Acta Agriculturae Shanghai,1993,9(2):1-5.(in Chinese)
[8] 杨宗渠,王柏楠,董志浩.食用菌诱变育种研究进展 [J].中国食用菌,1997,17(2):6-8.
Yang Z Q,Wang B N,Dong Z H.Research progress of mutation breeding of edible fungi [J].Edible Fungi of China,1997,17(2):6-8.(in Chinese)
[9] 孙 露.木耳属遗传多样性及原生质体育种的研究 [D].长春:吉林农业大学,2012.
Sun L.Studies on the genetic diversity and protoplast breeding ofAuricularia[D].Changchun:Jilin Agricultural University,2012.(in Chinese)
[10] 刘玉霞.侧耳属真菌原生质体技术选育高产菌株研究 [D].河北保定:河北大学,2006.
Liu Y X.Studies on selection of high-yieldingPleurotusstrains by protoplast technology [D].Baoding,Hebei:Hebei University,2006.(in Chinese)
[11] 闫培生,李桂舫,蒋家惠,等.大球盖菇原生质体再生及单核化特性的研究 [J].菌物系统,2001,20(1):107-110.
Yan P S,Li G F,Jiang J H,et al.Regeneration and monokaryotation of protoplasts ofStrophariarugoso-annulata[J].Mycosystema,2001,20(1):107-110.(in Chinese)
[12] 高怀安,陈世中,王丽荣,等.秦巴蛹虫草与冬虫夏草某些化学成分的对比研究 [J].中药通报,1987,12(2):44-45.
Gao H A,Chen S Z,Wang L R,et al.Comparative study on some chemical composition in QinbaCordycepsmilitarisandCordycepssinensis[J].Bulletin of Chinese Material Medica,1987,12(2):44-45.(in Chinese)
[13] 薛三勋,王晓文,钟勇玉,等.秦巴虫草的人工培养研究 [J].西北农业学报,2001,10(3):93-95.
Xue S X,Wang X W,Zhong Y Y,et al.Studies on artificial culture of Qinba Aweto [J].Acta Agriculturae Boreali-occidentalis Sinica,2001,10(3):93-95.(in Chinese)
[14] 马 芳,赵德化,盛宝恒.秦巴蛹虫草的药理实验研究 [J].西北药学杂志,1987,2(2):6-9.
Ma F,Zhao D H,Sheng B H.Pharmacological study of QinbaCordycepsmilitaris[J].Northwest Pharmaceutical Journal,1987,2(2):6-9.(in Chinese)
[15] 张银萍,张 舒,汪 洋,等.灵芝原生质体的高效制备及诱变 [J].安徽农业科学,2012,40(25):12379-12381.
Zhang Y P,Zhang S,Wang Y,et al.High preparation and mutagenesis of protoplast ofGanodermalucidum[J].Journal of Anhui Agricultural Sciences,2012,40(25):12379-12381.(in Chinese)
[16] 陈宏伟,陈安徽,王 陶,等.蛹虫草无性型原生质体制备条件的研究 [J].徐州工程学院学报,2008,23(4):23-26.
Chen H W,Chen A H,Wang T,et al.Preparation conditions of protoplast of anamorphic strains ofCordycepsmilitaris[J].Journal of Xuzhou Institute of Technology,2008,23(4):23-26.(in Chinese)
[17] 马丽苹,赵君锋,刘开永,等.蛹虫草原生质体分离条件研究 [J].安徽农业科学,2008,36(33):14612-14613,14616.
Ma L P,Zhao J F,Liu K Y,et al.Research on the isolation condition ofCordycepsmilitarisprotoplast [J].Journal of Anhui Agricultural Sciences,2008,36(33):14612-14613,14616.(in Chinese)
[18] 刘小莉,周剑忠,黄开红.蛹虫草原生质体的制备和再生研究 [J].江西农业学报,2009,21(9):119-120.
Liu X L,Zhou J Z,Huang K H.Study on preparation and regeneration of protoplast ofCordycepsmilitaris[J].Acta Agriculturae Jiangxi,2009,21(9):119-120.(in Chinese)
[19] 周礼红,罗丽美.蛹虫草原生质体的制备与再生 [J].湖北农业科学,2009,48(7):1621-1624.
Zhou L H,Luo L M.Preparation and regeneration of protoplasts fromCordycepsmilitaris[J].Hubei Agricultural Sciences,2009,48(7):1621-1624.(in Chinese)[20] Mendoza C G.Cell wall structure and protoplast reversion in basidiomycetes [J].World Journal of Microbiology and Biotechnology,1992,8:36-38.
[21] 谭文辉,李燕萍,许 杨.微生物原生质体制备及再生的影响因素 [J].现代食品科技,2006,22(3):263-265.
Tan W H,Li Y P,Xu Y.Factors affect the formation and regeneration of protoplasts of microorganism [J].Modern Food Science and Technology,2006,22(3):263-265.(in Chinese)
[22] 朱蕴兰,周卫东,陈安徽,等.冬虫夏草无性型原生质体再生条件研究 [J].安徽农业科学,2009,37(30):14629-14631.
Zhu Y L,Zhou W D,Chen A H,et al.Study on protoplast regeneration conditions of anamorphic strains ofCordycepssinensis[J].Journal of Anhui Agricultural Sciences,2009,37(30):14629-14631.(in Chinese)
[23] 柳 俊,谢从华.植物细胞工程 [M].2版.北京:高等教育出版社,2004:158-167.
Liu J,Xie C H.Plant cell engineering [M].2nd edition.Beijing:Higher Education Press,2004:158-167.(in Chinese)
[24] 朱宏发,吴京燕,何强泰.原生质体复壮平菇菌种初探 [J].食用菌,2006(3):20.
Zhu H F,Wu J Y,He Q T.Protoplasts ofPleurotusostreatuson rejuvenation [J].Edible Fungi,2006(3):20.(in Chinese)
Study on isolation and regeneration of QinbaCordycepsmilitarisprotoplast
MA Yue-teng,DU Shuang-tian,DING Jian,JI Xiao-peng,BAO Rui,LI Zhen
(CollegeofLifeScience,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The purpose of this paper was to study the optimal conditions for isolation and regeneration of QinbaCordycepsmilitaris(C.militaris) protoplasts,and to establish efficient methods for protoplast-regenerated strains.【Method】 Taking CM-16 strains from anamorph of QinbaC.militarisas test material,type of lyase,mycelia age,osmotic pressure stabilizer,enzymolysis time and temperature were studied on isolation and regeneration of protoplasts,and based on the results,the single factor conditions were optimized through orthogonal test.【Result】 (1) Using 0.6 mol/L NaCl,mixed enzymes(1% (wt) cellulase and 0.5% (wt) snailase was mixed by 1∶1 volume ratio),6 d age of mycelia,(26±1) ℃,and 3 h,the protoplasts yield was the highest.(2) Using 0.6 mol/L mannitol,mixed enzymes(1% (wt) cellulase and 0.5% (wt) snailase was mixed by 1∶1 volume ratio),5 d age of mycelia,(26±1) ℃,and 2 h,the protoplasts regeneration rate was the highest.The verification test results showed that the average rate of regenerated protoplasts was 25.7% and the average yield of protoplasts was 83.42×105mL-1.【Conclusion】 The optimization of enzymolysis temperature and time,mycelia age,osmotic pressure stabilizer and enzyme type was essential to increase the protoplasts yield and regeneration rate of QinbaC.militaris.
QinbaCordycepsmilitaris;protoplasts;protoplast isolation;protoplast regeneration
时间:2015-08-05 08:57
10.13207/j.cnki.jnwafu.2015.09.028
2014-02-21
陕西省科技统筹创新工程计划项目(2011KTCL02-16)
马跃腾(1988-),女,宁夏银川人,在读硕士,主要从事微生物资源与利用研究。E-mail:24984313@qq.com
杜双田(1961-),男,陕西扶风人,副教授,主要从事食用与药用真菌研究。E-mail:dst6107@126.com
Q935;S567.3
A
1671-9387(2015)09-0196-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150805.0857.056.html

