C18 硅胶制备荔枝果皮原花青素低聚体的组成分析及单体分离
李书艺,吴 茜,隋 勇,孙智达*
1武汉轻工大学食品科学与工程学院,武汉 430023;2华中农业大学食品科学技术学院 环境食品学教育部重点实验室,武汉 430070
荔枝(Litchi chinensis Sonn.),为无患子科常绿乔木,也是我国南方重要的水果农作物。研究表明,除了味美可口的果肉,荔枝的花、果皮和果核均具有抗氧化活性[1-3];特别是荔枝果皮,其色泽鲜艳,占果实鲜重15%,产量颇为丰富。课题组前期研究发现[4,5],荔枝果皮经过醇提、浓缩、AB-8 大孔树脂富集和乙酸乙酯萃取后可得到纯度较高的原花青素低聚 体 (Litchi pericarp oligomeric procyanidins,LPOPC)。LPOPC 中同时含有A-和B-型原花青素,延伸单元和末端单元为表儿茶素,通过4→8,2→O→7 或4→6,4→8 连接而成,以A-型原花青素低聚体为主[2]。然而,当利用上述纯化方法结合Toyopearl 柱层析分级制备典型的A-型原花青素二聚体{表儿茶素-(4β→8,2β→O→7)-表儿茶素}和三聚体{表儿茶素-(4β→8,2β→O→7)-表儿茶素-(4β→8)-表儿茶素}时,周期较长,费时费力。且提取物中含有的少量B-型原花青素与同等聚合度的A-型原花青素相比,仅单元连接键之间少了一个C-O-C键,分子量差距为2,难以通过凝胶色谱分离。为此,本文将对原有的纯化方法进行优化改进:用C18硅胶柱材料替代原来的AB-8 大孔树脂纯化,甲醇洗脱取代乙醇洗脱分离,其他步骤仍保持不变。这样,既可使A-和B-型原花青素达到完全分离的目的,又可快速制备纯度更高、聚合度更低的A-型原花青素低聚体。在此基础上,通过等辐射分析法(即Isobologram 法)评价了所得A-型原花青素二聚体和三聚体的协同抗氧化能力,对探究原花青素的结构与抗氧化活性之间的构效关系具有特殊意义。
1 材料与方法
1.1 实验材料
荔枝品种为妃子笑(Litchi chinensis Sonn.cv.Feizixiao),2012年6 月采自广州。选取色泽鲜艳,果形匀称,未受机械损伤的果实,取其皮于-20℃下保存。
1.2 主要试剂与仪器
试剂:(-)-表儿茶素、(+)-儿茶素、DPPH(美国Sigma 公司);福林酚试剂(美国Sigma 公司分装);甲醇,乙腈(色谱纯,美国Fisher 公司);High Techsil-C18 硅胶填料(苏州汇通色谱分离纯化有限公司分装);Toyopearl HW-40s 凝胶填料(日本Tosoh 公司);其他化学试剂(分析纯,国药集团化学试剂有限公司)。仪器:UV-2100 型紫外可见分光光度计(上海尤尼柯仪器有限公司);LC-MSn1100 series 液质联用仪(美国Agilent 公司)。
1.3 实验方法
1.3.1 荔枝果皮原花青素粗提物的制备
称取100±0.5 g 粉碎后的荔枝果皮,在70%的乙醇溶液中(料液比1∶15,W/V)50 ℃水浴避光浸提90 min。提取结束后抽滤除去壳渣,滤液于旋转蒸发仪内40 ℃减压回收乙醇,残留的水溶液为荔枝果皮原花青素的粗提物。
1.3.2 荔枝果皮原花青素的纯化
将上述粗提液100 mL 用滴管缓慢加入C18 硅胶层析柱(3 ×2.5 cm,5 μm)中,给予泵压力,控制洗脱液流速约50 mL/min。待吸附完全后,采用5倍柱体积的蒸馏水和等体积的90%甲醇分步洗脱处理,前者以去可溶性糖和其它小分子化合物,后者通过下接锥形瓶予以收集。然后,40 ℃减压旋蒸除去收集液中的甲醇,余下水溶液用3 倍体积乙酸乙酯萃取。再合并有机相,旋蒸除去有机溶剂,残留液复溶于蒸馏水后冷冻干燥即为优化制备的荔枝果皮原花青素低聚体(以下简称LPOPC)。
1.3.3 LPOPC 总酚含量的测定
1.3.3.1 标准曲线绘制
采用Folin-Ciocalteu 法测定上述LPOPC 中的总酚含量[6]。以没食子酸溶液为标准品绘制标准曲线:分别取浓度为0、0.05、0.1、0.125、0.25、0.5 mg/mL 的标准溶液0.1 mL 加至6 mL 蒸馏水中,混合后加入1 mL 福林酚试剂,均匀混合30 s 后静置8 min,然后加入1.5 mL 20%碳酸钠溶液,定容至10 mL。室温下避光放置2 h 后,765 nm 下比色。以标准溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得回归方程为Y=0.0013X +0.0189,R2=0.9909。
1.3.3.2 样品测定
配制0.3 mg/mL 样品溶液,按标曲制作步骤进行操作,根据标曲回归方程计算出样品中的总酚含量(mg/g),平行操作三次,取平均值。
1.3.4 LPOPC 的低聚体组成成分分析
取一定量冻干样品溶于甲醇配成0.5 mg/mL溶液,经0.22 μm 滤膜过滤后进行组分分析。使用Agilent 1100 Series LC/MSD Trap 液质联用仪,配有二元梯度泵,二极管阵列(DAD)检测器,柱温箱和自动进样器。
色谱条件:色谱柱为VP-ODS C18柱(150 mm ×4.6 mm,5 μm);柱温28 ℃;流动相:A 为0.4%的醋酸水溶液,B 为乙腈;洗脱梯度:0~40 min,5%~35% B;40~45 min,35%~50% B;45~50 min,50%~80% B;50~55 min,80%~5% B,然后柱平衡10 min;流速1 mL/min;检测波长280 nm;进样量20 μL。
质谱条件:离子源,电喷雾(ESI);压力,30 psi;干燥气,N2;载气温度,325 ℃;载气流速,12 mL/min;监测模式,MRM,负离子模式;离子扫描范围,100~1200 m/z;关注分子量,500 m/z;同步进行二级破碎。
1.3.5 LPOPC 平均聚合度的计算
根据LPOPC 中主要低聚体的聚合度和其相对含量,可推算出LPOPC 的近似平均聚合度,公式如下:
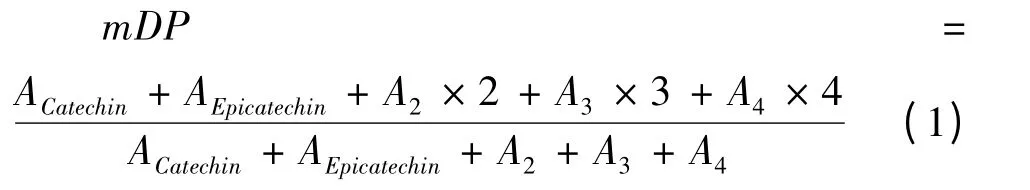
式中:ACatechin为儿茶素的百分含量(%);AEpicatechin为表儿茶素的百分含量(%);A2为原花青素二聚体的百分含量(%);A3为原花青素三聚体的百分含量(%);A4为原花青素四聚体的百分含量(%)。
1.3.6 A-型原花青素二聚体和三聚体的制备
采用Toyopearl HW-40s 凝胶柱(200 mm ×16 mm,30 μm,适用分子量范围100~1000),对C18 纯化工艺所得的LPOPC 进行了分级。将100 mg LPOPC 溶于3 mL 甲醇中,上样前先经0.22 μm 微孔滤膜过滤。洗脱液为甲醇,流速为0.8 mL/min,上样后每6 min 收集一管。洗脱液经紫外检测仪280 nm 处比色后将吸光度值记录在对应的仪器上。合并相同出峰位置的试管,减压除去甲醇,冷冻干燥,得到不同聚合度的黄烷醇组分[7]。对各组分进行质谱解析确定其种类后(方法同1.3.4),可通过归一化法计算目标化合物的纯度。
1.3.7 Isobologram 法分析A-型原花青素二聚体、三聚体的相互作用
1.3.7.1 二聚体、三聚体清除DPPH 自由基的能力
DPPH·是一种稳定的大分子自由基,在乙醇中呈紫色。当抗氧化剂与DPPH·反应时,紫色逐渐消失,通过测定吸光值可计算清除率。清除率反映了抗氧化剂对DPPH·的清除能力,通常表示为半数抑制率浓度IC50,即清除率为50%时抗氧化剂的浓度。IC50值越小,提取物清除自由基的能力越强[8]。
准确配制1 mg/mL 上述A-型原花青素二聚体和三聚体水溶液,将母液分别稀释10 倍和100 倍得到100 μg/mL 和10 μg/mL 样品溶液。再取不同体积样液定容至2 mL,加入DPPH 乙醇溶液后,混匀,在室温下避光反应30 min,于515 nm 处比色。空白组以等体积无水乙醇代替DPPH·,对照组以等体积蒸馏水代替样品,平行测定3 次,计算公式如下:
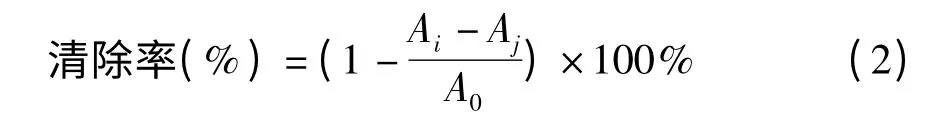
式中:A0为对照组吸光值;Ai为样品组吸光值;Aj为空白组吸光值。
1.3.7.2 二聚体、三聚体复配物清除DPPH 自由基的能力
选择3 组浓度,即将A-型原花青素二聚体和三聚体的浓度比固定为1∶4、1∶1.5、1∶0.5,且每组确定固定比例浓度设计使各自计算出的清除率在10%~100%范围内均匀分布。化合物按固定比例混合后,以1.3.7.1 的方法测定复合抗氧化剂对DPPH·的清除作用,计算复配组的IC50值。
1.3.7.3 构建二聚体、三聚体复配后的Isobologram分析图
等辐射分析法(Isobologram)常用于研究药物相互作用,选取两种能产生类似效应的药物,用等辐射图分析之间的相互作用[9]。将DPPH·清除实验中得到的二聚体IC50值和95%可信限标绘在横轴上,三聚体的IC50值和95%可信限标绘在纵轴上,连接横纵轴两IC50值构成相加线,连接两可信限构成相加线95%可信限。如果复配组的效应点落在相加线上或可信限内,则表示两种抗氧化剂的相互作用为相加,如果落在相加线及可信限下方则表示相互作用为协同作用,如果落在相加线及可信限上方则表示相互作用为拮抗作用[10]。
2 结果与讨论
2.1 荔枝果皮原花青素低聚体LPOPC 的组成分析
Folin-Ciocalteu 法测定的结果显示,C18 硅胶替代AB-8 大孔树脂纯化荔枝果皮原花青素提取物后,所制得的LPOPC 中总酚含量显著提升,达到940±123 mg/g[4]。表明此法确实可以达到优化提取的效果,故通过HPLC 和LC-MS 联合对LPOPC 的组成成分进行了进一步的验证和分析。
图1 为LPOPC 在波长280 nm 处的液相色谱图,从图中不难看出,提取物主要由12 个不同极性的组分构成。表1 中罗列了几种A-和B-型原花青素低聚体的典型结构碎片信息,可作为对LPOPC 中各组分结构解析的依据。如表1 所示,(+)-儿茶素和(-)-表儿茶素的分子离子[M-H]-为289 m/z,结合标准品的保留时间信息,分别对应为图1 中的峰1、峰2。B-型原花青素二聚体,分子离子[M-H]-为577 m/z,对应二级碎片451、425、407 和289 m/z,通过杂环裂解脱去间苯三酚(heterocyclic ring fission,HRF)、逆狄尔斯-阿德耳(retro-Diels-Alder,RDA)或同时脱水、醌甲基裂解(quinone methide,QM)类黄酮连接键等反应产生[11],故可同时存在多种同分异构体。而A-型原花青素二聚体与B-型原花青素二聚体相比,因连接单元之间增加了一个C-O-C 醚键,分子量少2,故[M-H]-为575 m/z[12];相应的,当发生以上相同的裂解反应时,分别产生质荷比449、423、289 和285 m/z 的二级碎片[13,14]。A-和B-型三聚体的碎片断裂方式同二聚体类似,不同的是A-型原花青素三聚体的裂解通常发生在没有C-O-C 酯键连接的两个单元之间,m/z 711 和693 为其RDA碎片,m/z 573 和289 为QM 裂解产生。基于以上结构特征,结合LC-MS 分析的结果可知,LPOPC 的每个组分中同时包含了一种或多种黄烷醇化合物(表2)。其中,共鉴定出9 种A-型二聚体、4 种A-型三聚体和2 种B-型二聚体(表2)。
以色谱图中该组分的峰面积表示其所占的比例,以对应质谱图中各物质的相对丰度表示该物质在该组分中的相对含量,可以对LPOPC 中各黄烷醇类物质的种类和分布进行初步表征(表2)。经过比对和计算发现,C18 硅胶制备的LPOPC 中黄烷醇类物质的含量高达93.12%,其中A-型原花青素约占41.98%,而B-型仅占2.31%,主要由A-型二聚体、三聚体和B-型二聚体组成。(-)-表儿茶素、A-型二聚体和三聚体的相对含量分别为44.86%、36.02%和9.86%。与AB-8 纯化法相比较,前者纯化产物中(-)-表儿茶素含量远高于后者,提取物中B-型原花青素的含量显著降低。这是因为C18 柱材料为疏水性最强的硅胶基体吸附剂,对非极性的化合物具有极好的强保留效果[15]。A-型原花青素相对于B-型而言极性更弱,与C18 表面会结合得更为紧密,故洗脱时较晚被分离。加上实验操作中吸附洗脱的过程应用的是反相色谱分离的原理,只要控制好实验条件,就可以达到除去B-型,富集A-型原花青素的目的。同时,根据公式(1),可计算得到LPOPC 中原花青素的近似平均聚合度仅为1.62。由此证明,使用C18 纯化工艺虽然增加了实验操作的价格成本,但在科学研究中,可以用来快速地制备聚合度更低、组分更简单的A-型原花青素低聚体,同时也可近乎完全地避免B-型化合物对分级制备带来的不利影响。
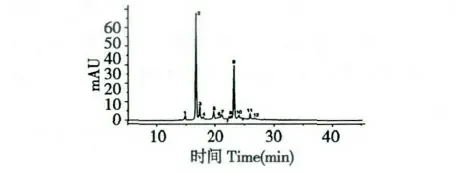
图1 荔枝果皮原花青素低聚体LPOPC 的RP-HPLC 图Fig.1 RP-HPLC chromatogram of litchi pericarp oligomeric procyanidins (LPOPC)
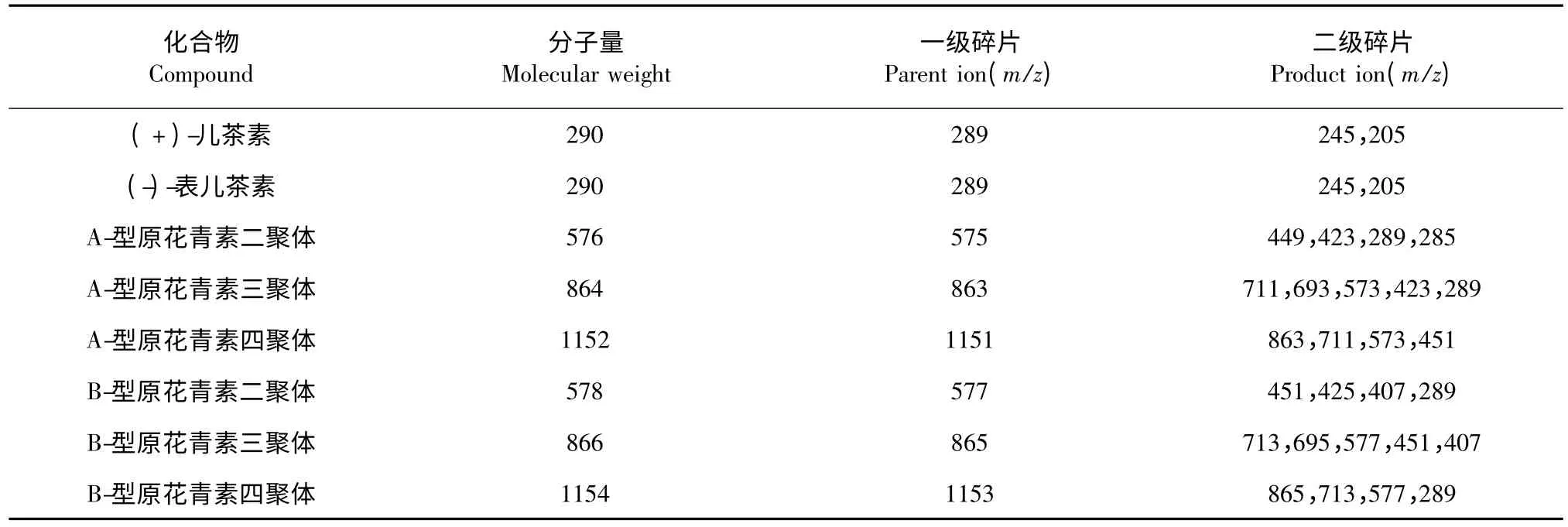
表1 A-和B-型原花青素低聚体的典型结构碎片Table 1 Typical structure fragments of A-and B-type procyanidin oligomers

表2 LPOPC 的组成成分分析(LC-MS 法)Table 2 Composition of LPOPC by LC-MS analysis
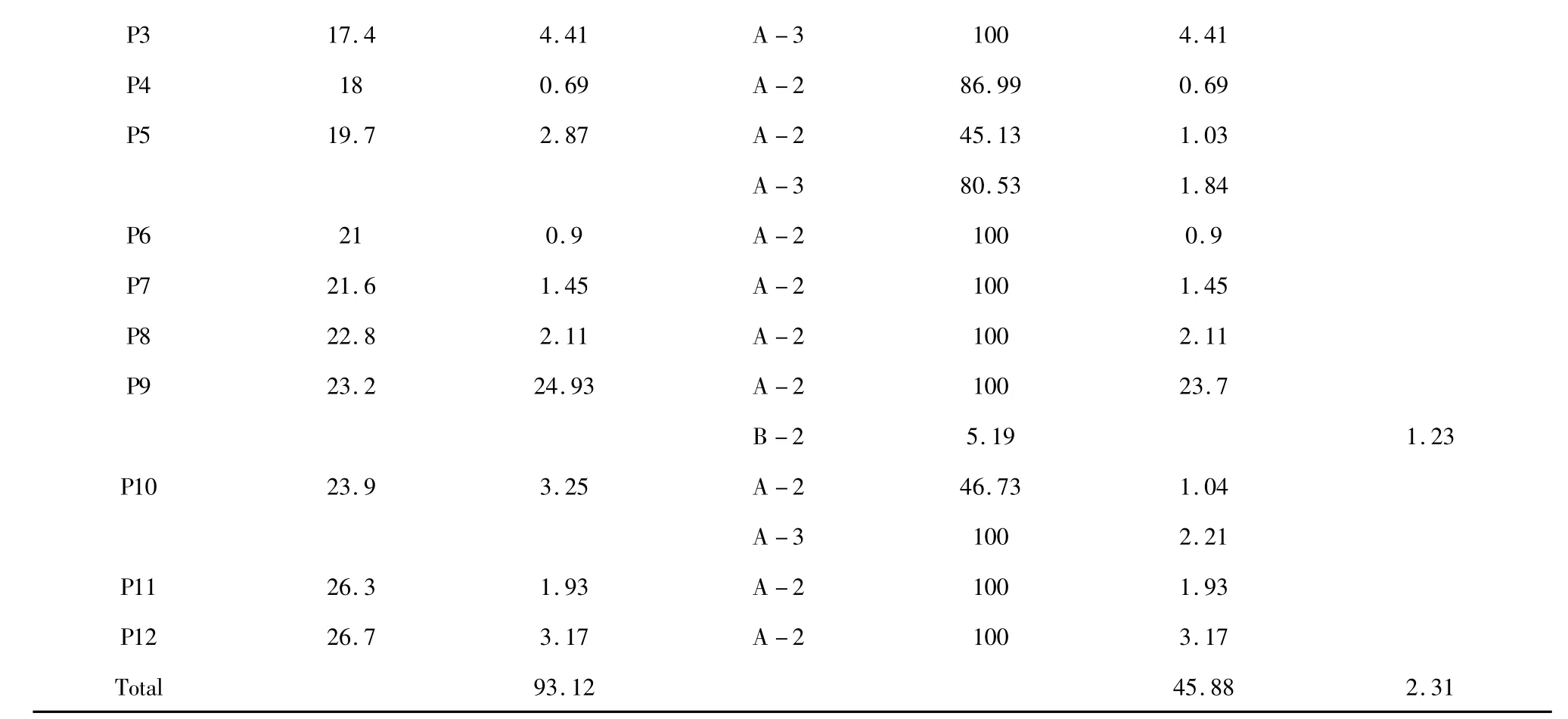
注:“Cat”为(+)-儿茶素,“Epi”为(-)-表儿茶素,“A-2”、“A-3”和“B-2”分别表示A-型原花青素二聚体、三聚体和B-型原花青素二聚体。Note:“Cat”and“Epi”were the abbreviations of (+)-catechin and (-)-epicatechin;“A-2”,”A-3”and“B-2”represented A-type procyanidin dimer,A-type procyanidin trimer and B-type procyanidin dimer,respectively.
2.2 荔枝果皮中A-型原花青素二聚体和三聚体的制备
利用C18 纯化的LPOPC 制备A-型原花青素二聚体和三聚体。经过凝胶色谱分级后,LPOPC 混合物被分成了7 个组分,如图2 所示。样品收集从出峰处开始,合并后进行HPLC 和LC-MS 分析。通过与原样的比对,确定后出峰的5 个组分,即图中标注的F3~F7 为LPOPC 中的主要黄烷醇类物质。经质谱鉴定和色谱归一化分析(色谱图均未显示):F3 为(-)-表儿茶素,纯度90%;F4 为(+)-儿茶素,纯度92%;F6 为原花青素A2,表儿茶素-(4β→8,2β→O→7)-表儿茶素,纯度93%;F7 为原花青素A-型三聚体,表儿茶素-(4β→8,2β→O→7)-表儿茶素-(4β→8)-表儿茶素,纯度85%。F5 为一种未知的A-型原花青素二聚体,纯度82%。由于在本实验条件下无法得到足够量高纯度的该化合物,故没有对它们进行进一步的结构鉴定。多次重复上样和富集后,回收有机溶剂甲醇,可得到足量的上述已知结构的A-型原花青素二聚体和三聚体化合物,以进行后续实验和分析。
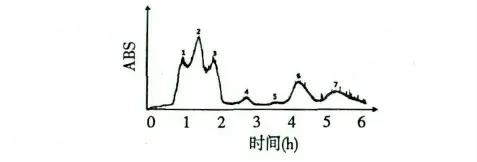
图2 LPOPC 经Toyopearl HW-40 s 的分级洗脱图谱Fig.2 Elution profile of LPOPC applied to Toyopearl HW-40 s column
2.3 A-型原花青素二聚体和三聚体的抗氧化相互作用
根据公式(2)可计算A-型原花青素二聚体和三聚体对DPPH 自由基的清除率。数据显示,以上二者均具有较强的DPPH·清除能力,且在一定范围内,随着浓度的增加,清除率逐渐上升,最大时分别达到87.7%和86.7%,半数抑制率浓度IC50值依次为9.34 和12.04 μg/mL。以A-型二聚体和三聚体清除自由基的IC50值为依据,将两者按几组固定比例混合进行复配实验,包括两种抗氧化剂效强含量相当及两种抗氧化剂分别占主导地位的情况,即选择3 组固定浓度比,分别使其抗氧化效应能力表现为1∶3、1∶1、3∶1,以确定新的量效曲线和IC50值,从而进行统计学分析。由于二聚体和三聚体的IC50比值为1∶1.4,因此近似选定二聚体和三聚体的复配浓度比为1∶4、1∶1.5 和1∶0.5。再将三种固定浓度比例各设计6 组浓度梯度,分别测定不同比例的复配物对DPPH·的清除率,计算相应的IC50值,结果如表3 所示。
在表3 中,每组浓度梯度的复配物对DPPH·的清除率均匀地分布在10%~100%以内。二聚体和三聚体以1∶4、1∶1.5 和1∶0.5 复配后的IC50,mix值分别为10.15、11.01 和10.19 μg/mL,数据结果符合分析要求,故可利用Isobologram 分析法确定二者之间的相互作用类型。根据1.3.7.3 中描述的方法构建Isobologram 分析图(图3),横纵坐标分别表示三聚体和三聚体的反应浓度。当二聚体与三聚体的浓度比为1∶4 时,IC50,A-2值为2.03 μg/mL,IC50,A-3为8.12 μg/mL;浓度比为1∶1.5 时,IC50,A-2值为4.36 μg/mL,IC50,A-3为6.65 μg/mL;浓度比为1∶0.5 时,IC50,A-2值为6.55 μg/mL,IC50,A-3为3.34 μg/mL(表3)。不难看出,三个效应点均落在相加线和95%可信限下方,表明A-型原花青素二聚体和三聚体复配后具有显著的协同抗氧化作用。
研究A-型原花青素二聚体和三聚体的协同抗氧化作用,一方面可以证明抗氧化活性与酚类化合物的羟基数目之间的关系:即羟基数量越多,抗氧化能力越强;另一方面,可以协助我们了解荔枝果皮A-型原花青素混合物是如何发挥抗氧化作用的。实验结果证明,三聚体的抗氧化活性虽仅略高于二聚体,但二聚体和三聚体之间却存在着显著的协同抗氧化关系,提示LPOPC 的高活性极有可能来源于不同聚合度原花青素的相互作用[16,17]。同时,我们还可能利用这种协同效应重组得到一种抗氧化活性远高于原提取物的复配物。在此,Isobologram 分析法为新型复合抗氧化剂的开发提供了重要参考依据[18]。
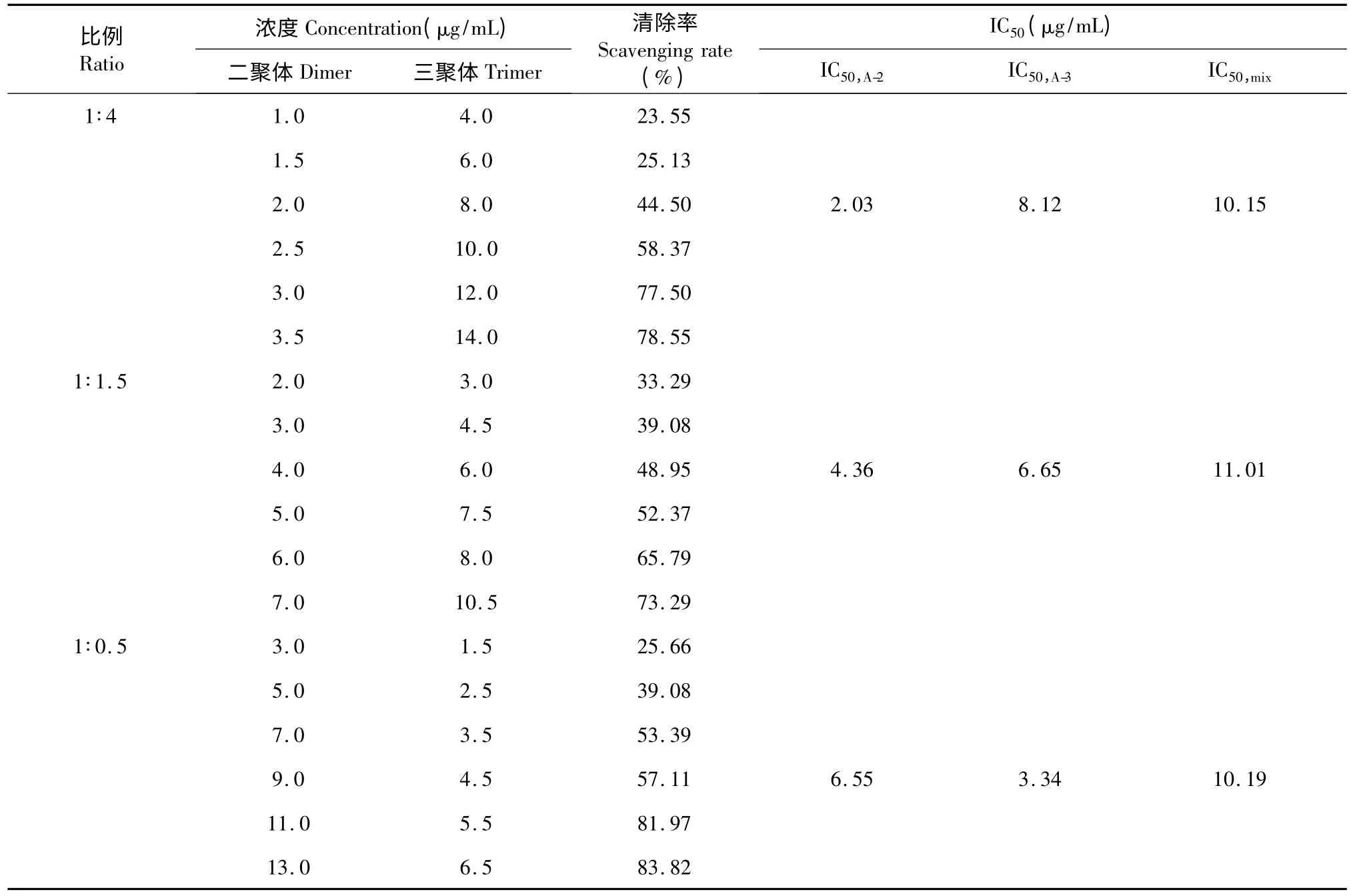
表3 A-型原花青素二聚体和三聚体复配后清除DPPH·的能力Table 3 DPPH radical scavenging activities of A-type procyanidin dimer and trimer mixture
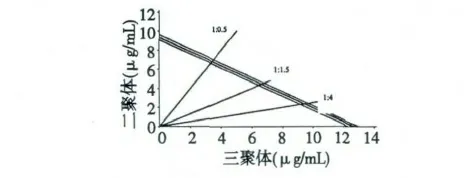
图3 二聚体和三聚体复配的Isobologram 分析图Fig.3 Isobologram analysis graph of interaction with procyanidin dimer and trimer
3 结论
本文在传统AB-8 分离纯化荔枝原花青素的基础上,通过C18 硅胶柱层析优化制备了聚合度更低、A-型原花青素纯度更高的荔枝果皮原花青素低聚体(LPOPC)。组分分析结果显示,C18 硅胶制备的LPOPC 中总酚含量达到940±123 mg/g,且B-型原花青素近乎完全地被分离。其中,(-)-表儿茶素、A-型原花青素二聚体和三聚体为提取物中最主要的单体和低聚体,相对含量分别为44.86%、36.02%和9.86%;提取物平均聚合度为1.62。因此,可高效利用C18 制备的LPOPC 通过凝胶色谱分级获得已知结构的A-型原花青素二聚体和三聚体。抗氧化评价结果显示,A-型原花青素二聚体和三聚体均具有较强的自由基清除能力;等辐射分析法证明两者之间呈现一定的协同抗氧化效应,为新型复合抗氧化剂的开发提供了新的研究思路。
1 Liu SC,Lin JT,Wang CK,et al.Antioxidant properties of various solvent extracts from lychee (Litchi chinenesis Sonn.)flowers.Food Chem,2009,114:577-581.
2 Liu L,Xie BJ,Cao SQ,et al.A-type procyanidins from Litchi chinensis pericarp with antioxidant activity.Food Chem,2007,105:1446-1451.
3 Nagendra Prasad K,Yang B,Yang S,et al.Identification of phenolic compounds and appraisal of antioxidant and antityrosinase activities from litchi (Litchi sinensis Sonn.)seeds.Food Chem,2009,116:1-7.
4 Zhou WJ (周玮婧).Extraction,purification and antioxidation of procyanidins from Litchi chinensis pericarp.Wuhan:Huazhong Agricultural University (华中农业大学),MSc.2010.
5 Li SY,Xiao J,Chen L,et al.Identification of A-series oligomeric procyanidins from pericarp of Litchi chinensis by FTICR-MS and LC-MS.Food Chem,2012,135:31-38.
6 Scallbert A.Quantitative Methods for the Estimation of Tannins in Plant Tissues.In R.W.Hemingway,Laks,P.E.(Ed.),Plant Polyphenols:Synthesis,Properties,Significance.New York:Plenum Press,1992.Vol.59,259-280.
7 Zhou WJ (周玮婧),Sui Y (隋勇),Sun ZD (孙智达),et al.Qualitative analysis of oligomeric procyanidins from Litchi chinensis pericarp.Food Sci (食品科学),2012,33(17):40-43.
8 Ningappa MB,Dinesha R,Srinivas L,et al.Antioxidant and free radical scavenging activities of polyphenol-enriched curry leaf (Murraya koenigii L.)extracts.Food Chem,2008,106:720-728.
9 Zhang L (张凌),Zhang MZ (张马忠),Hang YN (杭燕南).Drug interaction analysis with isobolograms.Int J Anest Res (国际麻醉学与复苏杂志),2007,28:472-476.
10 Xiao LB (肖黎波).Study of hypnotic interactions and bispectral index between propofol and midazolam.Hunan:Zhongnan University (中南大学),MSc.2007.
11 Karonen M,Loponen J,Ossipov V,et al.Analysis of procyanidins in pine bark with reversed-phase and normal-phase high-performance liquid chromatography-electrospray ionization mass spectrometry.Anal Chim Acta,2004,522:105-112.
12 Vivas N,Glories Y,Pianet I,et al.A complete structural and conformational investigation of procyanidin A2 dimer.Tetrahedron Lett,1996,37:2015-2018.
13 Friedrich W,Eberhardt A,Galensa R.Investigation of proanthocyanidins by HPLC with electrospray ionization mass spectrometry.Eur Food Res Tech,2000,211:56-64.
14 Shui G,Leong LP.Analysis of polyphenolic antioxidants in star fruit using liquid chromatography and mass spectrometry.J Chromatogr A,2004,1022:67-75.
15 Sander LC,Wise SA.A new standard reference material for column evaluation in reversed-phase liquid chromatography.J Sep Sci,2003,26:283-294.
16 Li SY (李书艺),Zhou WJ (周玮婧),Sun ZD (孙智达),et al.Antioxidant activity and DNA damage preventing effect of procyanidins from Litchi chinensis pericarp.Food Sci (食品科学),2010,31:14-18.
17 Zhou WJ (周玮婧),Si GH (佀国涵),Sun ZD (孙智达),et al.Antimicrobial activity and mechanism of flavonoids from Litchi pericarp.Nat Prod Res Dev (天然产物研究与开发),2011,23:332-336.
18 Romano CS,Abadi K,Repetto V,et al.Synergistic antioxidant and antibacterial activity of rosemary plus butylated derivatives.Food Chem,2009,115:456-461.

