响应面法优化金银花多糖羧甲基化工艺及抗氧化性研究
赵 鹏,张婷婷
陕西中医学院药学院,咸阳 712046
金银花(Lonicera japonica)是忍冬科植物忍冬的干燥花蕊,其主要分布于我国的山东、河北、陕西等省。金银花是我国传统的药食同源植物,主要具有清热解毒、凉散风热、抗病毒等功效,在临床上可用于治疗丹毒、喉痹、热毒血痢、风热感冒等疾病[1,2]。研究表明,金银花多糖是金银花中的主要活性成分之一,具有较好的抗氧化、抗菌、提高免疫力等生物活性[3-5]。目前对于金银花多糖的研究主要集中其分离纯化、药理活性等方面[6-9],而对其结构进行衍生化方面的研究尚未见报道。
对于多糖进行衍生化的方法主要包括物理法、化学法及生物法等。利用化学的方法对多糖的分子结构进行修饰,能够提高其生物活性,甚至赋予其新的生物活性。正因为如此,对于多糖的衍生化研究已成为多糖研究者重点关注的热点之一[10-13]。
本研究在前期对金银花多糖分离纯化的研究基础之上,利用响应面法对金银花多糖羧甲基化修饰的合成工艺条件进行了优化研究,并初步研究了羧甲基化后多糖的抗氧化性,考察羧甲基化修饰对金银花多糖抗氧化活性的影响。
1 材料与方法
1.1 材料与仪器
金银花购自西安万寿路中药材批发市场,氯乙酸、异丙醇、乙醇、乙醚、葡萄糖、苯酚、浓硫酸、邻苯三酚及其它试剂均为国产分析纯。
UV-2501PC 紫外可见分光光度仪(日本岛津公司);FA2004 电子天平(上海精科天平厂);H2050R台式离心机(湖南湘仪公司);ALPHA1-4 型真空冷冻干燥机(德国CHRIST 公司)。
1.2 实验方法
1.2.1 金银花多糖的制备
将金银花在80 ℃下干燥,粉碎后过60 目筛。再将其用无水乙醇在回流下脱脂两次,过滤,滤渣晾干后,用双蒸水,按料液比1∶15(g/mL)80 ℃下提取2 次,提取液合并,再按1 g 生药材浓缩为1mL 进行浓缩,浓缩液经脱蛋白、脱色处理后醇沉,即得金银花粗多糖,用水复溶后,再用Sephadex G-200 凝胶柱进行纯化,收集多糖富集峰,浓缩后冻干即得金银花多糖,经测定该多糖含量为95.2%,经高效凝胶色谱法检测,其为均一多糖,分子为31.3 Ku。
1.2.2 金银花多糖的羧甲基化
参照文献的方法[10],先精确称取一定量的多糖样品,加入适量异丙醇与浓度为20%的NaOH 的混合溶液将其溶解;再将氯乙酸溶于异丙醇中,并加入适量的20% NaOH 溶液混合均匀。在一定温度下,往多糖溶液滴加一定量的氯乙酸的异丙醇溶液。滴加完毕后,恒温反应一段时间后,待反应结束,冷却至室温,再用盐酸溶液将反应液调为中性。将反应液装入截留分子量为3500 的透析袋中用流动水透析48 h。透析液浓缩后即得羧甲基化修饰的金银花多糖。
1.2.3 金银花多糖羧甲基化取代度的测定
金银花多糖羧甲基化取代度的计算均按文献[13]的方法进行。准确称取10 mg 羧甲基多糖样品,在100 ℃干燥1 h 后转入锥形瓶中,加入3 mL 70%乙醇,混合后放置5 min。再依次加入10 mL水,50 mL 0.5mol/L NaOH。混合后搅拌直至样品溶解。然后用0.1 mol/L 盐酸滴定,用酚酞显示点,计算每克羧甲基多糖所需的盐酸的毫摩尔数(A):

式中:Vo为加入的Na0H 的体积(mL);V2为样品测定所消耗HCl 的体积(mL);V1为空白测定所消耗HCl 的体积(mL);Mo为加入的NaOH 的浓度,本实验中为0.5 mol/L;M 为测定所用HCl 的浓度,本实验中为0.1 mol/L;W 为测定所用样品的质量(g)。
羧甲基取代度(DS)按下式计算:

1.2.4 羧甲基化金银花多糖结构初步分析
参照文献[14],分别通过高效凝胶色谱法,红外光谱以及紫外光谱对金银花多糖羧甲基化前后的结构进行了初步分析。
1.2.5 抗氧化性能测试
参照文献[14]测试样品对超氧阴离子和羟自由基的清除效果。
2 结果与讨论
2.1 金银花多糖羧甲基化的合成
2.1.1 单因素分析
2.1.1.1 反应温度对金银花多糖羧甲基化取代度的影响
采用0.1g 金银花多糖,固定反应时间为2.5 h,氯乙酸浓度为:3.0 mol/L,分别考察了40、50、60、70和80 ℃五个反应温度下的反应过程,测定的不同产物的羧甲基化取代度,确定最优的反应温度。反应温度对金银花多糖羧甲基化取代度的影响结果见图1(A)。
2.1.1.2 氯乙酸浓度对金银花多糖羧甲基化取代度的影响
采用0.1 g 金银花多糖,固定反应时间为2.5 h,反应温度60 ℃,分别考察了2.0、2.5、3.0、3.5 和4.0 mol/L 五个氯乙酸浓度下的反应过程,测定的不同产物的羧甲基化取代度,确定最优的氯乙酸浓度。氯乙酸浓度对金银花多糖羧甲基化取代度的影响结果见图1(B)。
2.1.1.3 反应时间对金银花多糖羧甲基化取代度的影响
采用0.1 g 金银花多糖,固定氯乙酸浓度为:3.0 mol/L,反应温度60 ℃,分别考察了1.0、1.5、2.0、2.5 和3.0 五个反应时间下的反应过程,测定的不同产物的羧甲基化取代度,确定最优的反应时间。反应时间对金银花多糖羧甲基化取代度的影响结果见图1(C)。
由单因素的实验结果可知,当反应温度在40~60 ℃时,多糖羧甲基化取代度的值逐渐增大,当到60 ℃达到最大,随后随着温度的升高,取代度又出现了下降趋势,从多糖的取代度及稳定性考虑,确定最优的反应温度为60 ℃左右;当氯乙酸浓度在2.0~3.0 mol/L 时,多糖羧甲基化取代度的值快速增大,当到3.0 mol/L 左右时达到最大,随后随着配料比的增加,取代度趋于平缓,因此确定最优的氯乙酸浓度为3.0 mol/L 左右;当反应时间为1.0~2.0 h时,多糖羧甲基化取代度的值快速增大,2.0~2.5 h时逐渐变缓,2.5 h 小时以上,又逐渐下降,从多糖的取代度及稳定性考虑,因此确定最优的反应时间为2.5 h。
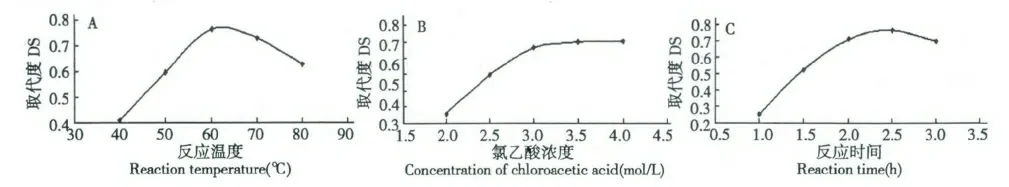
图1 反应温度(A)、氯乙酸浓度(B)及反应时间(C)对金银花羧甲基化取代度的影响Fig.1 Effects of reaction temperature (A),concentration of chloroacetic acid (B)and reaction time (C)on DS of L.japonica polysaccharides
2.1.2 金银花多糖羧甲基化工艺条件优化
本研究按照Box-Benhnken 的中心组合试验设计原理,在单因素实验的基础之上,以羧甲基取代度(DS)为响应值,选取反应温度、氯乙酸的浓度和反应时间等三个对反应具有较大影响的单因素进行响应面实验,来优化金银花多糖羧甲基化的工艺条件。实验因素和水平设计如表1 所示,响应面得到的实验及分析结果如表2 和表3 所示。

表1 实验因素水平表Table 1 Factors and levels of the designed experiment

表2 响应面分析实验方案及实验结果Table 2 Design and testing results of RSM

表3 方差分析表Table 3 Analysis of variance
采用Design-Expert 7.01 软件对响应面优化试验得到的结果进行分析研究,试验结果见表2,按照各因素对试验结果的影响进行二次方程拟合,拟合得到下式:
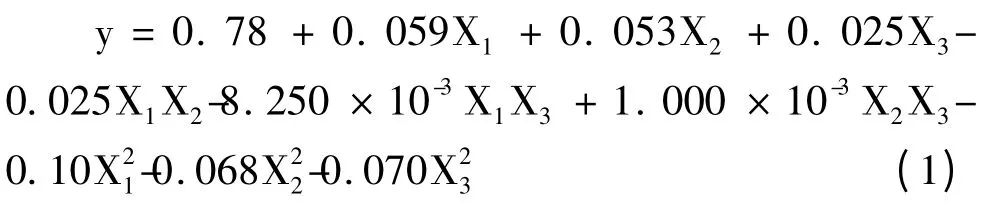
由方差分析表3 的分析结果可以看出,回归方程的F 值为106.98,P<0.0001,且失拟误差的P 值为0.0919,不显著,这说明,利用响应面法拟合得到的试验模型极显著,按照拟合模型得到的回归方程,考察其因变量与自变量之间的线性相关系数后发现,r=0.16/0.16=1.0000,这一点表明用该数学模型来评估各相关因素对金银花多糖羧甲基化取代度的影响可信值较高。对表3 的方差分析结果可以看出,响应面试验组合的反应温度和氯乙酸浓度对金银花多糖羧甲基化取代度的影响均极显著,反应时间为显著影响因素,其中最大的是反应温度,其次是氯乙酸浓度,反应时间的影响最小,在交互影响因素中,反应温度与氯乙酸浓度之间的交互影响为显著影响因素。
2.1.3 响应面图分析
通过响应面优化实验分析可以得到相应的响应面图,响应面图可以更加直观的反映出各单因素对金银花多糖羧甲基化取代度的影响结果以及各单因素之间交互影响的强弱关系。响应面实验得到的响应面图见图2。

图2 氯乙酸浓度和反应温度(A)、反应时间和反应温度(B)及反应时间和氯乙酸浓度(C)交互影响的响应面图Fig.2 Response surface plots showing the mutual effects of concentration of chloroacetic acid and reaction temperature (A),reaction time and temperature (B)and reaction time and concentration of chloroacetic acid (C)on DS of L.japonica polysaccharides
从图2 可以看出:反应温度对金银花多糖羧甲基化的取代度的影响极为显著,图中可看出其绘制的曲线最为陡峭;氯乙酸浓度对羧甲基化的影响次之,而影响最小的则是反应时间,相较于反应温度而言,其曲线较为平滑一些。通过响应面法预测得到的回归模型分析,可预测得到金银花多糖羧甲基化的最优合成工艺条件是:反应温度是61.7 ℃,氯乙酸浓度是3.225 mol/L,反应时间是2.6 h,预测的工艺条件下,得到的羧甲基化多糖的取代度为0.792[14]。
2.1.4 验证实验
按照上述预测的结果,从实验操作的可操作性考虑,微调上述工艺条件为:反应温度是60 ℃,配料比是3.2 mol/L,反应时间是2.6 h,在微调后的羧甲基化修饰的工艺条件下,做3 次多糖羧甲基化平行试验,得到的羧甲基化金银花多糖取代度的平均值为0.793,实验结果表明,通过回归方程预测得到的工艺条件与实际操作工艺条件十分吻合。
2.2 羧甲基化金银花多糖的初步结构分析
2.2.1 分子量测定
选择色谱柱:ShodexOhPakSB-804HQ;流动相:高纯水;流速:0.8 mL/min,柱温:25 ℃;检测器:示差折光检测器;进样量:10 μL 的条件下,分别对羧甲基化前后的金银花多糖进行了分子量的比较测试,结果如图3 所示。
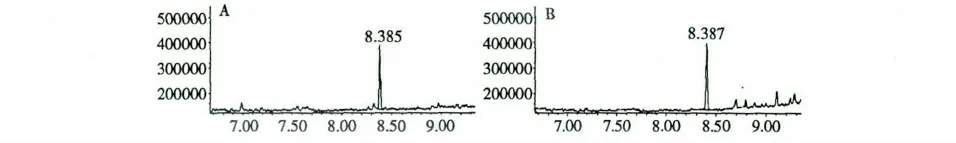
图3 金银花多糖(A)及羧甲基化金银花多糖(B)的高效凝胶色谱图Fig.3 HGPC chromatograms of L.japonica polysaccharides (A)and carboxymethyl L.japonica polysaccharides (B)
由图3 可知,经过羧甲基化后的金银花多糖主峰位置与羧甲基化前出峰时间基本一致,这说明,羧甲基化金银花多糖的分子量分布基本与金银花多糖一致,但是羧甲基化后的多糖高效凝胶色谱图上出现了较多的小杂峰,这应该是在羧甲基化过程中造成了部分金银花多糖的水解所致。
2.2.2 红外光谱
分别将金银花多糖、羧甲基化金银花多糖和溴化钾研磨压片后,红外光谱仪进行测定。结果如图4 所示。

图4 金银花多糖(A)及羧甲基化金银花多糖(B)的红外光谱图Fig.4 IR spectra of L.japonica polysaccharides (A)and carboxymethyl L.japonica polysaccharides (B)
由图4 可以看出,金银花多糖与其羧甲基化产物在红外谱图上的出峰位置很相似,这说明羧甲基化修饰对多糖的骨架结构没有造成影响。其中羧甲基化金银花多糖的红外谱图上出现了强度较大的1606 cm-1、1420cm-1和1333 cm-1信号峰,这些信号峰分别归属为COO-的对称和非对称伸缩振动峰,而谱图中1027 cm-1为C-O-C 的对称收缩振动峰,通过对这些特征吸收峰进行归属,可以判断本研究已经成功对金银花多糖进行了羧甲基化改性,并且未改变多糖本身的大体结构。
2.2.3 紫外光谱
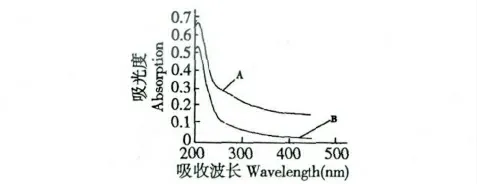
图5 金银花多糖(A)及羧甲基化金银花多糖(B)的紫外光谱图Fig.5 UV spectra of L.japonica polysaccharides and carboxymethyl L.japonica polysaccharides (B)
由图5 可知,羧甲基化前后的金银花多糖在200~450 nm 的紫外光谱基本一致,这说明改性并没有对多糖造成大的影响。
2.3 羧甲基化金银花多糖的抗氧化活性
2.3.1 羟自由基的清除实验
本研究分别考察了金银花多糖羧甲基化修饰前后对羟自由基的清除作用,实验结果见图6。

图6 羟自由基的清除实验Fig.6 The hydroxyl radical scavenging results
由图6 可知,经过羧甲基化修饰后的金银花多糖清除羟自由基的最大清除率为88.3%,比羧甲基化前多糖的最大清除率60.2%提高了28.1%,清除羟自由基的能力有了明显的提高。
2.3.2 超氧阴离子的清除实验
本研究分别考察了金银花多糖羧甲基化修饰前后对超氧阴离子的清除作用,实验结果见图7。
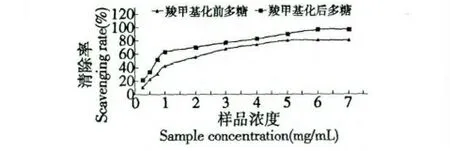
图7 超氧阴离子的清除实验Fig.7 The superoxide anion scavenging results
由图7 可知,经过羧甲基化修饰后的金银花多糖清除超氧阴离子的最大清除率为96.32%,比羧甲基化前多糖的最大清除率80.2% 提高了16.12%,清除超氧阴离子的能力也有了明显的提高。
上述抗氧化性实验结果说明,羧甲基化修饰的金银花多糖,其亲水性发生了改变,这可能是使其抗氧化活性高于未修饰多糖的原因尚在进一步的研究之中。
3 结论
本研究对金银花多糖进行羧甲基化修饰的工艺路线进行研究,并通过响应面分析方法优化了其最优的修饰工艺条件是:反应温度是60 ℃,配料比是3.2 mol/L,反应时间是2.6 h,在此条件下修饰制得的羧甲基化金银花多糖的羧甲基化取代度为0.793,利用该方法对多糖进行羧甲基化修饰,具有反应可操作性强,试剂便宜易得,多糖的羧甲基化取代度较高的优点,是一种较理想的多糖羧甲基化修饰方法。通过金银花多糖羧甲基化衍生物超氧阴离子和羟自由基的清除实验表明,经过羧甲基化修饰后的抗氧化能力较之羧甲基化修饰前的多糖有了非常明显的改善,其抗氧化能力进一步增强,本研究的成果为金银花多糖在药品、功能性食品等领域的进一步开发利用提供了一定的理论依据。
1 Bi YF (毕跃峰),Tian Y (田野),Bei SS (裴姗姗),et al.The chemical constituents of Lonicera japonica Thunb.J Zhengzhou Univ,Nat Sci Ed(郑州大学学报,理学版),2007,39:184-186.
2 Liu EL(刘恩荔),Li QS(李青山).Advance of Lonicera japonica Thunb.J Shanxi Med Univ (山西医科大学学报),2006,37:331-334.
3 Lin XP(林雄平),Chen XQ(陈晓清),Su YC(苏育才),et al.Antimicrobial activities of polysaccharide extracts from Flos lonicerae and Ilex kudingcha.Subtropical Plant Sci (亚热带植物科学),2008,37:51-53.
4 Yin HM(殷洪梅),Lv XY(吕新勇),Xiao W(萧伟).Optimization of extracting conditions of polysaccharides from Lonicera japonica and its immune activity.Chin J Chin Mate Med(中国中药杂志),2010,35:453-455.
5 Li EC(李尔春).Separation and purification of Lonicera japonica Thunb polysaccharides & research on its biological activities.Xi’an:Shaan’xi Normal University (陕西师范大学),2009.
6 Liu GH(刘光海).The extraction,purification and content determination of polysaccharide from Flos Lonicerae japonicae.J Hunan Univ Chin Med(湖南中医药大学学报),2009,29(11):33-34.
7 Deng QH(邓庆华).The research on optimizing the procedure of the extraction of Lonicera japonica Thunb with the orthogonal testing method.Changchun:Northeast Normal University (东北师范大学),MSc.2008.
8 Yin HM(殷洪梅),Shang Q(尚强),Xiao W(萧伟).Deproteinization from Lonicerae japonicae polysaccharide.Chin Tradit Herb Drugs (中草药),2010,4:584-586.
9 Zhao P(赵鹏),Li WH(李稳宏),Zhu ZH(朱骤海),et al.Optimization of ultrasonic extraction for polysaccharides from Lonicera japonicae.Food Sci (食品科学),2009,30:151-154.
10 Liang J(梁进),Zhang JY(张剑韵),Cui YY(崔莹莹),et al.Study on chemical modification and anticoagulant function in vitro of tea polysaccharides.J Tea Sci (茶叶科学),2008,28(3):166-171.
11 Qi HM,Zhang QB,Zhao TT,et al.In vitro antioxidant activity of acetylated and benzoylated derivatives of polysaccharide extracted from Ulva pertusa (Chlorophyta).Bio Med Chem Lett,2006,16:2441-2445.
12 Qi HM,Zhao TT,Zhang QB,et al.Antioxidant activity of different molecular weight sulfated polysaccharides from Ulva pertusa Kjellm (Chlorophyta).J App Phy,2005,17:527-534.
13 Zhang LH(张丽华),Song X (宋逍),Zhao P(赵鹏),et al.Study on carboxymethylated derivatives synthesis of polysaccharides from Tussilago farfara.Nat Prod Res Dev (天然产物研究与开发),2013,25:892-896.
14 Zhao P(赵鹏).Isolation,characterization of polysaccharide from Tussilago farfara.Xi’an:Northwest University (西北大学),PhD.2010.

