鼠尾草酸的抗氧化活性及抑菌活性研究
夏田娟,毕良武,2*,赵振东,2,邢雅丽,程 贤
1中国林业科学研究院林产化学工业研究所 生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室江苏省生物质能源与材料重点实验室,南京 210042;2 中国林业科学研究院林业新技术研究所,北京 100091
鼠尾草酸(Carnosic acid,简称CA),酚型二萜类化合物,分子式为C20H28O4,相对分子质量为332.43,是迷迭香和鼠尾草等植物中重要的天然抗氧化活性成分[1]。鼠尾草酸的外观为无色至淡黄色粉末晶体,易溶于油脂不溶于水,具有高效、安全、耐高温等特性[2]。作为重要的天然抗氧化剂,鼠尾草酸被广泛地应用于油脂及含脂食品、医药、饲料和化妆品等方面[3-5]。此外,鼠尾草酸所具有的良好抑菌活性也得到了广泛关注[6]。
为深入挖掘鼠尾草酸的良好的生物活性以及充分开发和利用鼠尾草酸资源提供科学依据,采用当前公认的1,1-二苯基-2-三硝基苯肼DPPH 自由基清除能力、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐ABTS 自由基清除能力、铁还原力等抗氧化活性检测与评价方法[7-9],进一步对鼠尾草酸与多种常规的合成抗氧化剂的抗氧化性能进行比较;同时,通过平板二倍稀释法[10]测试和评价迷迭香提取物、鼠尾草酸粗品、鼠尾草酸随着鼠尾草酸纯度的提高对六种不同菌种的最低抑菌浓度,探讨不同纯度的鼠尾草酸其抗菌种类及抗菌效果,为今后更好、更系统地开发和利用鼠尾草酸的抗氧化活性和抑菌活性提供参考。
1 材料与仪器
1.1 原料、试剂与仪器
UV9100 紫外可见分光光度计,北京莱伯泰科仪器有限公司;TG1650-WS 台式高速离心机,上海卢湘仪离心机仪器有限公司;HPX-Ⅲ系列恒温恒湿箱,上海新昌医疗器械制造有限公司;数显恒温水浴锅,上海江星仪器有限公司;LDZX-50KBS 立式压力蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-2F 型双人双面净化工作台,苏州净化设备有限公司;YCD209 超声波加湿器,北京亚都室内环保科技股份有限公司;移液器,杭州陆恒生物科技有限公司。
无水乙醇、三氯化铁,南京化学试剂有限公司;DPPH、ABTS 阿拉丁试剂(上海)有限公司;BHQ、BHT、BHA、PG,萨恩化学技术(上海)有限公司;VE,上海源叶生物科技有限公司;三氯乙酸、过硫酸钾,购于国药集团化学试剂有限公司;铁氰化钾,上海强顺化学试剂有限公司;苯扎溴铵溶液(新洁尔灭),南昌白云药业有限公司;氨苄青霉素钠,上海将来实业有限公司;红霉素,北京曙光药业有限责任公司;水解酪蛋白琼脂(MH),上海博微生物技有限公司。
大肠埃希式杆菌(CMCC-441.2,Escherichia coli)、金黄色葡萄球菌(CMCC-26003,Staphyloccocus aureu)、表皮葡萄球菌(CMCC-26069,Staphyloccocus epidermidis)、绿脓假单胞菌(CMCC-10104,Pseudomonas aeruginosa)、产气肠杆菌(GIM-1.234,Escherichia aerogenes)、肺炎克雷氏菌(GIM-1.279,Klebsiella pneumonia),中国微生物菌种网–北京北纳创联生物技术研究院。
迷迭香叶子,河南省禹州市湫水迷迭香种植有限公司。
1.2 实验方法
迷迭香提取物的制备:称取一定量的迷迭香叶子粉,按液固比16∶1(mL/g)加入75%的乙醇,加入3%乙酸作为稳定剂(相对于乙醇),超声频率28 kHz,超声功率200 W,超声提取时间40 min,超声温度35 ℃。提取液经过滤得滤液,滤液减压蒸馏得到迷迭香提取物浸膏,在40 ℃真空干燥箱干燥后研钵内研磨,即得迷迭香提取物粉末,HPLC 检测其中鼠尾草酸含量约为20%。
鼠尾草酸粗品的制备:称取一定量的迷迭香提取物粉末,按液固比20∶1(mL/g)加入适量的正己烷,超声频率28 kHz,超声功率140 W,超声提取时间40 min,超声温度35 ℃。提取液经过滤得滤液,滤液用一定量3%的碳酸氢钠溶液萃取,分液漏斗静置分液,水相用30%盐酸调节pH 至2.0。然后用正己烷再次萃取,萃取液减压浓缩至干,在研钵中研磨即得鼠尾草酸粗品,HPLC 检测其中鼠尾草酸含量约为75%。
鼠尾草酸的制备:取一定量的鼠尾草酸粗品,一定量200~300 目的硅胶、乙酸乙酯∶石油醚=4∶7(v/v)、洗脱剂流速为4 mL/min、负载量为0.3 g,接样量为5 mL/管,进行硅胶柱层析分离,经薄层色谱鉴定收集鼠尾草酸含量较高的几个级分合并、减压浓缩至干,即得鼠尾草酸,HPLC 检测其中鼠尾草酸含量约为97%。
1.2.1 鼠尾草酸的DPPH 自由基清除能力测定[7]
(1)用无水乙醇配置1 mmol/L 的DPPH 溶液,避光保存。将测试样品稀释至不同浓度;(2)将2.0 mL 测试样品溶液及2.0 mL DPPH 溶液加入到同一试管中,摇匀,室温下暗处静置30 min 后517 nm 处光吸收值测定其吸光度Asample,同时测定2.0 mL DPPH 溶液与2.0 mL 溶剂(无水乙醇)混合后的吸光度Acontrol,以及2.0 mL 测试样品溶液与2.0 mL无水乙醇混合后的吸光度Ablank。按公式(1)进行DPPH 清除率的计算。以同等浓度的叔丁基对苯二酚TBHQ、2,6-二叔丁基-4-甲基苯酚BHT、丁基羟基茴香醚BHA、没食子酸丙酯PG 和VE 为对照。实验重复三次,取平均值。
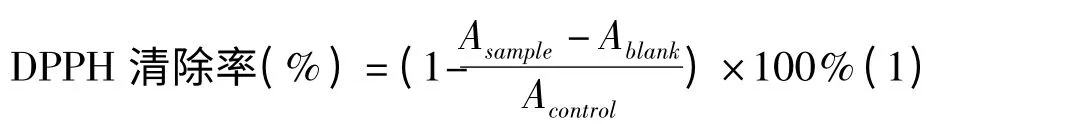
1.2.2 鼠尾草酸的ABTS 自由基清除能力测定[8]
取7 mmol/L 的ABTS 溶液5.0 mL,加入140 mmol/L 的过硫酸钾溶液88.0 μL,室温暗处静置14 h,得到ABTS 自由基贮备液。用乙醇对其进行稀释至734 nm 处的光吸收值为0.7±0.02,得ABTS 工作液。分别取0.1 mL 稀释后的不同浓度的鼠尾草酸溶液与3.9 mL ABTS 工作液混合成样品液,室温避光反应6 min 后测定样品液在734 nm 处的吸光值(Asample);以0.1 mL 无水乙醇与3.9 mL ABTS 工作液混合进行空白试验(Ablank)。ABTS 自由基清除率按公式(2)进行计算。以同等浓度的TBHQ、BHT、BHA、PG 和VE 为对照。实验重复三次,取平均值。
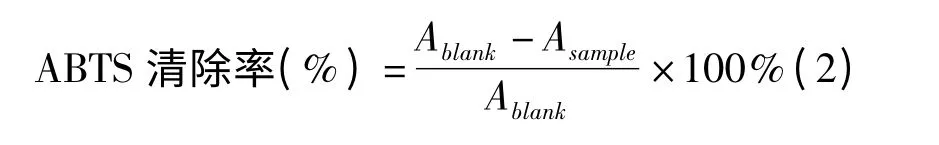
1.2.3 鼠尾草酸的铁还原力测定[9]
在1mL pH 值为6.6 的磷酸缓冲液中分别加入不同浓度的鼠尾草酸溶液200 μL 以及10 g/L 的铁氰化钾溶液1.0 mL,振荡混匀后50 ℃恒温水浴20 min。冷却后加入体积分数10%的三氯乙酸溶液1.0 mL,4000 rpm 下离心10 min。取上层清液2.0 mL,依次加入2.0 mL 无水乙醇、1.0 mL 三氯化铁溶液(1 g/L),振荡混匀后700 nm 处测定光吸收值。吸收值越大,说明还原力越强。以同等浓度的TBHQ、BHT、BHA、PG 和VE 为对照。实验重复三次,取平均值。
1.2.4 鼠尾草酸抑菌活性的测定
采用平板二倍稀释法,测定样品的最低抑菌浓度[10]。实验选取以下六种致病菌株,分别为:大肠埃希氏杆菌A,金黄色葡萄球菌B,表皮葡萄球菌C,绿脓假单胞杆菌D,产气肠杆菌E,肺炎克雷伯氏菌F。参照物选择新洁尔灭、氨苄青霉素钠和红霉素。实验重复三次,取平均值。
1.2.4.1 菌种的活化
分别将六种致病菌株接种于固体斜面培养基上,在恒温恒湿培养箱中于37 ℃下培养24 h 进行活化培养,传二代。
1.2.4.2 培养皿的高温灭菌
将培养皿用牛皮纸包好,置于干燥箱中,161℃,2 h。
1.2.4.3 琼脂的配制与高压蒸汽灭菌
取19 g 的水解酪蛋白琼脂加入三角瓶中,加入500 mL 蒸馏水,80 ℃水浴加热至琼脂完全溶解。无菌封口膜封口,置于高压蒸汽灭菌锅内,121 ℃,灭菌30 min。然后放入60 ℃恒温水浴锅中,待用。
1.2.4.4 样品溶液的配制
精确称量0.0256 g 样品,置于10 mL 的无菌容量瓶中,加入DMSO 使之溶解,定容,得到2560 μg/mL 的a,用移液枪取2.0 mL 的a 溶液与2.0 mL DMSO 混合,得到1280 μg/mL 的b 溶液,以同样的方法,依次取2.0 mL 样品溶液与2.0 mL DMSO 混合,以此倍比稀释,可得到浓度分别为640、320、160、80、40、20 μg/mL 的一系列DMSO 样品溶液。
1.2.4.5 含样琼脂平板的制备
将上述已配好的不同浓度的抗菌药物分别加入不同的平板中,加入一定量的琼脂,在平台上充分混合均匀。
分别取上述已配备好的不同浓度的样品溶液1.0 mL 加入已灭菌过的培养皿里,加入9.0 mL 琼脂,立即混合均匀,待琼脂完全凝固后即可得到浓度稀释为原来的十分之一,从低到高依次为2、4、6、8、16、32、64、128、256 μg/mL 的含药平板。
1.2.4.6 接种物的制备和接种
取已经活化过并接种到新鲜斜面上的菌种到已经灭菌处理过的试管中,加入无菌水适当稀释,并与0.5 号麦氏比浊管对比,制备得到菌悬液的浓度约为108CFU/mL。将制备好的菌悬液接种于含样琼脂表面,置于30 ℃恒温恒湿培养箱中培养24 h,观察结果。
2 结果与分析
2.1 抗氧化活性测定结果
2.1.1 DPPH 自由基清除能力
抗氧化剂的存在可以使得DPPH 溶液紫色减褪,517 nm 处吸收减弱。鼠尾草酸及各对照物对DPPH 自由基的清除作用见图1。由图1 可知,鼠尾草酸及各对照物对DPPH 的清除率呈量效关系,随着各物质质量浓度的增加,对DPPH 的清除率也相应增大,且鼠尾草酸在较低的浓度下就有较高的清除效率,其清除DPPH 的IC50值为2.53 μg/mL。鼠尾草酸质量浓度为5 μg/mL 时,对DPPH 的清除率可以达到90%以上。在所测浓度范围内,鼠尾草酸及各对照物对DPPH 清除能力大小的顺序为:TBHQ>CA>PG>BHA>BHT>VE。
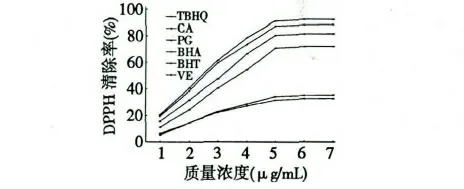
图1 鼠尾草酸对DPPH 自由基的清除作用Fig.1 The scavenging activity of carnosic acid on DPPH radical
2.1.2 ABTS 自由基清除能力
鼠尾草酸及各对照物对ABTS 自由基的清除作用见图2。由图2 可知,在所测质量浓度范围内,鼠尾草酸及各对照物对ABTS 自由基的清除能力随着质量浓度的增大而增强,鼠尾草酸对ABTS 自由基的IC50为51.58 μg/mL。在质量浓度为100 μg/mL时,鼠尾草酸的ABTS 清除率为88.40%,TBHQ 为90.15%,PG 为81.23%,BHA 为70.59%,BHT 为33.48%,VE 为32.75%。同等浓度下,鼠尾草酸的清除能力均高于PG、BHT、BHA 和VE,仅低于TBHQ。在所测浓度范围内,鼠尾草酸及各对照物对ABTS 清除能力大小的顺序为:TBHQ>CA>PG>BHA>BHT>VE。
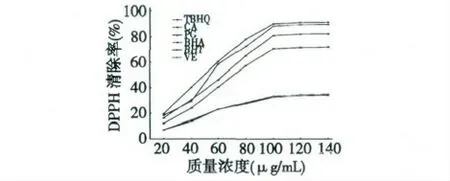
图2 鼠尾草酸对ABTS 自由基的清除作用Fig.2 The scavenging activity of carnosic acid on ABTS radical
2.1.3 铁离子还原力
氧化活性与还原力之间的普遍相关性决定了可以通过测定还原力来表征抗氧化活性的强弱。鼠尾草酸及各对照物的铁离子还原能力见图3。由图3可知,鼠尾草酸及各对照物的质量浓度与其还原力间呈一定的线性关系。当质量浓度为20 μg/mL时,鼠尾草酸在700 nm 处光吸收值(即还原力)为0.549,TBHQ 为0.642,PG 为0.475,BHA 为0.425,BHT 为0.330,VE 为0.327。随着浓度的增大,鼠尾草酸及各对照物的还原力大小差异也逐渐增大,当浓度为100 μg/mL 时,鼠尾草酸的光吸收值为2.189,TBHQ 为2.230,PG 为2.034,BHA 为1.623,BHT 为1.349,VE 为1.152。同等质量浓度下,鼠尾草酸的还原力均高于PG、BHT、BHA 和VE,仅低于TBHQ。在所测质量浓度范围内,鼠尾草酸及各对照物的铁离子还原力大小的顺序为:TBHQ>CA>PG>BHA>BHT>VE。
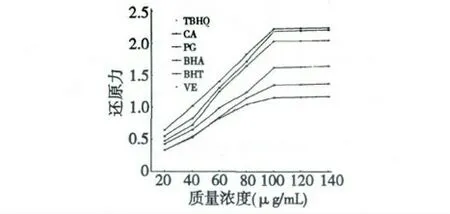
图3 鼠尾草酸的还原能力Fig.3 Reducing ability of carnosic acid
2.2 抑菌活性测定结果
实验选取了六种代表性菌株进行抑菌活性研究,分别为大肠埃希氏菌A,金黄色葡萄球菌B,表皮葡萄球菌C,绿脓假单胞菌D,产气肠杆菌E,肺炎克雷伯氏菌F。其中,A、B、D、E 为革兰氏阴性菌(G+),C、F 为革兰氏阳性菌(G-)。所测试的三种样品对不同菌株的抑制作用列于表1 中。
从表1 中可以看出,三种样品对六种菌种均有一定的抑制作用。迷迭香提取物、鼠尾草酸粗品、鼠尾草酸对大肠埃希式杆菌、金黄色葡萄球菌、表皮葡萄球菌的抑制效果不相上下;对绿脓假单胞菌的抑制效果最好,其最低抑菌浓度都<2 μg/mL;对于产气肠杆菌,迷迭香提取物和鼠尾草酸粗品表现出了同样的抑菌效果,鼠尾草酸则对该菌种的抑制效果不明显;对于肺炎克雷伯氏菌,可以看出迷迭香提取物、鼠尾草酸粗品、鼠尾草酸对其抑制效果越来越显著,鼠尾草酸则表现出了最好的抑菌效果,最低抑菌浓度达到了<2 μg/mL,可以看出,随着鼠尾草酸含量的提高,抑菌效果也出现显著提高,这可以从鼠尾草酸具有良好的抗炎、抗菌作用得到证明。因迷迭香提取物、鼠尾草酸粗品、鼠尾草酸中鼠尾草酸纯度的差别可能导致对不同的菌种具有不同的抑制作用,也可能是由于这三种样品中含有的迷迭香酸、鼠尾草酚等物质的影响而导致对不同的菌种有不同的抑制效果,需要进一步的研究才能给出确切的结论。
在与三种对照物的对比中发现:对于大肠埃希氏杆菌、绿脓假单胞菌,鼠尾草酸的最低抑菌浓度分别为4 和<2 μg/mL,表现出了比新洁尔灭、氨苄青霉素钠、红霉素更好的抗菌性;对于金黄色葡萄球菌,鼠尾草酸的最低抑菌浓度为8 μg/mL,优于新洁尔灭,但差于氨苄青霉素钠和红霉素;对于表皮葡萄球菌,鼠尾草酸的最低抑菌浓度为4 μg/mL,优于新洁尔灭和氨苄青霉素钠,差于红霉素;对于产气肠杆菌,鼠尾草酸表现出了和新洁尔灭同样的抑菌效果,最低抑菌浓度均为128 μg/mL,优于氨苄青霉素钠的,差于红霉素;对于肺炎克雷伯氏菌,鼠尾草酸表现出了和红霉素同样的抑菌效果,其最低抑菌浓度均为<2 μg/mL,优于新洁尔灭和氨苄青霉素钠。从表1 中可以看出,鼠尾草酸具有一定的广谱抗菌性,对于革兰氏阴性菌和革兰氏阳性菌均表现出了良好的抑菌效果,但比较之后发现,鼠尾草酸对于革兰氏阴性菌具有相对较广泛的抑制作用,但对于革兰氏阴性菌中的肺炎克雷伯氏菌,鼠尾草酸具有比三种对照物更好的抑制效果,这说明鼠尾草酸同样具有很好的抗炎作用。
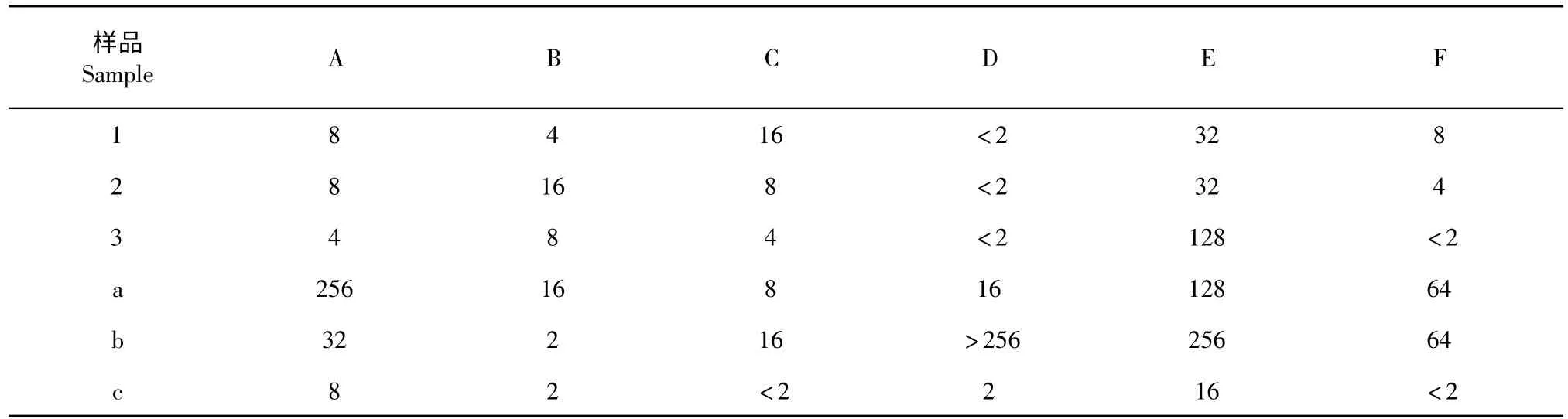
表1 不同浓度鼠尾草酸的最小抑菌浓度(μg/mL)Table 1 MIC of carnosic acid under different concentrations
3 讨论
经DPPH 自由基清除能力、ABTS 自由基清除能力、铁还原力等3 种体外抗氧化评价指标评定,发现鼠尾草酸具有比合成抗氧化剂PG、BHT、BHA、VE更好、仅次于TBHQ 的抗氧化性能,可在较低的浓度水平发挥较强的抗氧化能力,其清除DPPH 自由基的IC50值为2.53 μg/mL,清除ABTS 自由基的IC50值为51.58 μg/mL。相对于合成抗氧化剂,鼠尾草酸具有低毒性,因而可作为天然食品抗氧化剂加以开发利用。
经平板二倍稀释法发现:对于大肠埃希氏杆菌、绿脓假单胞菌,鼠尾草酸的最低抑菌浓度分别为4和<2 μg/mL,表现出了比新洁尔、氨苄青霉素钠、红霉素更好的抗菌性;对于金黄色葡萄球菌,鼠尾草酸的最低抑菌浓度为8 μg/mL,优于新洁尔灭,但差于氨苄青霉素钠和红霉素;对于表皮葡萄球菌,鼠尾草酸的最低抑菌浓度4 μg/mL,优于新洁尔灭和氨苄青霉素钠,差于红霉素;对于产气肠杆菌,鼠尾草酸表现出了与新洁尔灭相同的抑菌效果,最低抑菌浓度均为128 μg/mL,优于氨苄青霉素钠的,差于红霉素;对于肺炎克雷伯氏菌,鼠尾草酸表现出了和红霉素同样的抑菌效果,其最低抑菌浓度均为<2 μg/mL,优于新洁尔灭和氨苄青霉素钠。随着鼠尾草酸含量的提高,抑菌效果也出现显著提高,说明鼠尾草酸具有良好的抗炎、抗菌作用。
对鼠尾草酸的生物活性研究最多的就是其抗氧化性,且其多用于油脂及含脂食品的保鲜、贮存,食品的添加剂和化妆品等方面,Du 等[11]仅指出鼠尾草酸的抗氧化能力指数是BHT、VE的3 倍,但低于BHA,Zhang 等[12]则通过定期测定过氧化值、硫代巴比妥酸值、游离脂肪酸含量及茴香胺值等各项参数,来比较鼠尾草酸与合成抗氧化剂对葵花籽油脂质的抗氧化作用,实验发现:随着鼠尾草酸浓度的增加,其对葵花籽油脂质的抗氧化作用显著增强,并且显示出了比合成抗氧化剂BHT 和BHA 更强的抗氧化活性。本研究在以往文献资料的基础上补充了鼠尾草酸和TBHQ、PG 的抗氧化性的强弱,对鼠尾草酸和常见的合成抗氧化剂TBHQ、BHT、BHA、PG 和VE均进行了比较,且得出了这六种物质抗氧化性强弱的顺序:TBHQ>CA>PG>BHA>BHT>VE。大多数人类的疾病都是由氧化应激造成的,如糖尿病及慢性并发症、肺纤维化、高血压、感冒、动脉粥样硬化和相应的心血管疾病、癌症和帕金森病等。鉴于鼠尾草酸良好的抗氧化活性,其有可能在抗衰老方面发挥作用,已经有报道鼠尾草酸具有抗微血管分支生成的功效[13],鼠尾草酸在未来有可能成为治疗心血管疾病的良药。
关于鼠尾草酸的抑菌活性,国内外也有相关类文献研究了鼠尾草酸对不同菌株的抑制效果,但大多只针对于某一特定菌种[6,14],未能全面的探究鼠尾草酸对不同菌株的抑制效果。大多数革兰氏阳性菌的致病物质主要为外霉素,而大多数革兰氏阴性菌的致病物质主要为内霉素,为此,实验选择革兰氏阴性菌和革兰氏阳性菌来研究鼠尾草酸对二者的抑制效果,能清晰地辨别出鼠尾草酸在疾病治疗方面适合针对何种霉素引起的细菌感染等疾病,为进一步开发利用鼠尾草酸在医学中的应用奠定理论基础。因此,本研究结果对鼠尾草酸的抑菌活性作了更进一步的补充。实验发现鼠尾草酸对于革兰氏阴性菌具有相对较广泛的抑制作用,其抑菌机理还有待进一步研究发现。
鉴于鼠尾草酸良好的抑菌效果,因此有待加强对其抑菌活性及机理的进一步研究探索,使其尽早应用于人类疾病的治疗。鉴于鼠尾草酸具有良好的抗氧化和抑菌作用,可以进一步研究开发其成为新型的天然防腐保鲜剂的原料。
1 Rosemary C,Bi LW(毕良武),Zhao ZD(赵振东).Research progress of rosemary in Europe.Bio Chem Eng (生物质化学工程),2006,40:41-44.
2 Li DW(李大伟).Study on ultrasound-assisted extraction and isolation of bioactive components from rosemary leaves.Beijing:Chinese Academy of Forestry,MSc.2012.
3 Li YL(李燕凌),Zhang ZX(张志旭),Hu L(胡令).Antioxidation of polysaccharides from Poria cocos.Nat Prod Res Dev (天然产物研究与开发),2012,24:1126-1128.
4 He HJ(贺红军).Application of biopreservatives to chilled meat.Qingdao:Ocean University of China(中国海洋大学),MSc.2004.
5 Huang JN(黄纪念).Study on antioxidative activity and its mechanism of rosemary and development of natural functional food.Beijing:China Agricultural University(中国农业大学),PhD.2003.
6 Rozman T,Jersek B.Antimicrobial activity of rosemary extracts (Rosmarinus officinalis L.)against different species ofListeria.Acta Agri Slovenica,2009,93:51-58.
7 Li YY,Li K,Wang JX,et al.α-Glucosidase inhibitory and antioxidant activity of ardisia crenata.Nat Prod Res Dev (天然产物研究与开发),2012,24:1257-1260.
8 Yang FX(杨凤贤).Study on the chemical constituent and the antioxidant activity from rosemarinus officinalis L.Kunming:Southwest Forestry University(西南林学院),MSc.2009.
9 Chen R(陈如).Antioxidant activity of Rosemarinus officinalis L.Shanghai:Shanghai University(上海大学),MSc.2005.
10 Gao YQ(高艳清),Wang D(王丹),Shang SB,et al.Synthesis and antibacterial activity of dihydrocumatacylthiourea.Chem Ind Forest Prod (林产化学与工业),2012,32:23-27.
11 Du JQ (杜纪权),Xu H(徐鸿),Chen XX(陈雪香),et al.Separation and purification of carnosic acid from rosemary and determination of oxygen radical absorbance capacity.Food Machine(食品与机械),2011,27:87-91.
12 Zhang Y (张莹),Chen XQ(陈小强),Yang L(杨磊),et al.Protective effects of high pure carnosic acid against lipid oxidation of sunflower oil.Nat Prod Res Dev (天然产物研究与开发),2010,22:107-112,.
13 Kayashima T,Matsubara K.Antiangiogenic effect of carnosic Acid and carnosol,neuroprotective compounds in rosemary leaves.Biosci Biotechnol Biochem,2012,76:115-119.
14 Yuan GJ (袁干军),Li PB (李沛波),Yang H (杨慧).Anti-MRSA activity of carnosic acid in rosemary.Chin JMAP(中国现代应用药学),2012,29:571-574.

