抑制Claudin-1 表达对SW620 细胞侵袭性和转移性的影响研究
王彦斌 ,孙敏娴,马文强,郑 琦(大连市第二人民医院消化科,辽宁 大连 116100)
肿瘤是目前危害人类健康最严重的疾病之一,具有自主生长性、移植性、侵袭性及转移性,以侵袭性及转移性最为关键,同时也是判断肿瘤恶性程度的重要指标,超过80%以上的肿瘤患者死于肿瘤的侵袭和转移[1]。侵袭和转移是紧密相连的两个阶段,关于对肿瘤侵袭和转移方面的分子研究很多,1998 年,Furuse 等[2]发现一类新型的紧密连接蛋白Claudin-1,它主要调节细胞间的黏附。有研究发现,Claudin-1 的表达在人类大肠癌组织中比正常组织中明显上调,且能调节细胞的侵袭能力。本研究通过抑制SW620 中Claundin-1 的表达量来观察Claudin-1 对SW620 细胞侵袭性和转移性的影响,以进一步研究claundin-1 的生物学习性。
1 材料
1.1 细胞株来源
人结肠癌细胞株SW620 来自美国菌种保藏中心,由中国科学院上海细胞生物学研究所提供。
1.2 Claudin-1 shRNA
自行设计1 段shRNA 片段及1 段无意义干扰片断,由上海吉玛制药有限公司合成,片段序列及干扰位点见表1。将shRNA 片段进行转染,构建稳定的转染细胞株,命名为SW620-shRNA;无意义的干扰片段作为对照,命名为SW620-control。

表1 shRNA 片段、无意义干扰片断序列及干扰位点Tab 1 shRNA fragment、meaningless fragments of interference sequence and interference locus
1.3 仪器与试药
CO2培养箱(型号3427,美国Thermo 公司);电泳仪、电泳槽(美国Bio-Rad 公司)。Lipofectamine 2000(美国Invitrogen公司;兔抗人Claudin-1 抗体、山羊抗兔抗体(美国Cell Signaling Technology 公司);10%胎牛血清、RPMI-1640 培养基、0.25%胰蛋白酶(美国Gibco 公司)。
2 方法
2.1 细胞培养
SW620 细胞在含5% CO2、37 ℃培养箱中用含10%胎牛血清的RPMI-1640 培养基培养,用0.25%胰蛋白酶消化传代,1 周2 次。
2.2 脂质体法转染SW620 细胞
用Lipofectamine 2000 将质粒导入SW620 细胞。具体步骤:将SW620 细胞消化下来,将细胞浓度调整为1 ×105/ml,以2 ml/孔接种入6 孔板,用无抗菌药物的培养液培养16 ~24 h以上至细胞密度达到75%左右。撤去原培养液,以1 ×磷酸盐缓冲液(PBS)轻轻冲洗3 遍,以2 ml/孔加入Opti-MEN Ⅰ溶液。加入质粒后,将其置于37 ℃、5% CO2、饱和湿度的培养箱中,培养24 h 后更换无抗菌药物的含10% 胎牛血清的PRMI-1640 培养液,48 h 后用含遗传霉素(G418)的10%胎牛血清的RPMI-1640 培养液筛选。待形成阳性单细胞克隆群落后,用尖吸管吸取单克隆阳性细胞培养。
2.3 免疫蛋白质印迹法(western blot,WB)检测Claudin-1蛋白表达水平
恒压80 V,当溴酚蓝前沿进入分离胶,把电压提高至120 V,继续电泳直至溴酚蓝到达分离胶底部;半干电转移,以5%的脱脂奶粉/TBS-T 缓冲液封闭聚偏二氟乙烯(PVDF)膜2 h,室温(25 ℃)下轻柔摇动;以5%的脱脂奶粉/TBS-T 缓冲液稀释相应的一抗(1 ∶1 000 μl),与PVDF 膜4 ℃孵育过夜;以TBS-T 缓冲液洗涤5 min、3 次。二抗与一抗结合:以5%的脱脂奶粉/TBS-T 缓冲液稀释相应的二抗(1∶5 000 μl),与PVDF 膜孵育1 h,室温(25 ℃)下轻柔摇动;以TBS-T 缓冲液洗涤5 min、3 次;以TBS 缓冲液再洗涤5 min。增强化学发光显影,用UVI 凝胶成像系统摄像,采用Image-Pro Plus 6.0 软件分析条带灰度值。
2.4 细胞侵袭试验
待测细胞各组,每组设4 个孔;取细胞对数生长期,用无血清RPMI-1640 培养液过夜;按说明书铺基质胶;消化下细胞后,用PBS 调整细胞浓度为1 ×106/ml;在上、下室分别加入100 μl 细胞悬液和500 μl 含10% FBS 的RPMI-1640 培养液,于37 ℃、50 ml/L CO2培养48 h;取出上室,除去膜上室面的基质胶和细胞,以4%多聚甲醛固定膜下室面的细胞15 min;以结晶紫染色10 min,取下风干后,以中性树脂封固。在400 ×高倍镜下,每张膜取上、下、左、右、中5 个视野计数。
2.5 动物体内转移试验
实验动物:4 ~6 周龄的Balb/c 裸鼠36 只,雄性,体质量(19 ±2)g,随机分为2 组,分别为SW620-shRNA 组和SW620-control 组,每组各18 只,均置于SPF 环境下饲养。构建脾脏保留法制备裸鼠肝转移模型,2 组裸鼠分别注射含5 × 106SW620-shRNA 或SW620-control 的细胞悬液50 μl。术后继续在SPF 条件下饲养。病理观察:接种后4 周处死裸鼠,打开腹腔,观察脾脏和肝脏有无转移,记录肝脏表面转移结节数量,所有转移瘤均经病理切片苏木精-伊红染色证实。根据肝表面转移灶数目分为4 个等级:0 级,肝脏无转移病灶;Ⅰ级,1 ~3 个转移病灶;Ⅱ级:3 ~5 个转移病灶;Ⅲ级:>5 个转移病灶。
2.6 统计学方法
采用SPSS 19.0 统计学软件对数据进行处理,计数资料采用χ2检验,P<0.05 为差异有统计学意义。
3 结果
3.1 应用RNA 干扰技术抑制Claudin-1 的表达水平
采用WB 检测应用RNA 干扰技术抑制Claudin-1 的表达水平,结果见图1。
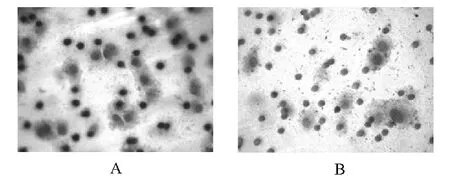
图1 WB 检测Claudin-1 的表达水平Fig 1 Results of the expression level of Claudin-1 determined by Westen blot
3.2 抑制Claudin-1 的表达后对细胞侵袭能力的影响
采用穿膜侵袭试验检测SW620-shRNA 与SW620-control细胞对基质胶侵袭能力的差异,结果见图2。结果显示,SW620-control 组的细胞比SW620-shRNA 组更具有侵袭力,抑制率高达70%,差异极有统计学意义(P<0.001)。
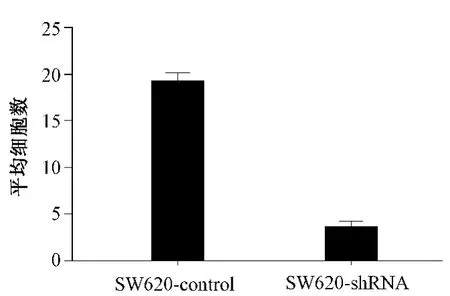
图2 下调Claudin-1 表达水平对SW620 细胞侵袭性的抑制结果Fig 2 Inhibition results of SW620 cells invasion after the down-regulation of expression level of Claudin-1
3.3 抑制Claudin-1 的表达对肿瘤细胞在裸鼠中转移能力的影响
抑制Claudin-1 的表达后,不仅明显抑制了SW620 细胞在裸鼠中的转移,而且减少了转移灶的形成,见表2。
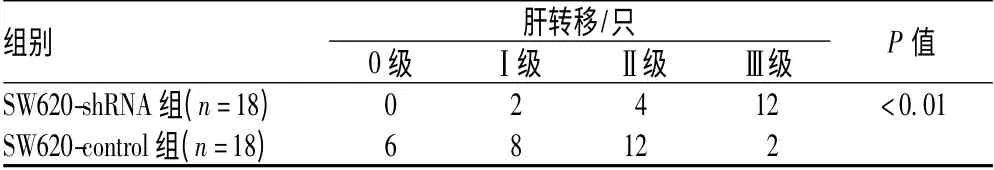
表2 抑制Claudin-1 的表达对SW620 细胞裸鼠肝脏转移能力的影响Tab 2 Effect of inhibiting Claudin-1 expression on SW620 cells in liver metastasis capacity of nude mice
4 讨论
Claudin-1 为位于人染色体3q28-q29 的基因,编码211 个氨基酸,主要参与细胞间的黏附调节。研究发现,Claudin-1 在不同肿瘤中的表达有明显差异,如其在乳腺癌[3-4]、肺腺癌[5]中以低表达的形式促进肿瘤的发病,而在其他肿瘤细胞如肾细胞癌、卵巢癌、胃肠道肿瘤中却以过表达的形式促进疾病发展[6-12]。
恶性肿瘤的侵袭及转移表现为原发灶的恶性肿瘤细胞侵袭邻近组织或转移到远处,并进一步生长形成转移灶,其发生的过程建立在穿透基底膜的基础上。本研究发现,抑制Claudin-1 的表达后,SW620 细胞穿透基底膜的能力明显降低,其抑制率达到70%左右,说明Claudin-1 能够明显影响肿瘤的侵袭能力。随后,本研究建立了具有与患者相似转移途径的小鼠体内人结肠癌肝转移模型,并且保留了原细胞系的生物学特征,结果显示,抑制Claudin-1 的表达能阻止SW620 细胞转移的发生,其在表面转移癌结节数远低于SW620-control 组。本研究结果证明,Claudin-1 可以影响肿瘤细胞的侵袭及转移能力,同时,其有利于阐明大肠癌侵袭的分子机制,对临床上预测肿瘤恶性程度、进行靶向治疗的意义重大。
[1] Peto J.Cancer epidemiology in the last century and the next decade[J].Nature,2001,411(6835):390-395.
[2] Furuse M,Fujita K,Hiiragi T,et al.Claudin-1 and -2:novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin[J].J Cell Biol,1998,141(7):1539-1550.
[3] Krämer F,White K,Kubbies M,et al. Genomic organization of claudin-1 and its assessment in hereditary and sporadic breast cance[J].Hum Genet,2000,107(3):249-256.
[4] Tokés AM,Kulka J,Paku S,et al.Claudin-1,-3 and -4 proteins and mRNA expression in benign and malignant breast lesions:a research study[J].Breast Cancer Res,2005,7(2):R296-R305.
[5] Chao YC,Pan SH,Yang SC,et al.Claudin-1 is a metastasis suppressor and correlates with clinical outcome in lung adenocarcinoma[J].Am J Respir Crit Care Med,2009,179(2):123-133.
[6] Lee JW,Lee SJ,Seo J,et al.Increased expressions of claudin-1 and claudin-7 during the progression of cervical neoplasia[J]. Gynecol Oncol,2005,97(1):53-59.
[7] Fritzsche FR,Oelrich B,Johannsen M,et al. Claudin-1 protein expression is a prognostic marker of patient survival in renal cell carcinomas[J].Clin Cancer Res,2008,14(21):7035-7042.
[8] Soini Y,Talvensaari-Mattila A.Expression of claudins 1,4,5 and 7 in ovarian tumors of diverse types[J]. Int J Gynecol Pathol,2006,25(4):330-335.
[9] Billings SD,Walsh SV,Fisher C,et al.Aberrant expression of tight junction-related proteins ZO-1,claudin-1 and occludin in synovial sarcoma: an immunohistochemical study with ultrastructural correlation[J].Mod Pathol,2004,17(2):141-149.
[10] Resnick MB,Gavilanez M,Newton E,et al. Claudin expression in gastric adenocarcinomas:a tissue microarray study with prognostic correlation[J].Hum Pathol,2005,36(8):886-892.
[11] de Oliveira SS,de Oliveira IM,de Souza W,et al. Clandins upregulation in human colorectal cancer[J]. FEBS Lett,2005,579(27):6179-6185
[12] Huo Q,Kinugasa T,Wang L,et al. Claudin-1 protein is a major factor involved in the tumorigenesis of colorectal cancer[J].Anticancer Res,2009,29(3):851-857.

