不同链长有机膦酸阻垢剂对硫酸钡结晶过程的影响
尹晓爽,刘 瑛,杨文忠
(南京工业大学 理学院,江苏 南京 210009)
BaSO4结垢是油田注水开发后期遇到的常见问题,严重影响原油的正常生产,油田阻垢逐渐成为人们关注的焦点。在各种阻垢方法中,加入合适的阻垢剂是最经济有效的方法。常用的阻垢剂主要为有机膦阻垢剂和聚合物阻垢剂[1-3]。对于这2类阻垢剂,人们大多采用静态方法测定实验前后硫酸根和钡离子浓度的变化来判断其优劣[4-6],很少对其抑制机理展开讨论。垢的形成实质为难溶盐晶体析出和生长的过程,因此,添加阻垢剂后BaSO4的析出过程更能反映阻垢剂对BaSO4垢作用的实质。
笔者用电导率法考察添加具有不同链长的2种有机膦阻垢剂后BaSO4的析出过程,通过经典的均相成核理论推算BaSO4结晶的表面自由能,利用Zeta电位反映晶体表面电荷性质,以便为研究阻垢剂的构效关系提供依据。
1 实验部分
1.1 试剂
氯化钡(BaCl2)、硫酸钠(Na2SO4),均为分析纯,国药集团化学试剂有限公司产品;二亚乙基三胺五亚甲基膦酸(DETPMP)、二亚己基三胺五亚甲基膦酸(BHMTPMP),工业级,武进水质稳定剂厂产品。
1.2 BaSO4析晶诱导时间的测定
精 确 称 取 1.5268gBaCl2·2H2O、0.8878gNa2SO4分别溶于250mL蒸馏水中,制成0.025mol/L Ba2+和储备液。在恒温容器中,将一定体积的Ba2+与二者储备液混合,得到硫酸钡过饱和溶液。7组硫酸钡过饱和溶液Ba2+与的初始浓度及过饱和指数SI列于表1。分别测定7组硫酸钡过饱和溶液不加阻垢剂及加入DETPMP或BHMTPMP阻垢剂时,溶液电导率随时间变化曲线。按照第2组过饱和溶液组成,改变恒温水浴温度,分别在288、298、308、318和328K测定该溶液加入和不加阻垢剂时溶液电导率随时间变化曲线。加入阻垢剂的过饱和溶液,阻垢剂的初始摩尔浓度均为0.010mmol/L。
表1 7种BaSO4过饱和溶液Ba2+与的初始摩尔浓度及过饱和指数(SI)(298K)Table 1 Initial Ba2+and molar concentration and supersaturation index(SI)of seven BaSO4 supersaturated solutions at 298K

表1 7种BaSO4过饱和溶液Ba2+与的初始摩尔浓度及过饱和指数(SI)(298K)Table 1 Initial Ba2+and molar concentration and supersaturation index(SI)of seven BaSO4 supersaturated solutions at 298K
Sample cBa2+/(mmol·L-1) cSO2-4 /(mmol·L-1)SI 1 0.250 0.250 2.63 2 0.312 0.312 2.81 3 0.375 0.375 2.96 4 0.437 0.437 3.08 5 0.500 0.500 3.19 6 0.562 0.562 3.28 7 0.625 0.625 3.36
过饱和指数(SI)由式(1)计算。

式(1)中,Ksp为BaSO4的溶度积;和分别为Ba2+和的活度,mol/L;和分别为Ba2+和的摩尔浓度,mol/L;fBa2+和分别为Ba2+和的活度系数,由Debye-Hückel方程求得。
过饱和溶液的诱导时间(tind)被定义为过饱和溶液形成之初至新相产生所经历的时间。通常采用监测过饱和溶液中结晶离子的浓度[7]、溶液的电导率[8]或浊度的变化[9]得到近似真实的诱导时间。
典型的BaSO4过饱和溶液电导率随时间的变化曲线如图1所示。由图1可知,最初溶液的电导率呈现一段平台区,而后电导率逐渐下降,反映BaSO4晶体不断析出的过程。将最初的平台区经历的时间近似地表示为BaSO4过饱和溶液析晶的诱导时间。

图1 典型的BaSO4过饱和溶液电导率(γ)随时间(t)的变化曲线Fig.1 The typical curve for the conductivity(γ)-time(t)of BaSO4supersaturated solution
1.3 BaSO4晶体表面Zeta电位的测定
将第2组BaSO4过饱和溶液用少量HCl和NaOH调节pH值后搅拌30min,采用上海中晨数字技术设备有限公司JS-94G型微电泳仪测定在初始pH=5、6.8、8和10时BaSO4晶体表面Zeta电位。
1.4 BaSO4样品的表征
将测定Zeta电位的BaSO4过饱和溶液在pH=8时生成的结晶产物真空干燥24h后,采用日本电子公司JEOL JSM-5900型扫描电子显微镜观测其微观形貌。
2 结果与讨论
2.1 BaSO4晶体表面自由能的推算
表面自由能是晶体及其过饱和溶液的一个基础参数。通过表面自由能可以了解结晶及晶体生长的速率。对于BaSO4晶体表面自由能的推算,可以根据溶液的过饱和指数与诱导时间的关系曲线得到[10-12]。
根据经典的均相成核理论[7,11],成核速率、晶粒参数及表面自由能有式(2)的关系。

式(2)中,J为成核速率,1/(cm3·s);A为常数,一般为1×1023~1×1033/(cm3·s);β为几何常数(比如球体为16π/3);σ为表面自由能,J/m2;Vm为固体分子摩尔体积,cm3/mol;NA为阿佛加德罗常数,6.02×1023mol-1;R为气体常数,8.314J/(mol·K);T为温度,K。
在均相成核区域内,σ可以通过诱导期与过饱和指数的关系式(3)得出[10,13]。

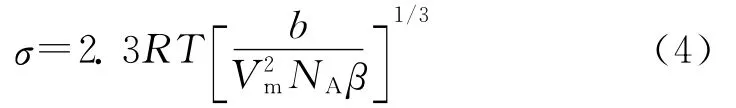
根据式(3),若lgtind-(SI)-2成直线关系,则斜率b的大小将决定表面自由能的大小。几种BaSO4过饱和溶液的lgtind-(SI)-2曲线如图2所示。由图2可知,lgtind与(SI)-2之间呈现良好的线性关系,说明在实验浓度范围内,BaSO4晶体的析出以均相成核为主。每组实验线性回归后的斜率列于表2。由表2和式(4)可知,加入DETPMP和BHMTPMP后,BaSO4析出晶体的表面自由能大大提高。BHMTPMP与DETPMP相比,其抑制作用更明显。
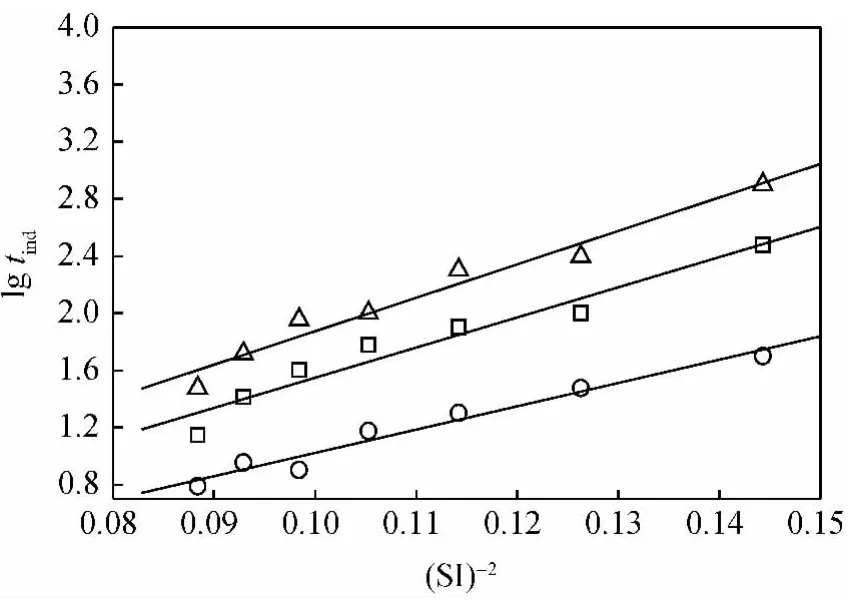
图2 含和不含阻垢剂的BaSO4过饱和溶液的lgtind-(SI)-2曲线Fig.2 lgtind-(SI)-2curves of BaSO4supersaturated solutions with or without scale inhibitor

表2 过饱和溶液中BaSO4晶体的表面自由能(σ)Table 2 Surface free energy(σ)of BaSO4crystalline in supersaturated solution
2.3 温度对BaSO4结晶过程的影响
温度对BaSO4的结晶过程有着重要的影响。随着温度的升高,对同一过饱和度的BaSO4溶液而言,析晶的诱导时间变短。根据晶体成核时有关经验公式(5)[10,14],对lg(1/tind)与1/T作图(见图3),线性回归,相应的不含阻垢剂、添加DETPMP、BHMTPMP的BaSO4过饱和溶液的该曲线斜率分别为3.88、4.86和5.66。加入阻垢剂后的斜率明显比不含阻垢剂溶液的大,由此可知,BaSO4的结晶活化能也随之增大,因此结晶成核的趋势变小,如式(5)所示。
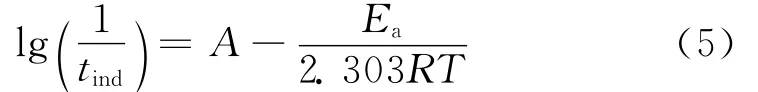
式(5)中,A为常数;Ea为结晶活化能,J/mol。

图3 含和不含阻垢剂BaSO4过饱和溶液lg(1/tind)-T曲线Fig.3 lg(1/tind)-Tcurves of BaSO4supersaturated solutions with or without scale inhibitor
2.4 阻垢剂对BaSO4晶体表面Zeta电位的影响
不同pH值条件下阻垢剂对BaSO4晶体表面电位的影响如图4所示。由图4可知,DETPMP和BHMTPMP的加入均使BaSO4晶体表面Zeta电位绝对值增加,且后者的作用更明显。这是因为两者都是有机膦酸,随着pH值的增加,去质子化能力增强,即有更多的-PO3H2基团转变为-,这些基团强烈地吸附在BaSO4晶体的表面,对晶体的生长起到抑制作用。Gunn等[14]曾讨论过,有机膦阻垢剂在pH=8时,对BaSO4结垢的抑制效果最好,而pH值继续升高,抑制效果反而减弱,此与笔者的实验结果相吻合。pH=8时,BaSO4晶体表面Zeta电位绝对值最高,当pH值继续上升,该绝对值也随之变小,即DETPMP和BHMTPMP在BaSO4表面的吸附作用减弱,这缘于两个方面的原因。一方面,pH值继续升高,质子化程度减弱,BaSO4晶体表面变得更负,阻垢剂与BaSO4晶体之间的吸附作用减弱;另一方面,pH值升高,BaSO4晶体表面继续失去质子,因此与阻垢剂之间通过氢键结合的能力也逐渐减弱。
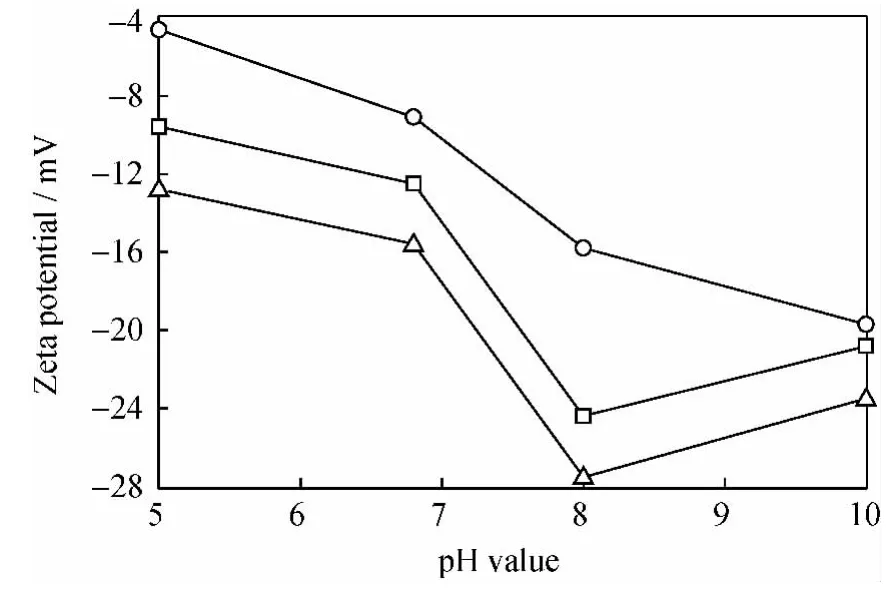
图4 BaSO4晶体表面Zeta电位与pH值的关系Fig.4 The pH value vs Zeta potential on BaSO4nucleation
由上可知,不论是BaSO4结晶自由能还是表面Zeta电位,BHMTPMP的影响均比DETPMP的影响更明显。这2个阻垢剂分子中均含有5个膦酸基团,二者最大的区别在于其分子结构中相邻N原子之间直接连接的亚甲基的个数,前者为6个,后者为2个。可见,使得2种阻垢剂的抑制行为有伯仲差异的根本原因在于连接2组膦酸基团之间的碳链长度不同所引起的空间距离。相邻N原子间距离更远些的BHMTPMP对于BaSO4结晶生长的匹配关系更密切,在BaSO4晶体表面的吸附作用也更有效[15-16]。
2.5 BaSO4晶体的形貌
不同溶液中生成的BaSO4晶体的SEM照片如图5所示。由图5可知,不含阻垢剂的溶液中BaSO4晶体呈片状长方结构,表面光滑;而含有DETPMP和BHMTPMP的溶液中的BaSO4晶体形状明显扭曲,在结晶表面出现明显的台阶生长趋势。这也说明2种有机磷阻垢剂在BaSO4晶体表面的吸附作用破坏了BaSO4晶体正常的生长习性,从而抑制其结晶。
3 结 论
(1)DETPMP与BHMTPMP阻垢剂的加入能有效地提高BaSO4结晶的表面自由能和结晶活化能。
(2)BaSO4晶体表面Zeta电位随着溶液pH值的变化发生明显变化;DETPMP与BHMTPMP通过吸附作用使BaSO4晶体表面Zeta电位在溶液pH=8时达到最大。
(3)DETPMP与BHMTPMP通过吸附作用阻碍了BaSO4晶体正常生长,晶体表面出现明显台阶状生长趋势。

图5 BaSO4晶体的SEM照片Fig.5 SEM images of BaSO4precipitates
[1]BINMERDHAH A B.Inhibition of barium sulfate scale high-barium formation water[J].Journal of Petroleum Science and Engineering,2012,(90-91):124-130.
[2]雷晓娟,谢志海,张旭,等.新型硫酸钡阻垢剂的合成与性能评价[J],化学工程,2011,39(2):76-78.(LEI Xiaojuan,XIE Zhihai,ZHANG Xu,et al.Synthesis and property evaluation of new BaSO4scale inhibitor[J].Chemical Engineering(China),2011,39(2):76-78.)
[3]MAVREDAKI E, NEVILLE A, SORBIE K.Assessment of barium sulphate formation and inhibition at surfaces with synchrotron X-ray diffraction (SXRD)[J]. Applied Surface Science, 2011, 257 (9):4264-4271.
[4]马浴铭,程耀丽,刘玉民,等.新型油田用钡、锶阻垢剂性能研究[J].工业水处理,2008,28(1):27-29.(MA Yuming,CHENG Yaoli,LIU Yumin,et al.Research on the performance of a new type of strontium and barium scale inhibitor for oil fields[J].Industrial Water Treatment,2008,28(1):27-29.)
[5]郑云萍,吴晓南,李蕾,等.油田硫酸钡、锶垢的高效阻垢剂研究[J].腐蚀与防护,2011,32(6):467-469.(ZHENG Yunping,WU Xiaonan,LI Lei,et al.High efficient scale inhibitor for barium/strontium sulfate scale in oilfield[J].Corrosion & Protection,2011,32(6):467-469.)
[6]何亮,乔宁,熊蓉春,等.环氧琥珀酸共聚物的制备及对硫酸钡的阻垢作用[J].北京化工大学学报(自然科学版),2008,35(2):47-49.(HE Liang,QIAO Ning,XIONG Rongchun,et al.Preparation of epoxysuccinic acid copolymer and its performance as an inhibitor of barium sulfate scaling[J].Journal of Beijing University of Chemical Technology(Natural Science Edition),2008,35(2):47-49.)
[7]MULLIN J W.结晶学[M].(第3版)北京:世界图书出版公司北京公司,2000.
[8]尹晓爽,杨文忠,唐永明,等.PBTCA对硫酸钡结晶动力学的影响[J].应用化学,2008,25(3):356-359.(YIN Xiaoshuang, YANG Wenzhong, TANG Yongming,et al.Effect of PBTCA on kinetics of formation of BaSO4crystal[J].Chinese Journal of Applied Chemistry,2008,25(3):356-359.)
[9]BOERLAGE S F E,KEMEDY M D,BREMERE I,et al.Stable barium sulphate supersaturation in reverse osmosis[J].Journal of Membrane Science,2000,179(1-2):53-68.
[10]HE S,ODDOAND J E,TOMSON M B.The nucleation kinetics of barium sulfate in NaCl solutions up to 6m and 90℃ [J].Journal of Colloid Interface Science,1995,174(2):319-326.
[11]NIELSEN A E.Kinetics of Precipitation[M].New York:Pergamon Press,1964.
[12]尹晓爽,杨文忠,唐永明,等.Mg2+、Mn2+与有机抑制剂对CaCO3沉积的协同抑制作用[J].石油学报(石油加工),2010,26(1):132-139.(YIN Xiaoshuang,YANG Wenzhong,TANG Yongming,et al.The synergistic effects in the presence of Mg2+,Mn2+and organic additives on CaCO3inhibition[J].Acta Petrolei Sinica(Petroleum Processing Section),2010,26(1):132-139.)
[13]SOHNEL O, MULLIN J W. Interpretation of crystallization induction periods[J].Journal of Colloid Interface Science,1988,123(1):43-45.
[14]GUNN D J,MURTHY M.S.Kinetics and mechanisms of precipitations[J].Journal Chemical Engineering Science,1972,27(6):1293-1313.
[15]JONES F,STANLEY A,OLIVEIRA,et al.The role of phosphonate speciation on the inhibition of barium sulfate precipitation[J].Journal of Crystal Growth,2003,249(3-4):584-593.
[16]BAROUDA E,DEMADIS K D,FREEMAN S R,et al.Barium sulfate crystallization in the presence of variable chain length aminomethylenetetraphosphonates and cations(Na+or Zn2+)[J].Crystal Growth & Design,2007,7(2):321-327.
——饱和溶液与不饱和溶液

