空心钛硅分子筛在环己烷温和氧化反应中的催化性能
史春风,朱 斌,林 民
(中国石化石油化工科学研究院石油化工催化材料与反应工程国家重点实验室,北京 100083)
环己酮(醇)又称KA油,是重要的有机化工原料,是生产己内酰胺、己二酸和尼龙的主要中间体,还可作为原料生产过氧化环己酮、香豆素等其他物质;同时也是一种优良的中、高沸点有机溶剂,具有极好的溶解性和低挥发性。近年来,随着聚酰胺行业迅速发展,环己酮(醇)作为生产己内酰胺的原料也得到了快速发展,我国环己酮(醇)的生产主要是为了满足己内酰胺生产的需要。现有的环己酮(醇)制备工艺根据所用原料不同,主要有苯酚加氢法、环己烯水合法、苯部分加氢法和环己烷氧化法[1]。其中,环己烷氧化法是主要的制备方法,占环己酮(醇)总生产能力的90%以上。但该方法存在环己烷转化率低、酮醇选择性不高、三废严重等问题。因此,研制新型高效催化剂、开发新工艺以降低生产成本、减少环境污染、实现清洁化生产,成为环己烷氧化工艺研究的重点。特别是近年来,国内、外市场上环己酮的需求量增加,因此其合成新工艺、新技术的研究和开发也一直受到学术界和工业界的重视[2]。
钛硅分子筛(TS-1)是一种具有原子经济特征的新型催化氧化催化剂,可以催化以H2O2为氧化剂的环己烷氧化反应。人们对TS-1/H2O2体系催化氧化环己烷制备环己酮(醇)反应进行了初步的研究,发现该反应条件温和、选择性较好、原子利用率较高,符合当代绿色化学和化工生产绿色化的要求,成为合成环己酮(醇)研究的重点方向之一[3]。中国石化石油化工科学研究院采用具有自主知识产权的用于选择性氧化过程的新型催化材料空心钛硅分子筛(HTS)为催化剂,开展了温和条件下催化环己烷液相氧化制备环己酮(醇)的相关研究[4-5],发现HTS的环己烷氧化性能优于传统的TS-1[5]。笔者在前期工作的基础上,详细考察了不同反应条件对HTS催化剂催化环己烷液相氧化反应性能的影响,并对其影响原因进行了分析,同时给出了HTS在较优反应操作条件下的催化性能。
1 实验部分
1.1 原料和试剂
空心钛硅分子筛 HTS(TiO2质量分数3.6%,颗粒平均粒径250nm左右)来自湖南建长石化股份有限公司;环己烷、双氧水(30%质量分数)、环己醇(A)、环己酮(K)和丙酮,分析纯,购自北京益利精细化学品有限公司。
1.2 HTS对环己烷氧化反应催化性能评价
采用250mL带回流装置的浆态床反应器考察反应时间对环己烷液相温和氧化反应的影响,采用250mL密闭高压不锈钢釜式反应器考察其他条件的影响。依次将一定量的催化剂、环己烷、丙酮、H2O2置于高压不锈钢釜式反应器中,然后将反应器置于升至所需反应温度的水(油)浴中,并开始计时,在自生压力下反应。到达反应时间后,停止加热,降温后打开反应器并取样。样品经离心分离后,采用气相色谱法对液相进行组成分析。未作特殊说明的情况下,基本 的 反 应 条 件:n(Cyclohexane)/n(H2O2)=0.5,催化剂质量分数5%,反应温度70℃,搅拌转速560r/min。在适宜的反应条件下,反应产物只有环己醇和环己酮,其典型气相色谱(GC)图见图1,所以以酮醇产率(y(KA oil))和酮/醇摩尔比(n(K)/n(A))表示催化剂的催化活性和选择性,作为钛硅催化剂的催化性能评价指标。由式(1)计算酮醇产率。
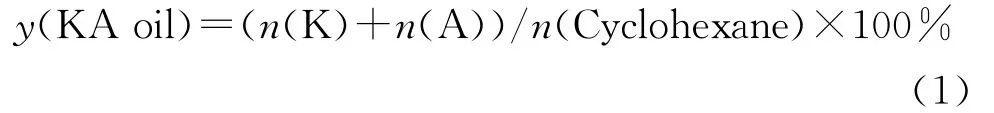
图1 环己烷氧化反应产物的典型气相色谱图Fig.1 Representative gas chromatogram (GC)map of the products from cyclohexane oxidation reaction
2 结果与讨论
2.1 反应时间对HTS催化环己烷氧化反应的影响
不同反应时间对以HTS为催化剂催化环己烷温和氧化反应的影响结果示于图2。由图2可以看出,随着反应时间的延长,环己酮产率逐渐增加,而环己醇产率先增加后减少。据此可以初步推断出环己醇为一中间产物,也进一步证实了HTS/H2O2体系催化氧化环己烷的反应与TS-1/H2O2体系相同为连串反应,即反应中环己烷首先被氧化成环己醇,环己醇再进一步被氧化生成环己酮[3]。在考察的时间范围内,相对较优的反应时间在6~10h范围。在实际生产过程中,可以根据目标产物环己酮(醇)的产率和酮/醇摩尔比等需要来合理选择反应时间。
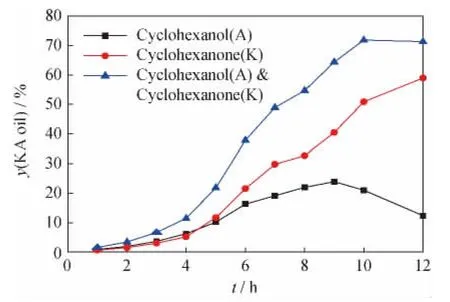
图2 HTS催化环己烷氧化反应产物酮醇产率(y(KA oil))随反应时间(t)的变化Fig.2 y(KA oil)vs t in cyclohexane oxidation reaction over HTS catalyst
2.2 反应温度对HTS催化环己烷氧化反应的影响
考察不同反应温度对HTS催化环己烷液相温和氧化反应的影响,结果示于图3。从图3可以看出,反应温度对HTS/H2O2体系下环己烷液相氧化反应的影响显著。40℃时反应速率较慢,反应2.5h时酮醇产率还不到5%,4h时酮醇产率仍低于10%,产物分布表现为醇多酮少,即此时酮/醇摩尔比较低;而当反应温度升到60℃时,酮醇产率明显增加,酮/醇摩尔比明显提高,表明此时反应速率显著加快;而当反应温度升高至100℃时,酮醇产率和酮/醇摩尔比并未随着温度的增加而持续增加,这是因为此时的氧化反应体系变得更复杂,同时H2O2无效分解加剧,而且环己烷更容易过度氧化,造成酮醇产率和酮/醇摩尔比降低。因此,对本反应体系来说,温度过低,反应速率慢,环己烷转化率低;温度过高,H2O2无效分解增多,H2O2有效利用率降低,副反应加剧,氧化反应体系变得复杂。综合考虑,以HTS为催化剂催化环己烷温和氧化反应中,较为理想的反应温度在60~80℃范围。
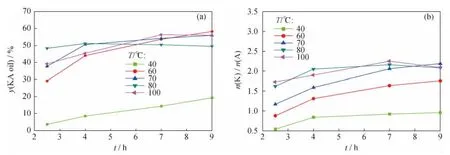
图3 不同反应温度下HTS催化环己烷氧化反应的酮醇产率(y(KA oil))和酮/醇摩尔比(n(K)/n(A))随反应时间(t)的变化Fig.3 y(KA oil)and n(K)/n(A)vs t in cyclohexane oxidation reaction over HTS catalyst at different temperatures
2.3 催化剂用量对HTS催化环己烷氧化反应的影响
催化剂提供催化活性中心,催化剂量加大,则活性中心增多,反应速率加快。因此在反应过程中要保证环己烷温和氧化反应体系内的催化剂HTS达到一定浓度。考察了催化剂用量对环己烷温和氧化反应的影响,结果示于图4。
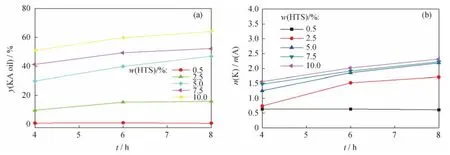
图4 不同 HTS用量下环己烷氧化反应的酮醇产率(y(KA oil))和酮/醇摩尔比(n(K)/n(A))随反应时间(t)的变化Fig.4 y(KA oil)and n(K)/n(A)vs t in cyclohexane oxidation reaction over HTS catalyst of different amounts
从图4(a)可以看出,在相同反应时间内,随着反应体系中催化剂质量分数的增加,酮醇产率有所提高。表明催化剂质量分数越高,提供的反应活性中心就越多,从而使环己烷氧化反应速率加快。在催化剂质量分数较低的反应体系中,如催化剂质量分数为0.5%时,即使经过较长的反应时间也难以检测到目的产物;而催化剂质量分数较高的反应体系中,如5.0%、7.5%和10.0%,酮醇产率较高。这是因为催化剂质量分数较高时对主反应有利,加快了主反应的进行,相对抑制了H2O2无效分解等副反应,H2O2的有效利用效率较高,进而提高了酮醇产率。
从图4(b)可以看出,在一定的范围内催化剂质量分数对反应产物酮/醇摩尔比有较大的影响。反应体系中催化剂质量分数较低时,如0.5%和2.5%,产物酮/醇摩尔比相对较低;而在较高催化剂质量分数时,如5.0%、7.5%和10.0%,产物酮/醇摩尔比相对较高。由此可见,在一定范围内较高的催化剂质量分数对提高H2O2的有效利用率有利。由于环己烷氧化反应是个连串反应,因此随着反应时间延长,环己烷转化率的提高,产物酮/醇摩尔比呈提高趋势。从图4(b)还可以看出,当反应时间为6和8h时,7.5%和10.0%催化剂所得产物酮/醇摩尔比与5.0%催化剂时的相近,说明只要催化剂达到一定质量分数,如5.0%,反应就能够顺利进行。催化剂的用量以催化剂质量分数在5%~10%范围为宜。
2.4 n(Cyclohexane)/n(H2O2)对 HTS催化环己烷氧化反应的影响
对于TS-1催化的各类以H2O2为氧化剂的氧化反应,相对于化学反应计量式所需的物料配比,在实际反应中多采用有机反应底物过量(H2O2少量)的方式投料,以提高H2O2的有效利用率,节约生产成本。但如果H2O2含量过少,反应速率慢,则转化率低,不利于实际生产。考察了n(Cyclohexane)/n(H2O2)对 HTS催化氧化环己烷氧化反应的影响,结果示于图5。
从图5(a)可以看出,H2O2相对过量时,即n(Cyclohexane)/n(H2O2)=0.25,酮 醇 产 率 在2.5h时即达到最大。这是因为体系内H2O2量多环己烷量少,随着反应的进行,环己烷浓度进一步降低,而产物环己酮(醇)浓度持续增加,且体系内剩余较多量的H2O2,因此容易发生环己酮过度氧化等副反应,从而造成酮醇产率随着反应的继续未持续增加而是有所降低。而当n(Cyclohexane)/n(H2O2)≥0.5,即体系内环己烷相对过量时,随着环己烷量的增加,酮醇产率逐渐降低,这是因为体系内H2O2浓度较低,反应速率较慢,从而造成酮醇产率不高。n(Cyclohexane)/n(H2O2)=0.5时,酮醇产率在6h相对较高。
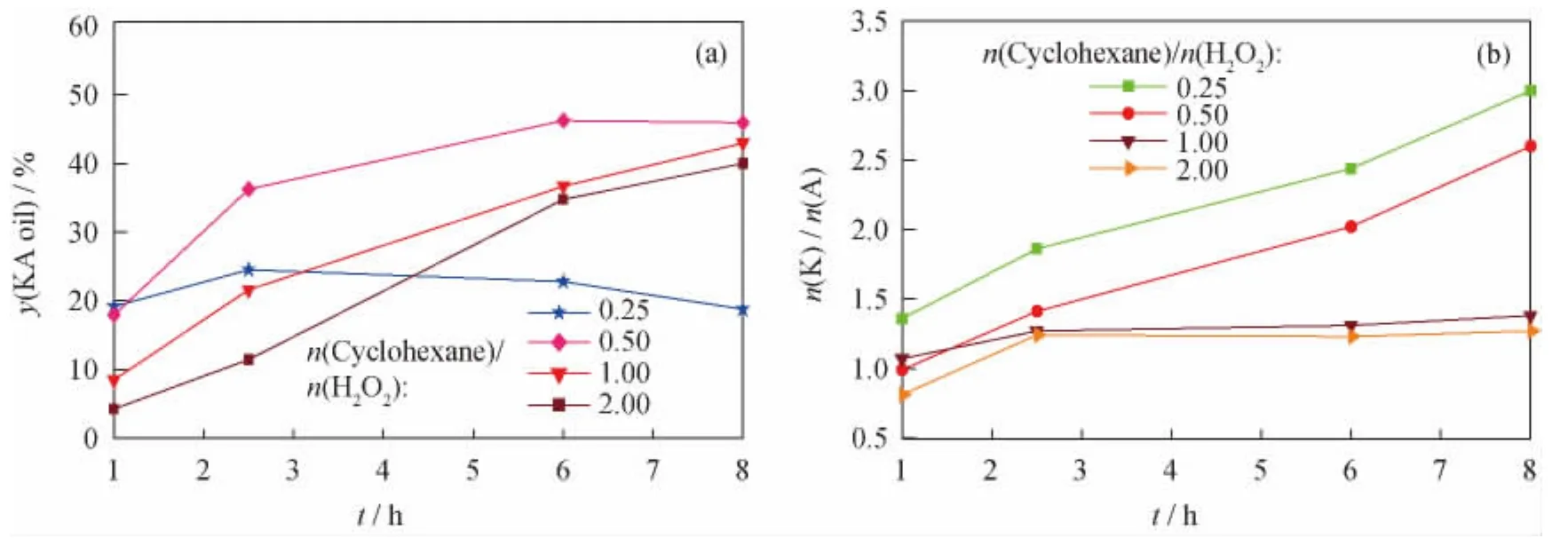
图5 不同n(Cyclohexane)/n(H2O2)下 HTS催化环己烷氧化反应的酮醇产率(y(KA oil))和酮/醇摩尔比(n(K)/n(A))随反应时间(t)的变化Fig.5 y(KA oil)and n(K)/n(A)vs t in cyclohexane oxidation reaction over HTS catalyst at different n(Cyclohexane)/n(H2O2)
从图5(b)可以看出,H2O2过量,即n(Cyclohexane)/n(H2O2)=0.25时,产物酮/醇摩尔比较高,因为此时体系内环己烷的量较少,而H2O2的量较多,使得环己醇氧化生成环己酮的反应容易进行;随着体系内环己烷量的增加,n(Cyclohexane)/n(H2O2)为0.5、1、2时,产物酮/醇摩尔比逐渐降低,以n(Cyclohexane)/n(H2O2)=0.5 时 相 对较高。
2.5 溶剂量对HTS催化环己烷氧化反应的影响
溶剂在HTS催化环己烷氧化反应中发挥重要的作用[4,7]。对比多种溶剂发现,以丙酮为溶剂时在HTS催化环己烷氧化反应的效果较好。考察了不同 丙 酮 用 量 (n(Acetone)/n(Cyclohexane))对HTS催化环己烷氧化反应的影响,结果示于图6。
从图6(a)可以看出,对于HTS催化环己烷氧化反应,随着溶剂用量的减少,同一反应时间中酮醇产率呈增加的趋势。这是因为溶剂量减少,反应物浓度增加,反应物分子与催化剂发生有效碰撞的次数增加,反应速率加快,因此能较快达到较高的酮醇产率。但是溶剂量减少到一定程度时,使得反应体系液相分层呈非均相,不利于反应的进行,n(Acetone)/n(Cyclohexane)=7时即属于这种情况。图6(a)显示,当n(Acetone)/n(Cyclohexane)=7时,酮醇产率最高,但经分析发现,此时体系液相分层,由于实验条件的限制,测得的结果主要为水相部分的反应结果,未考虑油相中环己烷的含量,从而导致测得的酮醇产率偏高。在实际反应过程中,发生分层时存在水相和油相的界面,不利于催化剂HTS与反应物分子发生有效碰撞,可导致反应速率下降,从而酮醇产率降低。因此为了获得较高的酮醇产率,可以适当地减少溶剂用量,但需保证体系液相呈均相状态。
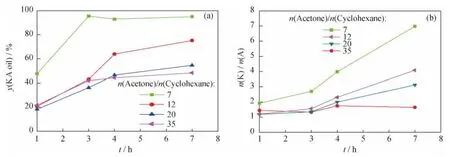
图6 不同n(Acetone)/n(Cyclohexane)下HTS催化环己烷氧化反应的酮醇产率(y(KA oil))和酮醇摩尔比(n(K)/n(A))随反应时间(t)的变化Fig.6 y(KA oil)and n(K)/n(A)vs t in cyclohexane oxidation reaction over HTS catalyst at different n(Acetone)/n(Cyclohexane)
从图6(b)可以看出,在反应时间少于4h时,溶剂用量的改变对酮/醇摩尔比也存在一定影响,但并未导致目标产物选择性的大幅改变。因为溶剂量的变化主要是改变了体系内各物质的浓度,进而影响反应速率,并未对反应体系本身产生如反应路径改变等实质性的影响。但当反应时间达到7h时,溶剂用量的改变对酮/醇摩尔比的影响较大。这是因为随着体系中环己醇生成量的变化,溶剂用量的增加对环己醇进一步氧化为环己酮的反应影响更大,n(Acetone)/n(Cyclohexane)=7时的酮/醇摩尔比数据也为水相的结果。综合酮醇产率和酮/醇摩尔比,在考察范围内,当n(Acetone)/n(Cyclohexane)=12时,HTS催化环己烷氧化反应的效果较好。
3 结 论
在空心钛硅分子筛HTS催化环己烷氧化反应中,反应时间、反应温度以及物料配比等均影响反应的酮醇产率和产物酮/醇摩尔比。较优化的反应条件为:反应温度60~80℃,催化剂质量分数5%~10%,n(Cyclohexane)/n(H2O2)=0.5,n(Acetone)/n(Cyclohexane)=12,反应时间6~10h。在此条件下,酮醇产率和产物酮/醇摩尔比分别可超过40%和2.0。
[1]SURESH A K,SHARMA M M, SRIDHAR T.Engineering aspects of industrial liquid-phase air oxidation of hydrocarbons[J].Ind Eng Chem Res,2000,39(11):3958-3997.
[2]张宝吉.钛硅沸石(TS-1)的合成、有机碱处理、挤条成型及其催化氧化环己烷的研究[D].北京:石油化工科学研究院,1998.
[3]KHOUW B,DART T C B,L ABINGER J A ,et al.Studies on the catalytic oxidation of alkanes and alkenes by titanium silicates[J].J Catal,1994,149:195-205.
[4]林民,刘郁东,朱斌,等.一种催化氧化环己烷的方法:CN,102079695A[P].2011.
[5]林民,邹飞艳,史春风,等.一种环己烷氧化的方法:CN,102206147A[P].2011.
[6]SHI Chunfeng,ZHU Bin,LIN Min,et al.Cyclohexane mild oxidation catalyzed by new titanosilicate with hollow structure[J].Catalysis Today,2011,175(1):398-403.
[7]杨丹红,赵文军,高林.环己烷氧化反应中的溶剂效应[J]. 石 油 化 工,2008,37(2):136-139. (YANG Danhong,ZHAO Wenjun,GAO Lin.Effect of solvent on cyclohexane oxidation [J]. Petrochemical Technology,2008,37(2):136-139.)

