益生菌肠内营养治疗重症急性胰腺炎临床效果分析
董文舒,范 旻,姚俊英,陶应龙(. 新疆医科大学公共卫生学院营养与食品卫生学教研室,新疆乌鲁木齐830000;. 新疆维吾尔自治区人民医院临床营养研究所,新疆乌鲁木齐830000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是常见的临床急腹症之一,起病急、病程进展快,常引发胰腺组织细菌感染、全身炎症反应综合征及多器官功能障碍综合征等,导致患者高病死率,严重威胁生命[1]。随着临床营养概念的提出及发展应用,SAP患者的治疗方式发生了很大变化,营养支持模块的加入使其治疗效果取得了较大程度的改善[2]。特别是微生态营养理念的提出,让人们对肠内营养(enteral nutrition)治疗作用充满期待。很多研究结果显示, 在传统的肠内营养支持基础上添加益生菌制剂,对于补充肠道正常菌群,纠正肠道微生态失衡,维持肠黏膜通透性,减少细菌易位及细菌内毒素释放和扩散具有很好的作用[3-5]。本研究将肠内微生态营养应用于SAP 患者,比较添加益生菌肠内营养支持和常规肠内营养支持模式的治疗效果,以观察肠内微生态营养对SAP 患者肠黏膜损伤治疗和调节菌群紊乱的作用, 现报道如下。
1 资料与方法
1.1 一般资料 选择2012 年5 月至2013 年7 月入住新疆维吾尔自治区人民医院胰腺外科、符合中华医学会消化病学分会制定的《重症急性胰腺炎诊治指南》[6]诊断标准的SAP 患者104 例。患者通过会诊确认符合营养支持条件、接受营养治疗,并将其分为常规肠内营养治疗组(对照组)和益生菌肠内营养治疗组(观察组)各52 例。本研究相关材料经医院伦理委员会审核并通过,且所有入组患者均知情同意。两组患者性别、年龄、病因等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
1.2 营养治疗方法 两组患者均予以监护、禁食、胃肠道减压、静脉滴注补足血容量,维持水、电解质和酸碱平衡,抗感染,抑酸,抑制胰酶活性等急性胰腺炎常规基础治疗。经营养科会诊确定治疗方案,待患者全身情况稳定、胃肠蠕动恢复,逐渐过渡到肠内营养治疗。首先经鼻-空肠营养管缓慢滴注温生理盐水(37~38 ℃)500 mL,以适应肠道及其功能恢复,然后由低浓度(1/3~1/2 浓度)、慢滴速(20~30 mL/h)开始使用肠内营养制剂,并逐渐增加至正常浓度并以快滴速(70~100 mL/h)匀速滴注,过渡到每天所需的能量,同时逐渐减少肠外营养用量直至停用。

表1 两组一般资料比较
1.2.1 对照组 使用短肽型肠内营养剂百普素[每袋125 g,提供能量500 kcal(1 kcal=4.184 kJ)],肠内营养开始第1~2 天予以百普素40~60 g/d,后逐渐增加至250 g/d,热量和氮不足部分由肠外营养补充。
1.2.2 观察组 在常规肠内营养治疗基础上添加益生菌制剂,即给予院内四联益生菌制剂(双歧杆菌、嗜酸乳杆菌、保加利亚乳杆菌、嗜热链球菌,活菌数1×109/100 g)800 g/d,每天分3 次、按新疆地区日常饮食规律给予,时间分别定为北京时间10:00、15:00、20:00。1.3 观察指标 观察两组患者住院时间、腹痛消失时间及感染发生情况。治疗开始及治疗7 d 后取患者粪便送检验科行细菌培养(肠杆菌、肠球菌、双歧杆菌、乳杆菌、类杆菌),按平板活菌计数法计数,并对细菌进行鉴定。
1.4 统计学处理 应用SPSS 17.0 统计软件进行数据处理,计量资料以±s表示,组间比较采用t 检验;计数资料以率表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 两组腹痛消失时间、住院时间、感染情况比较 观察组患者住院时间、腹痛消失时间及感染发生率均低于对照组,差异有统计学意义(P<0.05),见表2。
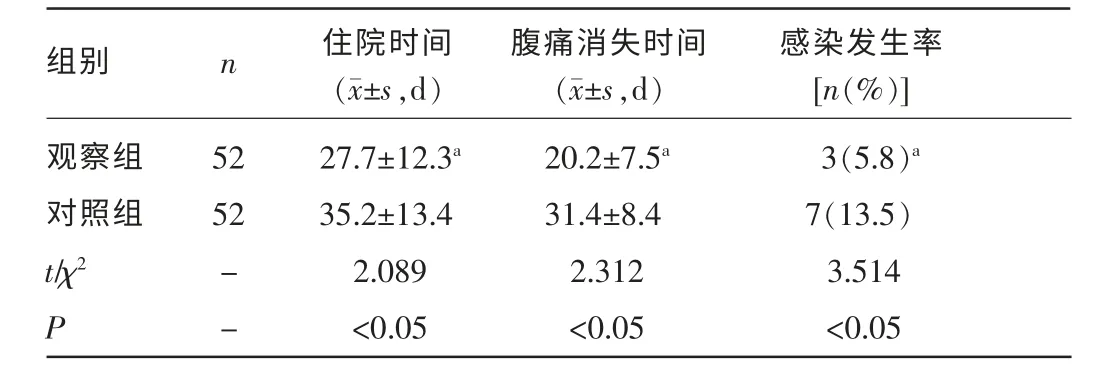
表2 两组腹痛消失时间、住院时间、感染发生情况比较
2.2 两组治疗前后肠道内定植菌群变化情况比较 观察组患者治疗后肠双歧杆菌、乳杆菌有益菌总数明显增加,而肠杆菌总数明显减少,差异均有统计学意义(P<0.05),肠道内菌群接近正常比例。对照组仍存在一定程度菌群紊乱。观察组治疗后肠杆菌、乳杆菌、双歧杆菌与对照组比较,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后肠道内定植菌群变化情况比较[ln(±s)]
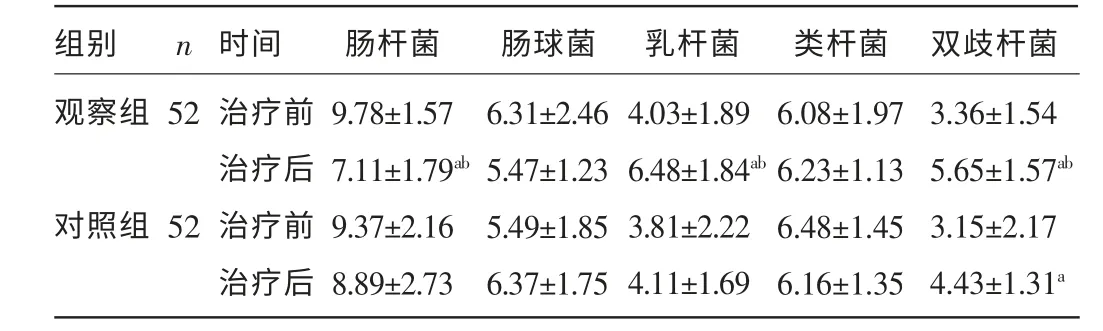
表3 两组治疗前后肠道内定植菌群变化情况比较[ln(±s)]
注:与同组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05。
组别观察组肠杆菌 肠球菌 乳杆菌类杆菌 双歧杆菌52对照组52 n 时间治疗前治疗后治疗前治疗后9.78±1.57 7.11±1.79ab 9.37±2.16 8.89±2.73 6.31±2.46 5.47±1.23 5.49±1.85 6.37±1.75 4.03±1.89 6.48±1.84ab 3.81±2.22 4.11±1.69 6.08±1.97 6.23±1.13 6.48±1.45 6.16±1.35 3.36±1.54 5.65±1.57ab 3.15±2.17 4.43±1.31a
3 讨 论
SAP 的传统治疗方式要求长期禁食或行全胃肠外营养,以使胰腺得到充分的休息。肠黏膜因缺少来自肠道内的营养物质而出现肠绒毛萎缩,肠黏膜细胞减少、细胞内蛋白质及DNA 含量减少等肠黏膜屏障功能障碍[7]。SAP 患者时常发生肠蠕动减弱、肠麻痹等肠运动障碍,导致肠腔内细菌过度繁殖、细菌毒素大量产生,对肠黏膜屏障造成损害,为细菌易位创造条件[8]。此外,常规治疗过程中长期、大量应用广谱抗生素导致肠道菌群定植能力降低,同时耐药菌株产生,而有益厌氧菌群被破坏,表现为大肠杆菌(革兰阴性需氧菌)过度生长,而双歧杆菌和乳杆菌数量有所下降,即双歧杆菌与肠杆菌科细菌的数量比值(B/E 值)下降[9-10]。
继1998 年“生态免疫营养”概念被Bengmark[11]提出后,这种利用有益菌群改善肠道内微生态环境的新型微生态学疗法被逐渐应用于各种原因引起的菌群失调的改善治疗中,并开始引起国内外学者的广泛关注。随着微生态学理论体系的发展与完善,其在临床上的应用范围也在不断延伸扩展,患者及医务工作者对于维持肠道内菌群生态平衡状态的重要性开始有了越来越深刻的认识。目前,作为一种新的治疗方法,利用微生态制剂治疗多种感染性疾病被应用于临床治疗中,其中微生态活菌制剂开始受到临床医学界越来越多的关注[12]。人体肠道中有大约1 000 g 的微生物与机体的不同发育阶段形成了一种动态的生理组合,称之为微生态平衡系统,发挥着多种重要的生理功能,与宿主机体的健康息息相关。微生态活菌制剂补充以双歧杆菌为代表的专性厌氧菌为机制,达到增加肠道内正常微生物的数量及平衡正常微生物构成比,使患者肠道内环境恢复至平衡的生理状态,从而发挥调节肠黏膜正常屏障功能、调节肠黏膜免疫应答反应、抑制肠道致病菌在肠上皮细胞的黏附功能。
综上所述,调节菌群紊乱已成为SAP 治疗过程中不可或缺的重要措施,目前采用改变肠道菌群构成的微生态疗法已成为临床治疗消化道感染的手段之一。本研究结果显示,观察组肠道内两大益生菌——双歧杆菌和乳杆菌的总数明显增加,同时肠杆菌的总数明显减少,肠道菌群结构接近正常比例;患者住院时间、腹痛消失时间明显缩短,感染发生率下降。本研究结果与国内外相关文献报道相近,提示肠内营养支持联合益生菌制剂对SAP 具有辅助治疗作用,能减少SAP 患者的并发症,改善预后,具有广阔的应用前景。
[1] McClave SA,Chang WK,Dhaliwal R,et al.Nutrition support in acute pancreatitis:a systematic review of the literature[J].JPEN J Parenter Enteral Nutr,2006,30(2):143-156.
[2] 白黎智,康利民,路小光,等. 肠内免疫微生态营养对重症急性胰腺炎肝损害的影响[J]. 世界华人消化杂志,2010,18(6):616-620.
[3] 陈磊,邹晓平,田觅,等. 肠内免疫微生态营养对急性坏死性胰腺炎全身炎症反应影响的研究[J]. 中华胰腺病杂志,2008,8(2):115-118.
[4] 龙彦. 肠内、外营养支持治疗重症急性胰腺炎[J]. 中国医药导报,2012,9(3):71-72.
[5] 汪志明,李宁. 肠道微生态与营养支持[J]. 中国实用外科杂志,2012,32(2):167-169.
[6] 中华医学会消化病学会胰腺疾病学组. 中国急性胰腺炎诊治指南(草案)[J]. 中华消化杂志,2004,24(3):190-192.
[7] Besselink MG,van Santvoort HC,Renooij W,et al. Intestinal barrier dysfunction in a randomized trial of a specific probiotic composition in acute pancreatitis[J]. Ann Surg,2009,250(5):712-719.
[8] 钟凯.肠屏障功能早期保护对重症急性胰腺炎治疗的影响[J].临床合理用药,2012,5(23):7-9.
[9] 吴力克,梁冰,许自明,等. 水面和水下长航对艇员肠道菌群影响的比较及意义探讨[J]. 中国微生态学杂志,2001,13(2):75-77.
[8] 伦永志,黄敏,袁杰利,等. 灭活双歧杆菌调整小鼠抗生素相关性菌群失调[J]. 中国微生态学杂志,2002,14(1):8-9.
[10] 张华,黄海涛. 双歧杆菌预防重症胰腺炎患者肠道菌群失调的临床研究[J]. 中国微生态学杂志,2012,24(4):339-340.
[11] Bengmark S. Ecological control of the gastrointestinal tract. The role of probiotic flora[J].Gut,1998,42(1):2-7.
[12] 成正祥,马淑霞,郭健壮,等. 微生态失调与感染[J]. 中国微生态学杂志,2011,23(4):370-374.

