产褐藻胶裂解酶菌株Cobetia sp.WG-007的筛选及发酵优化
刘旭梅, 李 恒, 蒋 敏, 龚劲松, 许正宏, 史劲松
(江南大学 药学院,江苏 无锡 214122)
近年来,随着海洋生物功能性食品开发、海洋药物研制等领域的发展,褐藻胶裂解酶的研究引起了研究者的重视和关注。褐藻胶裂解酶具有广泛的生物来源,可从多种海洋微生物、土壤微生物、噬菌体、病毒、海洋软体动物和海藻中分离得到,其中以海洋微生物的来源为主[1]。在目前已报道的多种褐藻胶裂解酶中,主要来源于弧菌(Vibrio)[2],假单胞菌(Pseudomonas aeruginosa)[3],固氮菌(Azotobacter vinelandii)[4]、 交 替 假 单 胞 菌 (Pseudoaltermonas elyakovii)[5]及交替单胞菌(Alteromonas)[6]等。 海藻酸钠又名褐藻酸钠、褐藻胶,是一种由L-古罗糖醛酸和其C5差向异构体D-甘露糖醛酸结合而成的线性高分子多糖。褐藻胶裂解酶通过β-消去机制催化褐藻胶降解产生具有多种生物活性的褐藻寡糖[7]。由于褐藻胶裂解酶具有专一性、反应效率高、反应温和及可控性强等优点,被认为是定向制备褐藻寡糖的有力工具。因此,不断寻找开发新的高效褐藻胶裂解酶,并用于实现海藻胶高值应用,是现阶段的主要研究趋势和热点。
据报道,大部分褐藻胶裂解酶是一种可诱导性酶,通过改变其培养基成分及培养条件可以提高微生物的产酶量。本研究以褐藻酸钠作为唯一碳源,从腐烂的海带中筛选到一株高产褐藻胶裂解酶的菌株,通过形态学和系统发育分析对其鉴定,并采用单因素和正交试验方法对产酶条件优化,为褐藻胶裂解酶的工业化应用提供了依据。
1 材料与方法
1.1 材料与仪器
1.1.1 样品来源 腐烂的海带,来源于连云港中大海藻工业有限公司,置于低温保存。
1.1.2 培养基
1)富集和初筛培养基 (g/L):褐藻酸钠 5.0,MgSO4·7H2O 1.0,K2HPO41.0,(NH4)2SO45,琼脂 18,NaCl 30;pH 7.0。
2)种子培养基(g/L):蛋白胨 5.0,酵母粉 1.0,褐藻酸钠 5.0,NaCl 30;pH 7.0。
1.1.3 主要试剂及仪器 PCR产物回收试剂盒、细菌基因组提取试剂盒,购自上海捷瑞生物工程有限公司;实验中用于扩增及克隆所用试剂,均购自Takara公司;蛋白胨,购自上海生工公司;其他试剂均购自国药试剂公司。
PCR扩增仪,Bio-Rad公司制造;UV-2100型分光光度计,上海尤尼科仪器有限公司制造;核酸电泳系统,COSMO BIO Co-LTD制造;精密pH计,上海Mettler-Toledo制造。
1.2 实验方法
1.2.1 菌株的筛选 将样品涂布到以褐藻酸钠为唯一碳源的固体平板培养基上,30℃恒温培养48 h后,观察菌落形态,选取生长良好且具有透明水解圈的菌株,接种到筛选液体培养基中,30℃,180 r/min培养,测定发酵上清液中的酶活力。
1.2.2 细菌的形态结构观察 固体平板培养基上观察菌落形态,经质量分数2%乙酸固定脱盐后采用革兰氏染色,在光学显微镜下观察菌体形态。
1.2.3 16S rDNA的克隆与序列分析 菌株WG-007基因组采用细菌基因组试剂盒进行提取,质粒提取采用碱裂解法,参照文献进行感受态制备、连接、转化等[8]。以WG-007菌株基因组DNA为模板,利用通用引物 (5'-ATTCCGGTTGATCCTGC-3’;5-AGGAGGTGATCCAGCCGCAG-3’)扩增 16S rDNA,PCR 条件为:94℃变性 45 s,56℃退火 45 s,72℃延伸 90 s,30个循环,72℃延伸 10 min[9],扩增产物通过质量分数1.0%琼脂糖凝胶电泳检测。PCR产物连接pMD19-T载体,转化 Escherichia coli JM109。将克隆后的样品进行测序,测序结果在GenBank中进行BLAST序列比对以确定种属。遵循邻接法和最大相似法原则,应用 CLUSTAL、MEGA5.0等软件进行聚类与同源性分析,构建系统发育树[10]。
1.2.4 生理生化试验 将菌株WG-007涂布于初筛培养基平板上,30℃培养24 h,观察细胞形态和菌落特征。部分生理生化试验鉴定参照《常用细菌鉴定手册》[11]。
1.3 褐藻胶裂解酶活力的测定方法
取一定体积的发酵液在4℃,8 000 r/min条件下离心20 min,取上清液测定酶活力。一定体积的发酵上清液与1 mL质量分数1%褐藻酸钠溶液(0.05 mol/L、pH 7.0 的 Na2HPO4-NaH2PO4缓冲液配制)混合,45℃反应15 min后,迅速加入1 mL DNS溶液于沸水浴3 min后迅速冷却,然后定容到10 mL,用紫外分光光度计于520 nm下测定吸光值。
1个酶活力单位(U)定义为:1 mL酶液在上述条件下反应,每分钟产生1 μg还原糖所需要的酶量[12]。
1.4 菌株的发酵优化
除非特别说明,以筛选液体培养基作为出发培养基,优化结果用于后续试验。顺序开展碳源的选择及最佳浓度、氮源的选择及最佳浓度、NaCl及无机盐的浓度等研究。在单因素实验的基础上选取褐藻酸钠、蛋白胨、NaCl和K2HPO4进行四因素三水平正交试验,确定最佳培养基组成。在最佳培养基组成下,分别对培养基的pH、转速、培养温度、装液量、接种量进行优化,检测不同培养条件对菌株产酶能力的影响。
2 结果与讨论
2.1 分泌褐藻胶裂解酶菌株的筛选
通过初筛培养,筛选出8株能在以褐藻酸钠为唯一碳源的平板上生长且形成透明水解圈的菌株,通过发酵培养,取上清液测定酶活,不同菌株酶活力的比较结果见图1。编号为07的菌株发酵液酶活力最高,并且经5代遗传稳定性培养其产酶稳定,将此菌株命名为WG-007,并作为后续试验的研究对象。

图1 不同菌株的褐藻胶裂解酶活性Fig.1 Alginate lyase activity of different strains
2.2 菌株WG-007的鉴定
2.2.1 生理生化及形态学鉴定 菌株WG-007在初筛平板上培养24 h后菌落呈现圆形,直径约为2~3 mm,表面光滑,湿润,边缘整齐,稍有隆起,颜色为米黄色,无孢子形成。镜检结果见图 2(a)(1 000×),菌落形态见图 2(b)。
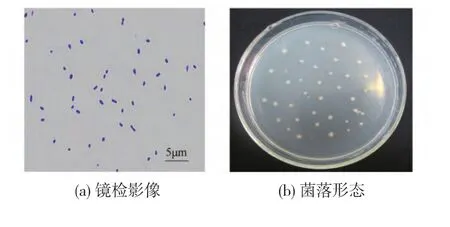
图2 菌株WG-007形态学特征Fig.2 Morphological characterization of strain WG-007
菌株 WG-007可在 20~45℃,pH 5.5~10.0的条件下生长,最适温度为25℃,最适pH为8.5。最高能够耐受30 g/dL的NaCl溶液,在7.0 g/dL的NaCl溶液中生长最旺盛。其余生理生化特性如表1所示。

表1 菌株Cobetia sp.WG-007的生理生化特征Table 1 Physiological and biochemical characteristics of strain Cobetia sp.WG-007
2.2.2 分子生物学鉴定 菌株WG-007的16S rDNA基因序列 1 507 bp (GenBank登录号:KF545599)。经比对,发现其16S rDNA序列与Cobetia属的多种菌株的相似性为99%。系统发育树见图3。同时结合菌株的形态学特征和生理生化特征,将其鉴定为Cobetia属,并命名为Cobetia sp.WG-007。

图3 菌株WG-007的16S rDNA比对分析Fig.3 16S rDNA Blast analysis of strain WG-007
2.3 培养基组成的优化
2.3.1 碳源和氮源对产酶的影响 将葡萄糖、果糖、麦芽糖、蔗糖、褐藻酸钠、淀粉等分别作为菌株Cobetia sp.WG-007生长的唯一碳源,研究不同碳源对菌株WG-007产酶的影响。结果表明,只有以褐藻酸钠为唯一碳源时,才能在发酵液中检测到酶活性,表明菌株WG-007所产的褐藻胶裂解酶属于诱导酶。在此基础上,进一步研究了不同质量浓度的褐藻酸钠对菌株WG-007产酶的影响。如图4所示,随着褐藻酸钠质量浓度的增加,菌株的产酶量也在增加,但是当质量浓度超过6 g/L时,菌株的产酶量反而逐渐下降,这可能是由于高浓度的褐藻酸钠产生了一定的阻遏作用而影响了酶的生成。因此褐藻酸钠适宜质量浓度为6 g/L。
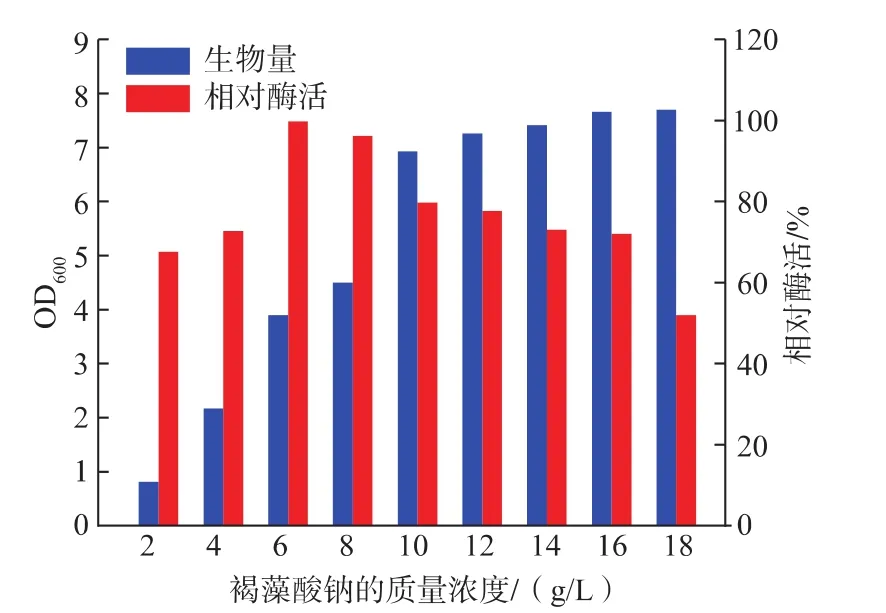
图4 褐藻酸钠质量浓度对Cobetia sp.WG-007生长及酶活性的影响Fig.4 Effect of sodium alginate concentration on growth and enzyme activity from Cobetia sp.WG-007
进一步考察了WG-007在不同无机和有机氮源中的生长和产酶情况,发现在无机氮源(硫酸铵、氯化铵、草酸铵)中菌株生长缓慢且酶活性极低,而在有机氮源(包括蛋白胨、牛肉膏、酵母粉等)中能检测出一定酶活。其中以蛋白胨为氮源时,发酵液中酶活性较高。不同质量浓度的蛋白胨对菌株的生长及产酶结果见图5,当蛋白胨质量浓度为4.0 g/L时,酶活达到最高。质量浓度过大同样会影响褐藻胶裂解酶的积累。

图5 蛋白胨质量浓度对Cobetia sp.WG-007生长及产酶的影响Fig.5 Effect of peptone concentration on growth and enzyme activity from Cobetia sp.WG-007
2.3.2 NaCl及金属离子对产酶的影响 不同质量浓度的NaCl对菌株WG-007的生长和产酶均有明显的影响,这与菌株来源于海洋环境有关。该菌株在低质量浓度的NaCl环境下生长缓慢,产酶能力低,在一定范围内,随着NaCl质量浓度的增加酶活力增加,当NaCl质量浓度为25 g/L时,菌株产酶能力最强,结果见图6。实验中还研究了不同种类的金属离子对菌株 WG-007的生长和产酶的影响 (见表2)。结果显示,只有K+表现为明显的促进作用,其余几种金属离子均表现出不同程度的抑制。通过对K2HPO4质量浓度的优化,表明质量浓度在0.25 g/L时,该菌株产酶能力最好,结果见图7。
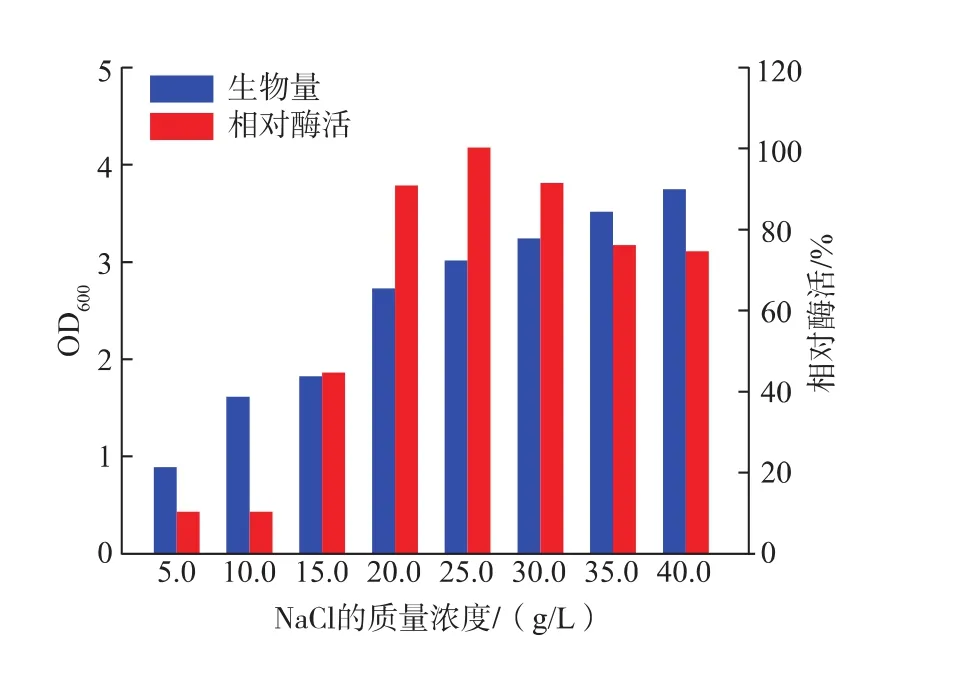
图6 NaCl质量浓度对Cobetia sp.WG-007生长及产酶的影响Fig.6 Effect of NaCl concentration on growth and enzyme activity from Cobetia sp.WG-007

表2 不同金属离子对酶的作用Table 2 Effects of different metal ions on alginate lyase
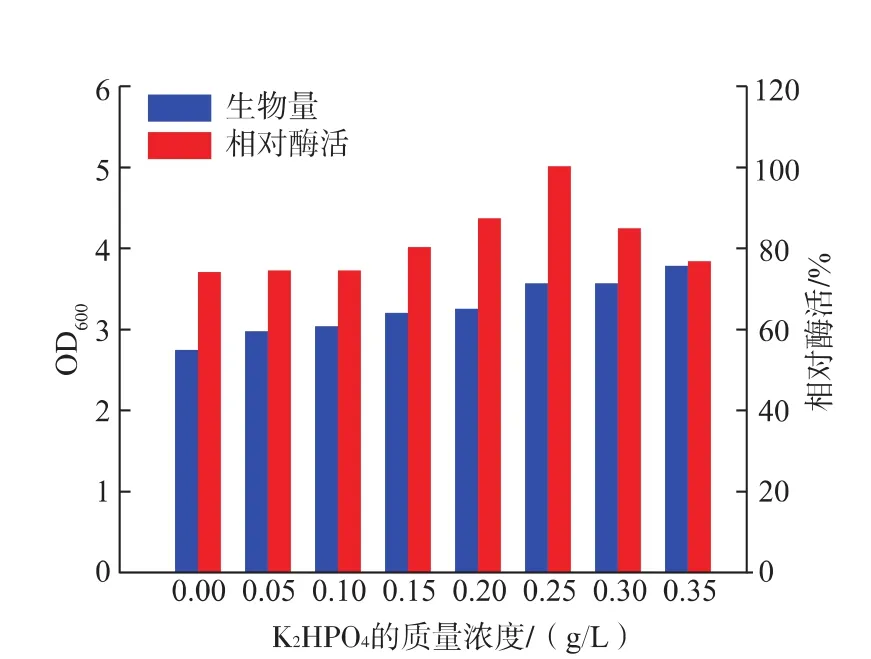
图7 K2HPO4的质量浓度对Cobetia sp.WG-007生长及产酶的影响Fig.7 Effect of K2HPO4concentration on growth and enzyme activity from Cobetia sp.WG-007
2.3.3 正交试验结果 利用正交试验综合考察碳源、氮源等不同因素与水平对产酶的交互影响。单因素试验已确定出对该菌株产酶影响较为突出的因素有褐藻酸钠、蛋白胨、NaCl及K2HPO4质量浓度,因此选择进行四因素三水平的正交试验,设计见表3。
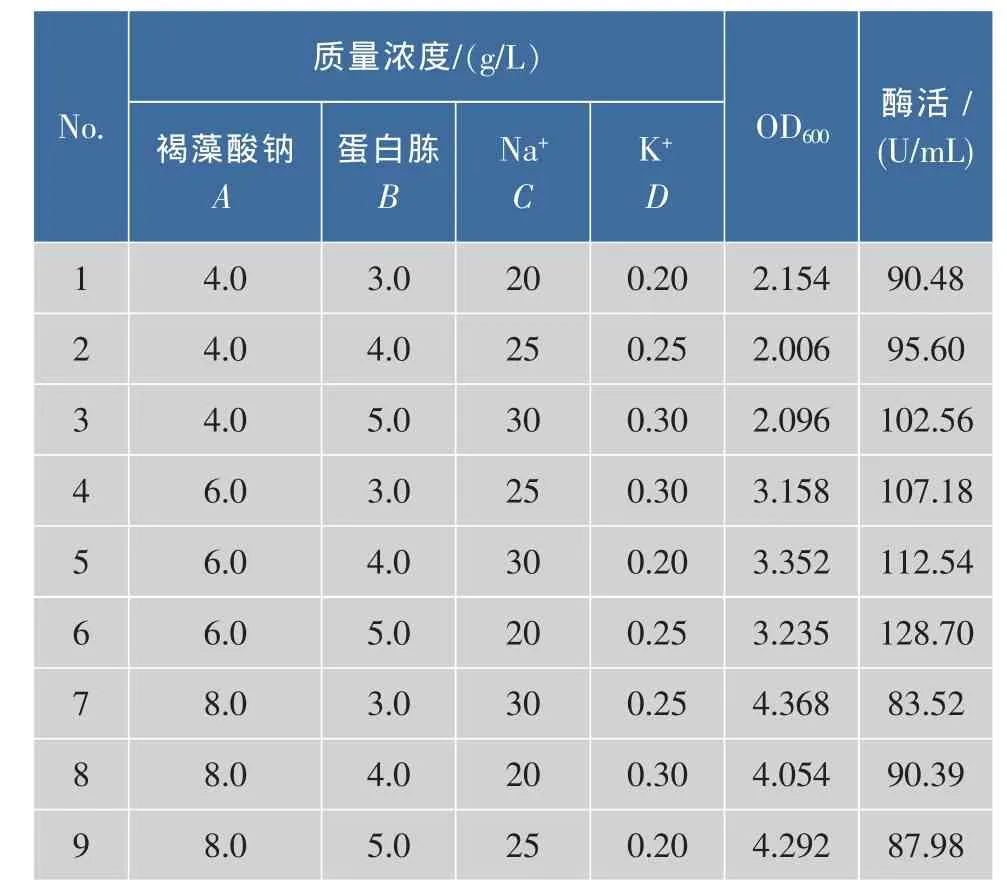
表 3 发酵优化 L9(34)正交表Table 3 Fermentation optimization orthogonal L9(34)
结果显示,进行的9组试验中,第6组试验(褐藻酸钠 6.0 g/L, 蛋白胨 5.0 g/L,NaCl 20.0 g/L,K2HPO40.25 g/L)的酶活最高,达到128.7 U/mL。根据极差和方差分析(表4),可知正交试验所考察的影响酶活力的4个因素中,主要因素是A(褐藻酸钠质量浓度),其次是B(蛋白胨质量浓度)。通过正交试验,酶活性提高幅度约为20%。
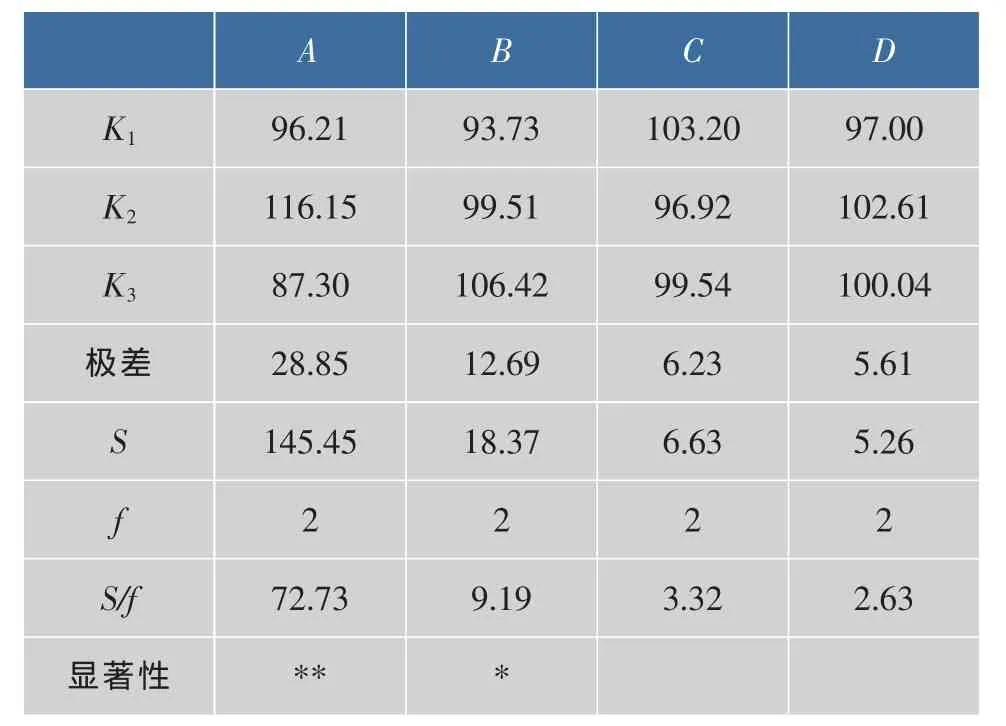
表4 发酵优化L9(34)正交实验直观分析表Table 4 Orthogonal experiment and range analyasis of optimal fermentation
2.3.4 pH对产酶的影响 培养基初始pH对菌株产酶也具有重要影响,环境pH直接影响着细胞膜的活性、稳定性以及产物代谢酶系的活性,从而间接影响着微生物对营养物质的吸收和酶的分泌[13]。如图8所示,菌株WG-007产酶最适pH为8.5。
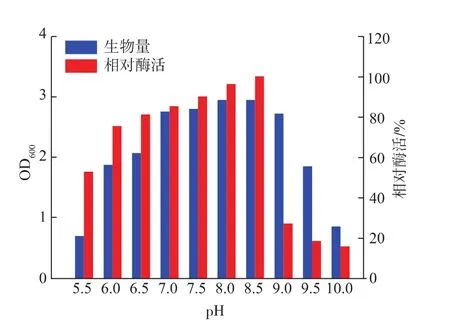
图8 pH对Cobetia sp.WG-007生长及产酶的影响Fig.8 Effect of pH on growth and enzyme activity from Cobetia sp.WG-007
2.3.5 温度对产酶的影响 在低于25℃时,菌株WG-007生长非常缓慢,直接影响到产酶。选择25、28、30、37℃发酵培养,确定其产酶的最适温度,结果如图9所示,在25℃时酶活性最高,在较高温度下菌株生长能力减弱,并且其产酶能力明显下降。相关研究也显示,大部分来源于海洋环境的褐藻胶降解菌产酶的适宜温度范围为25~30℃[14-15]。
2.3.6 装液量、接种量、转速对产酶的影响 不同的接种量对酶活性的影响并不显著,当接种量达到体积分数2.0%时,就能够达到较高的酶活。装液量也是制约菌种生长及产酶的一个重要因素,装液量过大会影响菌株生长过程中的溶氧,导致产酶下降。实验发现,装液量为30 mL时,褐藻胶裂解酶活力最高。试验中还测定了不同的转速 (150 r/min、180 r/min、200 r/min、220 r/min) 对菌株 WG-007 产酶的影响。发现转速对生长及产酶作用并不明显,适宜转速为150~180 r/min。

图9 温度对Cobetia sp.WG-007生长及产酶的影响Fig.9 Effect of temperature on growth and enzyme activity from Cobetia sp.WG-007
2.3.7 菌株WG-007的发酵产酶曲线 在最佳培养成分和培养条件下,菌株WG-007的生长和产酶随时间的变化如图10所示。生物量在21 h达到最大,发酵液中总酶活在30 h达到最高,为160.7 U/mL。依据酶发酵动力学曲线,该菌株产褐藻胶裂解酶属于生长半耦联型。

图10 Cobetia sp.WG-007的生长曲线及产酶曲线Fig.10 Curve of growth and enzyme activity of Cobetia sp.WG-007
3 结语
由褐藻酸钠作为唯一碳源的选择性培养基,从腐烂海带上筛选出多株具有明显降解褐藻酸钠能力的菌株,经过液体发酵培养基复筛,得到一株高产褐藻胶裂解酶的菌株WG-007。通过形态学研究并结合16S rDNA同源分析,鉴定该菌为Cobetia属。鉴于目前未见有关Cobetia属菌株产褐藻胶裂解酶的研究报道,因而研究Cobetia sp.WG-007产褐藻胶裂解酶具有一定的理论与应用价值。研究中通过单因素及正交试验对该菌株产酶条件发酵优化,已将酶活力提高到初始的3.52倍,达到160.7U/mL,接近了目前褐藻酸裂解酶发酵产酶的最高水平。由于优化后的产酶培养基成分简单,培养周期短,因此Cobetia sp.WG-007是一株潜在的可用于工业化生产的褐藻胶裂解酶生产新菌株。
[1]李丽妍,管华诗,江晓路,等.海藻工具酶——褐藻胶裂解酶研究进展[J].生物工程学报,2011,27(6):838-845.LI Liyan,GUAN Huashi,JIANG Xiaolu,et al.Advances in algae toolenzymes:alginate lyase [J].Chinese Journal of Biotechnology,2011,27(6):838-845.(in Chinese)
[2]Tang J C,Taniguchi H,Chu H,et al.Isolation and characterization of alginate-degrading bacteria for disposal of seaweed wastes[J].Letters in Applied Microbiology,2009,48(1):38-43.(in Chinese)
[3]Farrell E K,Tipton P A.Functional characterization of algL,an alginate lyase from pseudomonas aeruginosa[J].Biochemistry,2012,51(51):10259-10266.
[4]Gimmestad M,Ertesvag H,Heggeset T M B,et al.Characterization of three new azotobacter vinelandii alginate lyases,one of which is involved in cyst germination[J].Journal of Bacteriology,2009,191(15):4845-4853.
[5]Ma L Y,Chi Z M,Li J,et al.Overexpression of alginate lyase of Pseudoaltetmonas elyakovii in Escherichia coli,purification,and characterization of the recombinant alginate lyase[J].World Journal of Microbiology and Biotechnology,2008,24(1):89-96.
[6]Math R K,Jin H M,Kim J M,et al.Comparative genomics reveals adaptation by Alteromonas sp.SN2 to marine tidal-flat conditions:Cold tolerance and aromatic hydrocarbon metabolism[J].PloS One,2012,7(4):e35784.
[7]Haug A,Myklestad S,Larsen B,et al.Correlation between chemical structure and physical properties of alginates[J].Acta Chemica Scandinavica,1967,21:768-78.
[8]Di Cello F,Bevivino A,Chiarini L,et al.Biodiversity of a Burkholderia cepacia population isolated from the maize rhizosphere at different plant growth stages[J].Applied and Environment Microbiology,1997,63(11):4485-4493.
[9]Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173(2):697-703.
[10]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[11]东秀珠,蔡妙英.一般细菌常用鉴定方法[M].北京:科学出版社,2001.
[12]魏丹,窦文芳,李恒,等.高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化[J].食品与发酵工业,2012,38(7):26-31.WEI Dan,DOU Wenfang,LI Heng.et al.Isolation,identification,and fermentation optimization of a high efficient novel alginatedegrading strain[J].Food and Fermentation Industries,2012,38(7):26-31.(in Chinese)
[13]侯保兵,刘书来,张建友,等.褐藻胶裂解酶产生菌的发酵优化研究[J].水产科学,2009,28(11):667-670.HOU Baobing,LIU Shulai,ZHANG Jianyou,et al.Optimization of alginate-degrading bacterial fermentation process for alginate lyase production[J].Fisheries Science,2009,28(11):667-670.(in Chinese)
[14]傅晓妍,李京宝,韩峰,等.褐藻胶裂解产生菌Vibro sp.QY102的发酵条件优化[J].中国海洋大学学报,2007,37(3):432-436.FU Xiaoyan,LI Jingbao,HAN Feng.et al.Studies on Vibro sp.QY102 fermentation processes for alginate lyase production[J].Periodical of Ocean University of China,2007,37(3):432-436.(in Chinese)
[15]Fu X,Lin H,Kim S M.Optimization of culturing condition and medium composition for the production of alginate lyase by a marine Vibrio sp.YKW-34[J].Journal of Ocean University of China,2008,7(1):97-102.

