白藜芦醇对不同时间高糖诱导HepG2细胞氧化损伤的保护作用
徐圆媛 , 余 静 , 陈立立 , 成向荣 ,2, 施用晖 ,2, 乐国伟 *,2
(1.江南大学 食品学院,江苏 无锡 214122;2.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122)
氧化应激是机体在遭受有害刺激时,体内高活性分子如活性氧(reactive oxygen species,ROS)自由基产生过多,氧化程度超出机体清除能力,造成抗氧化系统失衡[1-2]。高糖能引起细胞中ROS水平增加,造成持久氧化应激,这与某些疾病如高血糖症、糖尿病及其并发症的成因和发展密切相关[3]。白藜芦醇(Resveratrol,Res)是芪类结构的多酚化合物,许多研究表明其具有抗氧化、清除自由基、抑制血小板聚集、调节血脂代谢、抗炎等广泛的生理药理学特性[4]。 α-硫辛酸(α-lipoic acid,LA)是天然抗氧化剂中效果最强的一种,能清除过氧化氢(H2O2)、羟自由基(·OH)等多种ROS[5]。较多研究结果表明,硫辛酸对氧化应激损伤细胞具有保护作用[6-8],本研究中用硫辛酸作为药物对照组。已有研究结果表明,白藜芦醇对氧化损伤的细胞具有一定的保护作用[9-11],其对损伤细胞的保护作用机制可能与调节核因子E2-相关基因 2(nuclear factor erythroid2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路、增强细胞对氧化应激的抗性相关[12],但对于细胞不同氧化应激状态时,不同浓度白藜芦醇的作用表现和机制鲜有报道。本研究中利用不同时间高糖诱导HepG2细胞氧化应激模型,探讨了白藜芦醇保护细胞模型抑制氧化损伤的作用表现和机制。
1 材料与方法
1.1 材料与仪器
人肝癌细胞HepG2,购自中科院上海生物化学与细胞生物学研究所;胰蛋白酶,美国Sigma公司产品;DMEM培养基,美国Gibco公司产品;小牛血清,杭州四季青生物材料工程研究所提供;葡萄糖(Glu)、噻唑蓝(MTT)、 2’,7’-二氯荧光素二乙酸酯(DCFH-DA)荧光探针,美国 Sigma公司产品;SOD、MDA、T-AOC、GSH-PX测定试剂盒,南京建成生物工程研究所提供;BCA蛋白质浓度测定试剂盒、Trizol试剂盒,上海生工生物工程公司产品;荧光定量PCR AccuPower 2X GreenstarqPCR Master Mix试剂,BIONEER公司产品;白藜芦醇、硫辛酸,美国Sigma公司产品。测定与分析用水均为灭菌超纯水。
二氧化碳恒温细胞培养箱,美国Thermo公司制造;SpectraMax M5/M5e酶标仪,美国Molecular Devices公司制造;One-Drop OD 1000+分光光度计,上海采邑生物科技有限公司提供;7900HT Fast Real-Time PCR仪,美国ABI公司制造。
1.2 方法
1.2.1 细胞传代培养 HepG2细胞在含有体积分数10%小牛血清的DMEM的培养基中于37℃、质量分数5%CO2饱和湿度环境下常规培养。细胞生长至70%~80%融合时胰蛋白酶消化。按体积比1∶3传代培养。细胞悬液以6×104个/mL的密度接于96孔板,每孔 100 μL。
1.2.2 实验分组 实验分为6组。正常对照组:含5.5 mmol/L 葡萄糖培养基(Control);损伤组:含33 mmol/L 高糖培养基(G);高糖加 10 μmol/L 硫辛酸对照组 (LA);高糖加不同浓度白藜芦醇处理组0.1 μmol/L(R0.1)、1 μmol/L(R1)、10 μmol/L(R10)。作用细胞时间分别为24、48、72 h。
1.2.3 噻唑蓝(MTT)法检测细胞存活率 96孔板中细胞分组处理,将培养基吸出,每孔加入20 μL 5 mg/mL的MTT,及80 μL的无血清培养基,继续培养4 h,去上清液加入150 μL DMSO,避光振荡10 min,M5酶标仪测定各孔在波长492 nm处的吸光度。
1.2.4 DCFH-DA荧光探针法检测细胞内自由基ROS水平 按1∶1 000体积比无血清培养液稀释DCFH-DA,使其终浓度为10 μmol/L。96孔板细胞培养终止,去除培养液,每孔加入100 μL DCFHDA。37℃培养箱内孵育30 min。PBS洗涤细胞2次,以充分去除未进入细胞内的DCFH-DA。检测细胞荧光强度,激发波长488 nm,发射波长525 nm。
1.2.5 氧化还原指标的测定 以细胞裂解液为样本,参照南京建成生物工程研究所提供的相应试剂盒说明书,测定细胞内MDA含量,以及SOD、TAOC、GSH-PX活性。蛋白质含量用BCA蛋白质试剂盒定量。
1.2.6 Real-time PCR方法测定细胞Nrf2、HO-1的mRNA表达 取培养48 h的细胞模型,用Trizol试剂盒提取细胞总RNA,One-Drop OD 1000+型分光光度计测定RNA的浓度和纯度。取2 μg总RNA进行反转录得到cDNA。以ABI-7000型荧光定量PCR仪,参照Accu Power 2X Greenstarq PCR Master Mix荧光定量PCR试剂盒,以β-action为内标进行PCR扩增。通过Ct值进行相对定量,用溶解度曲线评估PCR产物特异性。目的基因及内标引物设计见下表1。

表1 基因的引物序列Table 1 Sequence of the primers
2 结果与讨论
2.1 白藜芦醇对高糖诱导细胞存活率的影响
细胞在诱导剂的作用下,自由基产生增多,但这种损伤在适宜抗氧化剂的作用下有可能被修复。添加机体常见诱导物体外模拟氧化应激,建立细胞氧化应激损伤模型,评价抗氧化剂在细胞模型的作用,能够体现其在病理状态下的作用机制,为揭示氧化应激机制以及研究和筛选抗氧化药物和功能食品奠定了实验基础。高糖是常见的、极易获得并且性质稳定的诱导剂。高糖代谢时,大量葡萄糖进入细胞内时,无法及时进行糖酵解,激活6种代谢旁路,其途径中间产物过多可导致活性氧簇生成,同时激活蛋白激酶 C (PKC), 导致 O2-·、ONOO-等ROS的生成过量,并促进脂质过氧化,诱发氧化应激,造成对细胞的毒性[13-14]。
由表2可知,与正常对照组相比,48、72 h损伤组细胞存活率极显著降低(P<0.01),说明高糖的缓和损伤作用在48 h以上才会出现。与损伤组相比,Res、LA组均能显著提高模型细胞存活率(P<0.05),对损伤有显著的抑制作用,并且有一定的浓度依赖性,R10组作用72 h时无显著影响。

表2 白藜芦醇对高糖细胞存活率的影响Table 2 Effects of resveratrol on cell viability of high glucose-induced cell
2.2 白藜芦醇对高糖诱导细胞自由基水平的影响
2’,7’-二氯荧光素二乙酸酯 (DCFH-DA),一种针对细胞内活性氧类物质的特异性荧光探针,可以特异性地与ROS结合,从而直接检测细胞内ROS量的变化[15]。传统计算细胞ROS水平的方法,通常没有考虑细胞存活的状态,只单纯地进行荧光值的计算。作者在实验中发现,在不同作用浓度下,存活率变化显著,考虑活细胞才能在检测ROS时发出荧光,因此在计算ROS水平时需要去除细胞存活率的影响,校正过的ROS水平才能更准确地反映实验实际状况。
由表3可知,与正常对照组相比,48、72 h高糖损伤组能极显著升高ROS水平(P<0.01),添加抗氧化剂组均能显著降低损伤模型的ROS水平,并具有一定的浓度依赖性。72 h R10组较R0.1、R1组ROS水平有显著上升的趋势。提示在R10作用72 h时,可能会对细胞产生有损害的促氧化作用。
由实验2.1、2.2结果可知,高糖不同于常见的H2O2急性损伤,它在24 h内没有显著效果,需要代谢48 h以上才会对细胞存活率和自由基产生极显著影响,造成氧化损伤。添加不同浓度Res能提高损伤模型的存活率、降低自由基水平。

表3 白藜芦醇对高糖细胞自由基的影响Table 3 Effects of resveratrol on ROS of high
2.3 白藜芦醇对高糖诱导细胞氧化还原状态的影响
由表3可见,与正常组相比,不同时间损伤组的 SOD、GSH-PX、T-AOC 均显著降低,MDA 含量显著升高(P<0.05)。与各个时间损伤组相比,添加LA和不同浓度Res时,SOD、GSH-PX、T-AOC均显著升高(P<0.05),MDA 含量显著降低(P<0.05),并且Res对高糖诱导细胞氧化还原状态的调节存在剂量效应关系。48 h组Res各浓度氧化还原状态整体水平均优于其他两个时间组。R10组作用效果最好,且在相同浓度下,Res效果优于LA。
从氧化还原指标的实验结果可以看出,高糖能显著破坏细胞的氧化还原平衡状态,加入白藜芦醇能显著抑制高糖造成的氧化损伤,R10组甚至能使氧化还原状态接近甚至优于正常对照组,推测可能是白藜芦醇清除了细胞内较多的活性氧类物质后使SOD、GSH-PX含量相对性增多,总抗能力提高。24 h下未出现显著慢性损伤,但细胞氧化还原状态已开始发生改变;48 h下显著造成氧化应激 (P<0.05),Res各浓度组均能不同程度改善氧化还原水平,并且 R10 组改善效果极显著(P<0.01);72 h 长期作用时,改善氧化还原状态的程度显著性低于48 h各组,并且高浓度可能会发生对损伤细胞的促氧化作用。

表3 白藜芦醇对高糖诱导细胞氧化还原状态的影响Table 3 Effects of resveratrol on the redox states of high glucose-induced cell
2.4 白藜芦醇对高糖诱导细胞Nrf2、HO-1 mRNA表达的影响
Nrf2是重要的内源性抗氧化应激的调节因子,其活化后可以调节一些重要的抗氧化酶类的表达。当细胞受到毒物或者氧化物质作用时,Nrf2蛋白质发生磷酸化解偶联,进入细胞核内,与抗氧化反应元件(ARE)结合,进而诱导其调控的靶基因表达血红素加氧酶 1(HO-1)、醌氧化还原酶 1(NQO1)、超氧化物歧化酶(SOD)等抗氧化和II相解毒酶,从而对抗ROS引发的氧化应激,保护正常的细胞不受其破坏[12]。
选取2.3实验结果中作用效果最好的48 h模型R10组以及相应的高糖损伤组、LA组,RT-PCR测定其Nrf2、HO-1 mRNA表达水平。由图1、2可知,与正常对照组相比,损伤组显著降低Nrf2、HO-1的表达水平 (P<0.05);与损伤组相比,LA和Res均能极显著升高 Nrf2、HO-1的表达水平(P<0.01),并且R10组的升高水平更为显著。表明在高糖损伤的细胞模型中,白藜芦醇可以通过活化Nrf2通路,上调其下游抗氧化酶mRNA的表达,从而改善细胞氧化还原状态。
综上所述,高糖诱导4 8h以上时,细胞存活率显著降低、自由基水平显著上升(P<0.05),造成细胞氧化应激。
24、48、72 h时,各浓度白藜芦醇均能改善损伤细胞氧化还原状态,其中R10组作用48 h效果极显著(P<0.01)。在一定范围内,随着氧化应激的加剧,白藜芦醇的需要量可能发生变化,短期作用时,大剂量可以有效缓解氧化应激;长期作用时,大剂量可能会出现促氧化等不良影响。在适宜的低剂量下,能长期维持氧化还原平衡状态。因而不同氧化还原状态对抗氧化剂的需要量可能会有不同,但其机制需要进一步探讨。
R10组作用48 h时,上调Nrf2、HO-1 mRNA表达水平,通过提高损伤模型抗氧化相关通路重要基因的表达来改善氧化还原状态。

图1 白藜芦醇对高糖诱导细胞Nrf2表达的影响Fig.1 Effects of resveratrol on the expression of Nrf2 of high glucose-induced cell
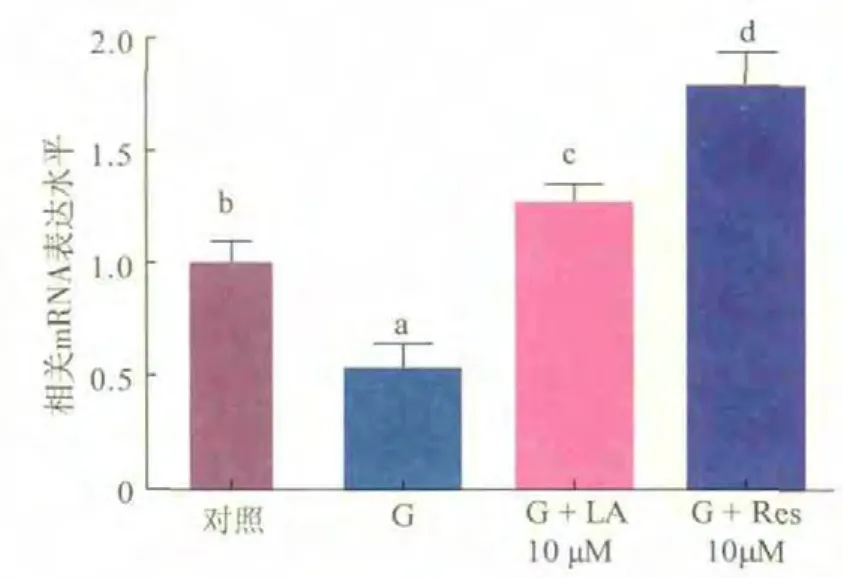
图2 白藜芦醇对高糖诱导细胞HO-1表达的影响Fig.2 Effects of resveratrol on the expression of HO-1 of high glucose-induced cell
3 结语
探讨了不同浓度白藜芦醇对不同时间高糖诱导的HepG2细胞氧化损伤的保护作用,通过对细胞存活率和自由基水平的影响,以及氧化还原状态、抗氧化通路相关基因的测定,结果显示,白藜芦醇能显著升高高糖诱导细胞损伤模型的存活率,通过清除细胞自由基水平、改善细胞抗氧化能力、上调Nrf2-ARE通路中Nrf2、HO-1 mRNA的表达,改善并维持了细胞良好的氧化还原状态。
[1]吴其夏,余应年,卢建.病理生理学[M].北京:中国协和医科大学出版社,2003.
[2]柯跃斌,郑荣梁.自由基毒理学[M].北京:人民卫生出版社,2012.
[3]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414:813-820.
[4]Das D K,Maulik N.Resveratrol in cardio protection:A therapeutic promise of alternative medicine[J].Mol Interv,2006,6(1):36-47.
[5]Packer L,Witt E H,Tritschler H J.Alpha-lipoic acid as a biological antioxidant[J].Free Radic Biol Med,1995,19:227-250.
[6]Meng X,Li Z M,Zhou Y J,et al.Effect of antioxidant α-lipoic acid on apoptosis in human umbilical vein endothelial cells induced by high glucose[J].Clin Exp Med,2008(8):43-49.
[7]Petersen Shay K,Moreau R F,Smith E J,et al.Is alpha-lipoic acid a scavenger of reactive oxygen species in vivo:Evidence for its initiation of stress signaling pathways that promote endogenous antioxidant capacity[J].IUBMB Life,2008,60(6):362-367.
[8]Suh J H,Shenvi S V,Dixon B M,et al.Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis,which is reversible with lipoic acid[J].Proc Natl Acad Sci USA,2004,101(10):3381-3386.
[9]Yu W,FU Y C,Zhou X H,et al.Effects of resveratrol on H2O2-induced apoptosis and expression of SIRTs in H9c2 cells[J].Cell Biochem,2009,107:741-747.
[10]Vinqtdeux V,Dreses-Werringloer U,Zhao H,et al.Therapeutic potential of resveratrol in Alzheimer’s disease[J].BMC Neurosci,2008,9(Supply 2):S6.
[11]Li Y,Cao Z,Zhu H.Upregulation of endogenous antioxidants and phase 2 enzymes by the red wine polyphenol,resveratrol in ultured aortic smooth muscle cells leads to cytoprotection against oxidative and electrophilic stress[J].Pharmacol Res,2006,53(1):6-15.
[12]Kobayashi M,Yamamoto M.Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J].Adv Enzyme Regul,2006,46:113-140.
[13]Poitout V,Robertson R P.Minireview:Secondary β-cell failure in type 2 diabetes-convergence of glucotoxicity and lipotoxicity[J].Endocrinology,2002,143:339-342.
[14]Poitout V,Robertson R P.Glucolipotoxicity:Fuel excess and β-cell dysfunction[J].Endocr Rev,2008,29:351-366.
[15]Nagano T.Bioimaging probes for reactive oxygen species and reactive nitrogen species[J].Clin Biochem Nutr,2009,45:111-124.

