非酿酒酵母菌在自然发酵过程中产脂肪酶特性
徐亚男, 李 琦, 肖 婧, 倪永清, 单春会, 史学伟
(石河子大学 食品学院,新疆 石河子832000)
非酿酒酵母是一类自然存在于葡萄酒发酵过程中的微生物,其代谢物对酒的香气、风味等感官特征有很重要的影响[1]。酿酒酵母和非酿酒酵母都参与酒精发酵过程,其中非酿酒酵母的脂肪酶产量高于酿酒酵母[2],通常都是在发酵初期存在。脂肪酶是重要的工业酶制剂品种之一[3],可以催化解脂、酯交换、酯合成等反应,广泛应用于油脂加工、食品、医药、日化等工业。不同来源的脂肪酶具有不同的催化特点和催化活力。脂肪酶可以降解来自葡萄和酵母菌自溶的脂质,释放脂肪酸来改善葡萄酒的品质[4]。葡萄酒生产中常用的脂肪酶多是来源于细菌或者丝状真菌,但是其通常是不确定的复杂的酶的混合物,对葡萄酒可能存在某些不利影响。脂肪酶是一种特殊的酯键水解酶[5],它可作用于甘油三酯的酯键,使甘油三酯降解为甘油二酯、单甘油酯、甘油和脂肪酸。目前国内外对野生微生物脂肪酶的研究与开发较为活跃。脂肪酶可以应用于生产生活的各个方面[6],尤其在新疆葡萄酒的生产中有着广泛的应用,脂肪酶作用后释放出的链较短的脂肪酸,增加和改进食品的风味和香味,可以增进葡萄酒的香气成分,改善酒的品质,因此对脂肪酶的特性的研究十分必要。
作者通过对非酿酒酵母中高产脂肪酶菌株的筛选、酶活测定,最终得到高产脂肪酶菌株Y13。此研究为提高果酒品质奠定了基础,并对丰富酿造果酒菌种资源及扩大果酒市场占有率具有重要的推动作用。因此研究非酿酒酵母菌在新疆葡萄自然发酵过程中产脂肪酶特性亦十分有必要。
1 试验材料
1.1 菌种及试剂
实验室保藏的24株酵母菌株,其生长发育树见图1。
本试验所使用化学试剂均为色谱纯及分析纯,由天津市巴斯夫化学试剂厂生产。

图1 系统发育树Fig.1 Phylogenetic tree
1.2 培养基
1.2.1 YPD培养基 葡萄糖2.0 g/dL,蛋白胨2.0 g/dL,酵母浸粉1.0 g/dL;蒸馏水配制,自然pH值,121℃高压灭菌20 min。
1.2.2 初筛培养基1 蛋白胨1.0 g/dL,酵母粉0.5 g/dL,NaCl 0.5 g/dL,CaCl20.01 g/dL,Tween80 1.0 g/dL,琼脂 1.5 g/dL;pH 7.2。
1.2.3 初筛培养基2 蛋白胨1.0 g/dL,葡萄糖0.5 g/dL,硝 酸 铵 0.1 g/dL,MgSO4·7H2O 0.05 g/dL,NaCl 0.05 g/dL,K2HPO40.1 g/dL,琼脂 2 g/dL,橄榄油乳化液1.2 g/dL,罗丹明B 0.1 g/dL。
1.2.4 种子培养液 葡萄糖10 g/dL,蛋白胨5 g/dL,K2HPO41.0 g/dL,MgSO40.5 g/dL;pH 7.2。
1.2.5 发酵培养基 葡萄糖10 g/dL,牛肉浸膏10 g/dL,K2HPO42.0 g/dL,MgSO40.3 g/dL,橄榄油乳化液10 g/dL;pH 7.5。 详见文献[7]。
2 试验方法
2.1 菌株活化及扩增培养
2.1.1 菌株活化 将 4℃保藏的酿酒酵母菌株,分别接种于YPD液体管培养基中,在30℃下培养48 h活化。
2.1.2 扩增培养 将活化的菌株按体积分数5%的接种量接于已装有100 mL YPD培养基的三角瓶中,于28℃、180 r/min摇床扩增培养72 h。
2.2 菌株产酶鉴定
酵母菌接种于初筛培养基1平板上,37℃培养4 d。脂肪酶能分解Tween80在菌落周围形成的白色透明圈。
酵母菌接种于初筛培养基2平板上,37℃培养4 d。产脂肪酶的菌株会出现橘黄色荧光圈,挑选荧光圈大的进行复筛。
2.3 发酵条件优化
对筛选出的菌株进行产脂肪酶学特性研究,利用酶学特性优化发酵培养条件。
2.4 脂肪酶粗酶液的提取及酶活测定
挑取菌种接入装有50 mL种子培养液的250 mL的三角瓶中培养48 h。种子培养液按体积分数5%接种量接种于装有50 mL发酵培养基的250 mL的三角瓶中培养。收集发酵液,4℃下10 000 r/min离心10 min,获得上清液作为粗酶液。
在试验温度和试验pH下,每分钟释放1 μmol脂肪酸的酶量定义为一个酶活力单位 (μmol/(min·mL)),以U表示 。用NaOH滴定法进行酶活测定[8]。
2.5 脂肪酶酶学特性研究方法
分别选取测定温度、pH、金属离子、培养时间对酶活的影响为单因子,进行单因素试验,计算公式如下:

式(1)中:V 为滴定样液消耗的 NaOH 体积(mL),V0为滴定空白样消耗的NaOH体积 (mL),t为反应时间(min),n 为酶液体积(mL),M 为滴定用的 NaOH溶液的浓度(mol/mL)。
3 结果与分析
3.1 产脂肪酶菌株鉴定
经试验,通过肉眼观察和紫外灯照射观察发现,Y9、Y13、Y19、Y21 透明圈和荧光圈比较明显,可以判定 Y9、Y13、Y19、Y21这 4株菌株可以产生脂肪酶,结果见图2。

图2 Y9、Y13、Y19、Y21透明圈和荧光圈比较结果Fig.2 Compare the results transparent and fluorescent ring of Y9、Y13、Y19、Y21
透明圈直径越大酶活越高[9]。由表1根据透明圈的直径大小的比较可得,透明圈的直径大小Y19<Y21<Y9<Y13,因此 Y13 酶活最高。

表1 鉴定结果Table 1 Authentication
3.2 脂肪酶酶学特性
3.2.1 温度对酶活的影响 将酶液分别在0℃、10℃、20℃、30℃、40℃、50℃中保温 30 min,在35℃下测定其酶活力(其他条件为标准发酵条件)。结果见图3。
由图3可知,0~40℃脂肪酶的酶活一直在升高,脂肪酶保持较高的稳定性,在40℃以上时,脂肪酶的酶活迅速下降,这是因为40℃以上酶已变性失活。因此脂肪酶在40℃左右最为稳定。

图3 温度对酶活的影响Fig.3 Influence of temperature on enzyme activity
3.2.2 pH对酶活的影响 在酶活液中分别加入pH为 5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5 的缓冲液,在35℃下测定酶活力(其他条件为标准发酵条件)。结果见图4。
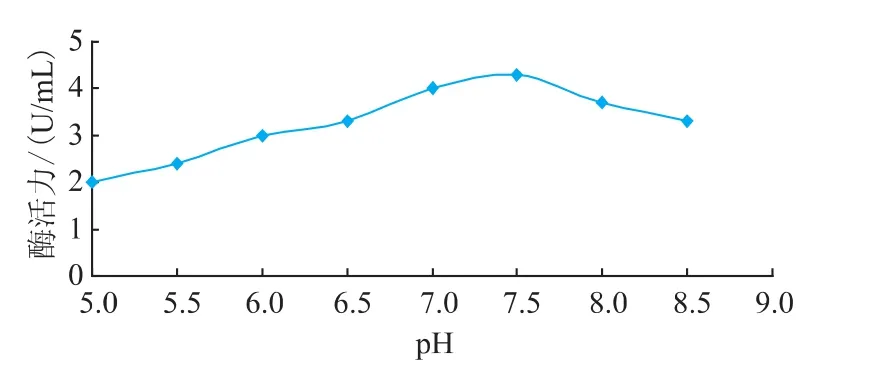
图4 pH对酶活的影响Fig.4 Effect of PH on enzyme activity
由图4可知,在pH为5.0~7.5范围内,酶活力一直升高,pH超过7.5,酶活力下降。脂肪酶在pH 7.0~7.5范围内稳定性好,显示较高活性,可见该脂肪酶为中性脂肪酶[10]。
3.2.3 金属离子对酶活的影响 将Fe2+、Cu2+、Mn2+、Ca2+、Na+、K+、Zn2+、Mg2+分别加入到酶液中, 在 35 ℃下测定酶活(其他条件为标准发酵条件)。结果见图5。

图5 金属离子对酶活的影响Fig.5 Effect of metal ion on enzyme activity
由图5可知,不同的金属离子对酶活的影响不同。Fe2+、Cu2+、Ca2+对酶有明显的激活作用;Mn2+、Na+、K+、Zn2+对酶有微弱的激活作用;而Mg2+对酶具有一定的抑制作用。其中,Ca2+对酶的激活作用最显著。
3.2.4 培养时间对酶活的影响 将酶液分别培养24、36、48、60、72、84 h,35 ℃下测定酶活(其他条件为标准发酵条件),结果见图6。

图6 培养时间对酶活的影响Fig.6 Effect of culture time on enzyme activity
由图6可知,培养时间在36~60 h产酶能力随培养时间的增加而增加,自60 h开始减少,产酶能力最大培养时间在60 h左右。
3.3 发酵条件的优化
通过单因素实验得出:产酶的最适温度为40℃,最适 pH 为 7.0~7.5,Fe2+、Cu2+、Ca2+对酶有明显的激活作用,Ca2+作用最明显,最适培养时间为60 h。
根据单因素试验,选取影响力较大的4个因素进行正交试验,结果见表2。

表2 正交试验结果Table 2 Orthogonal test results
比较本实验中的4个因素中Rj的大小,可以看出影响因素A>C>D>B。优化组合为A1B2C3D3。即高产脂肪酶菌株最优培养条件为:培养温度39℃,pH为7.0,培养时间为65 h,添加适量Ca2+。
4 结语
通过产脂肪酶试验,根据透明圈和荧光圈的有无,以及透明圈直径的大小,确定Y13是脂肪酶高产菌株。通过单因素试验和正交试验优化得酶的最适培养温度为39℃,最适pH为7.0,Ca2+促进酶的发酵,最适培养时间为65 h,温度是产酶试验的最大影响因素。
脂肪酶可以应用于食品工业的各个方面,例如用于有机相合成的具有转酯化或酯化功能的脂肪酶的规模化生产,对于酶催化合成精细化学品和手性化合物有重要意义。食品工业利用酶作用后释放出的链较短的脂肪酸,增加和改进食品的风味和香味;利用脂肪酶催化的醇解和酯化反应来生产各种香精酯,作调料剂;用有1,3-专一性的微生物脂肪酶提高食用油营养价值和增加食用油的花色品种[11],制备代可可酯等高档油脂;另外,脂肪酶还可以用于酒类的去浊除渣,改善面包品质,改善蛋白质的发泡等方面。因此产脂肪酶菌株不仅可以应用于葡萄酒的生产、改善酒的香气成分、提高葡萄酒的品质,而且还可以广泛应用于其他食品工业,增加食品风味,提高食品的品质。
[1]Yadavdn,Paykipe,Khanm A,et al.Effect of freeze-thaw cycles and additives on rheological an d sensory properties of ready to bake:Frozen chapaties[J].International Journal of Food Science and Technology,2008,43:1714-1720.
[2]Ukait,Urade R.Cooperation of phosphatidylcholine with endogenous lipids of wheat flour for an increase in dough volume[J].Food Chemistry,2007,102:225-231.
[3]Collarc,Andreup,Martinez-Anayam A.Interactive effects of flour,starter and enzyme on bread dough machinability[J].European Food Research and Technology,1998,207:133-139.
[4]Lilbaek H M,Broe M L,Hoier E,et al.Improving the yield of mozzarella cheese by phospholipase treatment of milk[J].Journal of Dairy Science,2006,89:4114-4125.
[5]吴华昌,由耀辉,卢中申,等.脂肪酶应用于白酒催陈的初探[J].中国酿造,2011(3):75-77.WU Huachang,YOU Yaohui,LU Zhongshen,et al.Application of lipsase in the aging of liquor[J].China Brewing,2011(3):75-77.(in Chinese)
[6]李蓓,衣杰荣.腐乳在发酵过程中脂肪酶活力变化研究[J].食品工业科技,2011(10):261-263.LI Bei,YI Jierong.Evolution of lipase activity during sufu ripening process[J].Science and Technology of Food Industry,2011(10):261-263.(in Chinese)
[7]甘争艳,阿依木妮沙,吾满江,等.假丝酵母脂肪酶Li-pase AY 30G催化红花油水解研究[J].化学工程与装备,2011(7):25-26.GAN Zhengyan,A Yi Munisha,WU Manjiang,et al.Candida lipase AY 30G catalytic hydrolysis of safflower oil[J].Chemical Engineering&Equipment,2011(7):25-26.(in Chinese)
[8]康建波,胡士恒,王亚男,等.脂肪酶催化玉米油合成脂肪酸乙酯工艺研究[J].现代化工,2012,32(7):47-49.KANG Jianbo,HU Shiheng,WANG Yanan,et al.Optimization of lipase-catalyzed synthesis of fatty acid ethylester from corn oil[J].Modern Chemical Industry,2012,32(7):47-49.(in Chinese)
[9]Kulthidak,Patoomratanat,Emmanuelle M,et al.pH-imprinted lipase catalyzed synthesis of dextran fatty acid ester[J].Journal of Molecular Catalysis B:Enzymatic,2007,47(3):135-142.
[10]孙国政,甘伯中,张卫兵,等.天祝牧区牦牛乳酥油中产脂肪酶菌株筛选及产酶条件的研究[J].食品工业科技,2010,31:195-199.SUN Guozheng,GAN Bozhong,ZHANG Weibing,et al.Screening lipase-producing microorganisms from yak butter of TIanzhu pasturing area and study on its fermentation conditions[J].Science and Technology of Food Industry,2010,31:195-199.(in Chinese)
[11]Kur sheva A V,Lit vinenko I V.Spectrofluorometric studies of the aromatic hydrocarbons in the bottom sediments and water mass of the western sector of the arctic region[J].Oceanology,2009,49(5):707-714.

