大蒜抑菌成分提取工艺优化
李艳梅, 赵福顺
(内蒙古农业大学 职业技术学院,内蒙古 包头014109)
大蒜(Allium sativum L)为百合科葱属多年生草本缩根植物,俗称葫、独蒜、葫蒜等,鳞茎俗称“大蒜”[1-2]。大蒜的化学成分齐全,含有水、维生素、无机盐、蛋白质、氨基酸、脂质类、糖类、微量元素及含硫化合物等,含硫化合物为大蒜的主要活性物质[3-7]。大蒜对真菌具有一定的抑制作用,其功能原理主要是含硫化合物成分与重要的巯基包含酶相互作用,使酶失去功用[8-12]。利用其抗菌原理,大蒜生物活性物质在临床上被广泛的应用。马穆英等研究大蒜水溶液对几十种常见真菌的抑制和杀菌作用,结果表明,根据测定的杀菌率,大蒜抗真菌的能力与化学防腐剂甲苯酸和山梨酸钾的抗菌能力相当[13]。
1 材料与方法
1.1 材料与仪器
大蒜,购于内蒙古包头市农贸市场;番茄晚疫病菌,由内蒙古农业大学职业技术学院食品系提供;无水乙醇、石油醚、三氯甲烷、乙酸乙酯、正丁醇,均购于天津市化学试剂三厂,分析纯;马铃薯葡萄糖琼脂培养基(PDA)、马铃薯液体培养基(PDB),购于青岛高科园海博生物技术有限公司。
RE-52AAA旋转蒸发仪,上海嘉鹏科技有限公司制造;KG-SX-700型灭菌锅,日本岛津公司制造;VD-1320型无菌操作台,哈尔滨东联电子公司制造;MJX-150BX霉菌培养箱,天津市泰斯特仪器有限公司制造。
1.2 实验方法
1.2.1 菌悬液的制备 将番茄晚疫病菌接种于灭菌后的PDA培养基上,26℃下培养72 h,活化3次,将第3代菌种采用血球板计数法,用灭菌后的生理盐水稀释成 1×107~1×109CFU/mL 的菌悬液。

1.2.3 抑菌实验方法 采用牛津杯法[14],配制PDA培养基,倒入灭菌培养皿中,冷却凝固。将0.2 mL菌悬液接入培养基中,涂布均匀。将牛津杯放在培养基上,将0.2 mL待测液注入牛津杯中,以待测液的溶剂作为对照,平行3次,在26℃培养箱中培养72 h,测量抑菌圈的大小,照相。
1.2.4 抑菌物质提取工艺
1)提取溶剂的选择:称取各2.00 g大蒜粉末共10份,置于不同的三角瓶中,分别加入提取溶剂水、体积分数30%乙醇、体积分数50%乙醇、体积分数70%乙醇、体积分数90%乙醇、无水乙醇、石油醚、三氯甲烷、乙酸乙酯、正丁醇。料液比为 1∶5 (g/mL),在40℃提取2 h。然后按1.2.3进行抑菌实验,并根据抑菌圈的大小确定最佳溶剂。
2)提取温度的选择:称取各2.00 g大蒜粉末共6份,置于不同的三角瓶中,采用1)中选择的最佳溶剂,料液比为 1∶5 (g/mL),提取时间为 2 h,提取2 次。 按 1.2.2 的提取工艺, 分别在 25、30、40、45、50、55℃下提取。然后按1.2.3进行抑菌实验,并根据抑菌圈的大小确定最佳温度。
3)提取时间的选择:称取各2.00 g大蒜粗粉共6份,置于不同的三角瓶中,采用已确定的最佳溶剂和最佳温度,料液比为1∶5(g/mL)。按1.2.2的提取工艺, 分别在 1、2、3、4、5 h的条件下超声波辅助提取2次,然后按1.2.3进行抑菌实验,并根据抑菌圈的大小确定最佳提取时间。
4)料液比的选择:称取各2.00 g大蒜粗粉共6份,置于不同的三角瓶中,采用之前确定的最佳条件,按 1.2.2 的提取工艺,分别在 1∶5、1∶10、1∶15、1∶20、1∶25、1∶30 (g/mL)的条件下超声波辅助提取2次。按1.2.3进行抑菌实验,并根据抑菌圈的大小确定最佳料液比。
5)浸提次数的选择:称取各2.00 g大蒜粗粉共4份,置于不同的三角瓶中,采用已确定的提取条件,按 1.2.2的提取工艺,分别提取 1、2、3、4次。 按1.2.3进行抑菌实验,并根据抑菌圈的大小确定最佳提取次数。
6)正交实验:影响提取效率的因素是提取温度(A)、提取时间(B)、提取料液比(C)、浸提次数(D)。根据以上单因素的实验结果,通过 L16(44)正交实验,经比较各自的抑菌效果,确定大蒜抑菌成分的最佳提取条件。
1.2.5 最小抑菌质量浓度实验和最小杀菌质量浓度实验 采用二倍稀释法,取具塞试管9支编号,分别加5 mL的PDB液体培养基。取0.8 g/mL的大蒜粗提液5 mL加到1号试管中混匀,从1号试管中取5 mL加到2号试管中,以此类推,加到8号试管为止,再将第8支试管弃去5 mL。即各试管中药液 的 质 量 浓 度 分 别 为 400、200、100、50、25、12.5、6.3、3.2 mg/mL,以不加大蒜粗提液为空白对照,灭菌。将每支试管中加入0.2 mL菌悬液,26℃,150 r/min培养72 h。观察试管是否浑浊,不浑浊记为“—”,浑浊记为“+”,以未浑浊的最小质量浓度作为最小抑菌质量浓度。从每支试管中取0.2 mL加到PDA培养基中,涂布均匀,培养72 h。无菌落生长记为“—”,有菌落生长记为“+”,以未长菌的最小质量浓度为最小杀菌质量浓度。
2 结果与分析
2.1 提取溶剂的优选
根据1)的实验设计进行了最佳提取溶剂的选择实验,实验结果见图1,不同溶剂其提取效果表现差异很大。水、体积分数30%乙醇、体积分数50%乙醇、乙酸乙酯作为提取溶剂时,提取液的抑菌圈直径均大于30 mm;体积分数70%乙醇、体积分数90%乙醇、无水乙醇提取液的抑菌圈直径在20~30 mm;三氯甲烷、正丁醇提取液的抑菌圈直径在10~20 mm;石油醚提取液的抑菌圈直径小于10 mm。根据其溶质相似相溶的原理,其结构相似的物质才能易于混溶,其中体积分数30%乙醇提取液的抑菌圈直径最大,因此选择体积分数30%乙醇作为最适溶剂。
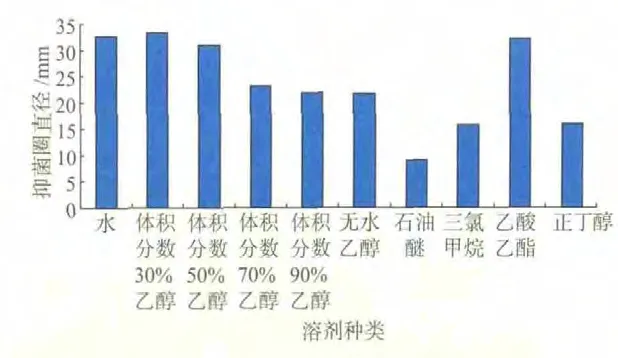
图1 溶剂对大蒜粗提液抑菌效果的影响Fig.1 Effects of different solvents on antifungal substances
2.2 提取温度的优选
用体积分数30%乙醇作为提取溶剂,根据2)的实验设计进行了最佳提取温度的选择实验,实验结果见图2。随着温度增高,其抑菌效果逐渐提高,以提取温度在35℃时,提取物的抑菌效果最好。随着提取温度的不断增高,抑菌效果降低,这可能是由于温度过高,使大蒜中的抑菌活性成分被降解。所以选择35℃作为最佳提取温度。
2.3 提取时间的优选
用体积分数30%乙醇作为提取溶剂,提取温度为35℃时,不同时间处理提取液的抑菌效果见图3。随着时间的延长,提取液的抑菌效果逐渐增高,当提取时间达到2~3 h时,抑菌效果最好;当提取时间4~5 h时,随着时间的延长,提取液的抑菌效果迅速下降。所以,选择3 h作为最佳提取时间。
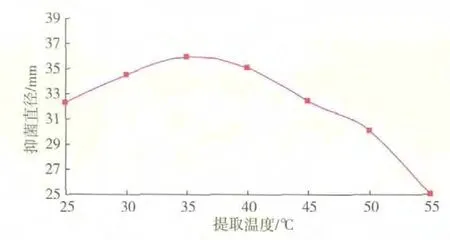
图2 提取温度对大蒜粗提液抑菌效果的影响Fig.2 Effects of different temperature on antifungal substances
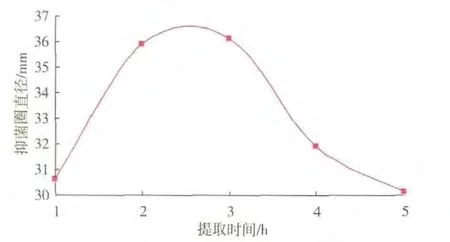
图3 提取时间对大蒜粗提液抑菌效果的影响Fig.3 Effects of different time on antifungal substances
2.4 提取料液比的优选
用体积分数30%乙醇作为提取溶剂,提取温度为35℃,提取时间为3 h,不同的料液比的提取液抑菌效果见图 4。当料液比为 1∶5~1∶10 (g/mL)时,随着提取溶剂的增加,提取液抑菌效果也逐渐增高;当料液比在 1∶10~1∶30 (g/mL)时,抑菌效果随料液比的变化趋于稳定。提取溶剂的增加,使物料与溶剂的接触面积增大,有效成分的浸出也随之加快,抑菌活性增强[8]。所以,选择 1∶10 (g/mL)作为最适宜的料液比。
2.5 提取次数
用体积分数30%乙醇作为提取溶剂,提取温度为 35 ℃,提取时间为 3 h,料液比 1∶10 (g/mL)。提取次数与提取液抑菌效果的关系见图5。当提取次数为1~2次时,随着提取次数的增多,抑菌效果也逐渐增高。当提取次数为3~4次时,随着提取次数的增加,提取液的抑菌效果逐渐趋于平缓,所以选择3次作为最适宜的提取次数。
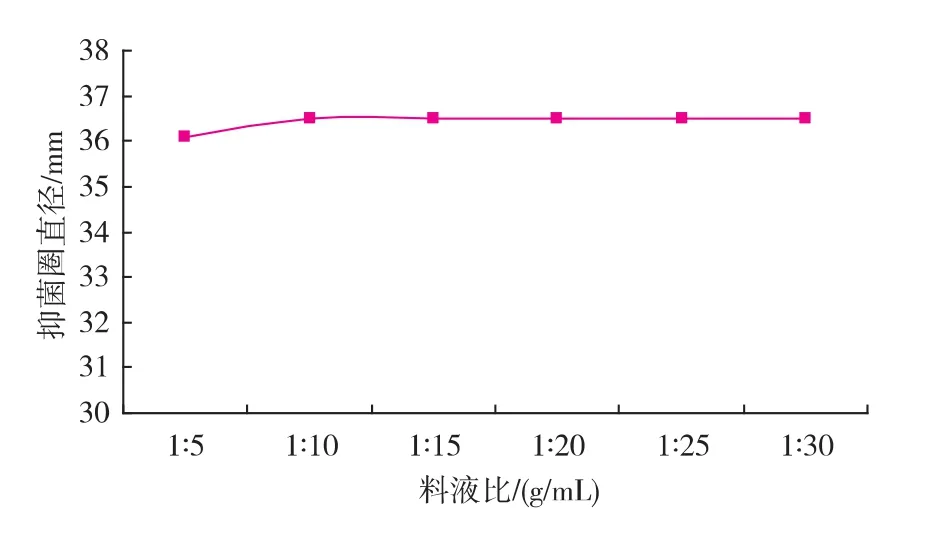
图4 提取料液比对大蒜粗提液抑菌效果的影响Fig.4 Effects of different solid-liquid ratio on antifungal substances
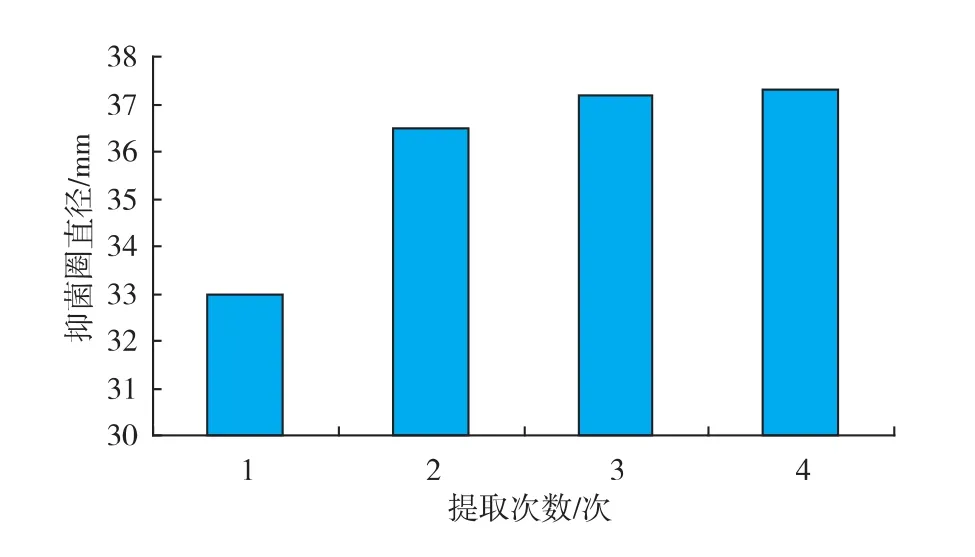
图5 提取次数对大蒜粗提液抑菌效果的影响Fig.5 Effects of different times on antifungal substances
2.6 正交实验
采用正交设计,确定了提取条件的最优组合,结果见表1。各因素对番茄晚疫病菌抑菌效果影响的主次关系为 D>A>C>B。可以看出,A、B、C、D 4个因素的影响都具有统计学意义,D因素影响显著,A因素影响仅次于D,即因素D对番茄晚疫病菌的抑菌效果起决定性的作用;因素C和因素B对抑菌效果的影响不如A和D。因此,综合考虑各因素对番茄晚疫病菌的影响结果,确定了最佳配方组合为A3B1C3D3,即提取温度 40 ℃,料液比 1∶5 (g/mL),提取时间3 h,提取3次。
2.7 最小抑菌质量浓度与最小杀菌质量浓度实验
在上述实验结果的基础上,进行最小抑菌质量浓度与最小杀菌质量浓度的实验。由表2可以看出,当药液质量浓度在15.7 mg/mL时5号试管未浑浊,当药液质量浓度达到6.3 mg/mL时6号试管出现浑浊现象。然后进行最小杀菌质量浓度实验,当药液质量浓度在12.5 mg/mL时有少量菌落。则表明大蒜粗提液对番茄晚疫病菌的最小抑菌质量浓度为12.5 mg/mL,最小杀菌质量浓度为25 mg/mL。
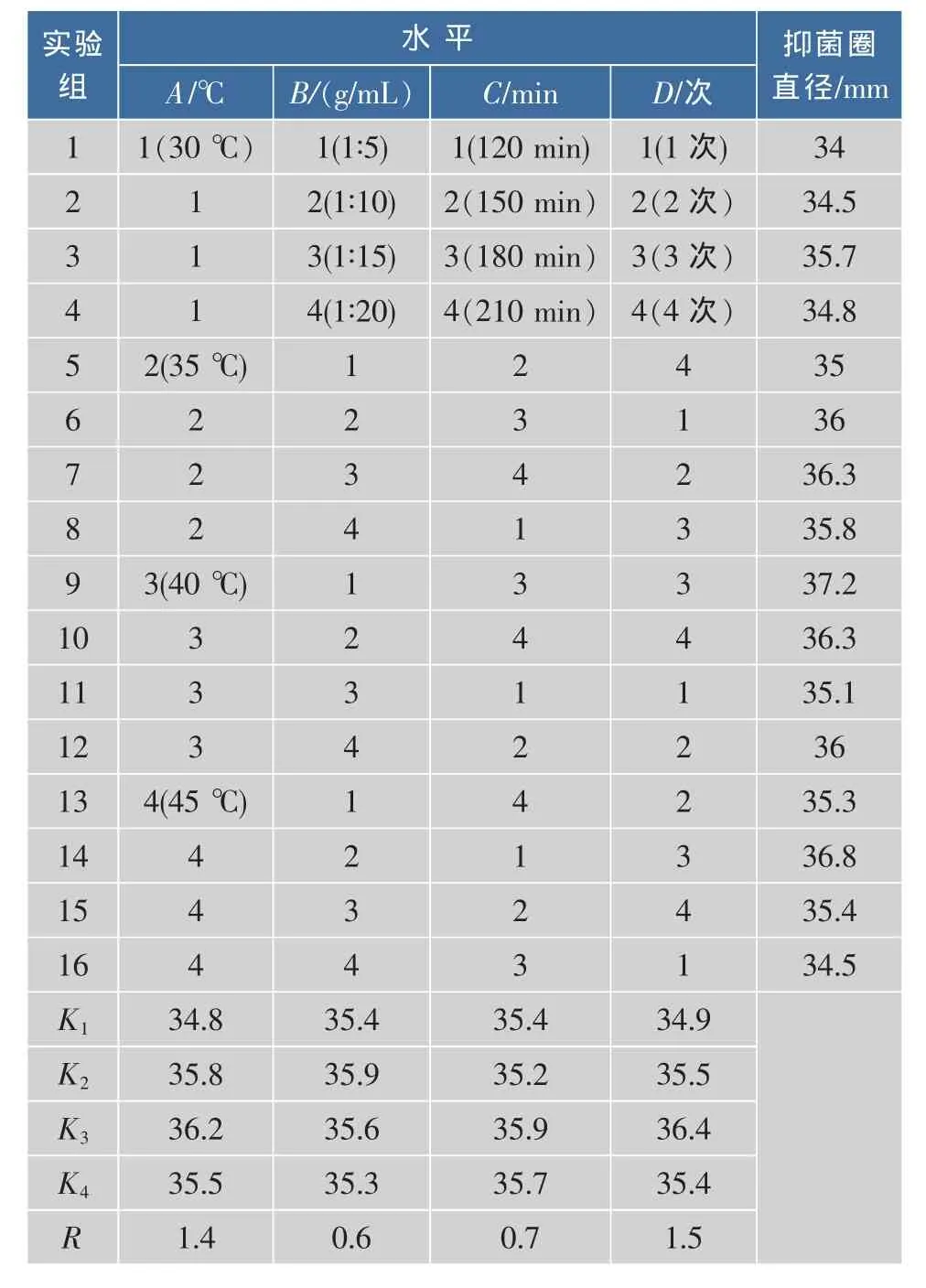
表1 L16(44)正交实验结果Table 1 Result of orthogonal test L16(44)
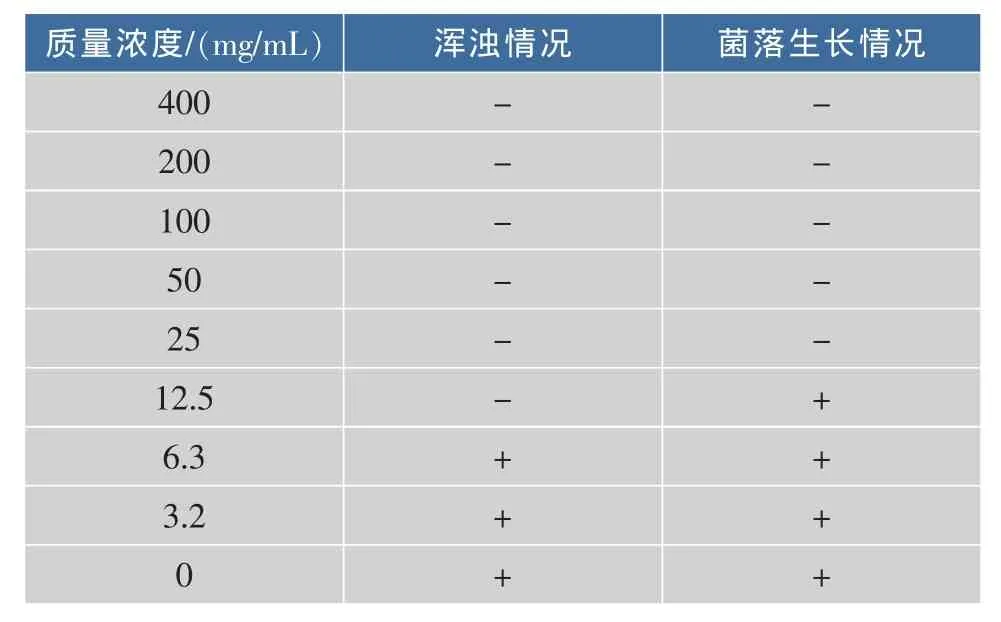
表2 大蒜粗提液的最小抑菌浓度与最小杀菌浓度实验结果Table 2 Result of MIC and MFC of antifungal substance
3 结语
通过对大蒜抗番茄晚疫病菌有效成分提取条件的研究,结果表明:大蒜提取液以体积分数30%乙醇作为提取溶剂,在40℃超声波辅助提取3 h,提取次数为3次,料液比为1∶5(g/mL),即得到大蒜提取液的抑菌效果最佳的提取条件。在此条件下大蒜提取液对番茄晚疫病菌的抑菌直径达到37.2 mm。大蒜提取液对番茄晚疫病菌最小抑菌质量浓度为12.5 mg/mL,最小杀菌质量浓度为25 mg/mL。由此可知,大蒜提取液的抑菌活性成分对番茄晚疫病菌有较强的抑制作用,科研成果为大蒜抑菌的深入研究与大蒜抑菌活性成分的开发利用提供了良好基础。
[1]李时珍.本草纲目[M].北京:农村读物出版社,1995:1-2.
[2]毕艳红.分子蒸馏技术分离提纯大蒜精油的研究[D].泰安:山东农业大学,2007.
[3]Huang T K.Handbook of Composition and Pharmacological Action of Commonly-used Traditional Chinese Medicines[M].Beijing:China Medice-Pharmaceutical Science and Technology Publishing House,1994:328-351.
[4]优质大蒜出口潜力大[N].农村实用技术与信息,2002-08-16.
[5]向枭,周兴华.大蒜素在水产动物营养中的作用[J].兽药与饲料添加剂,2000(2):15-16.XIANG Xiao,ZHOU Xinghua.The role of allicin in aquatic animal nutrition[J].Veterinary Pharmaceuticals&Feed Additives,2000(2):15-16.(in Chinese)
[6]江苏新医学院.中草药大词典[M].南京:江苏人民出版社,1978.
[7]贾江滨,刘静.大蒜化学成分研究进展[J].广东药学,1999,9(1):1-5.JIA Jiangbin,LIU Jing.The research of chemical composition of garlic[J].Guangdong Pharmaceutical Journal,1999,9(1):1-5.(in Chinese)
[8]孙桂林.大蒜生理活性物质的提取及其抗菌和抗黑色素癌细胞作用的研究[D].乌鲁木齐:新疆大学,2008.
[9]王海平.大蒜种质资源研究进展[J].中国蔬菜,2006(1):15-18.WANG Haiping.The research progress of garlic germplasm resources[J].Chinese Vegetables,2006(1):15-18.(in Chinese)
[10]Fernández-López J,Zhi N,Aleson-carbonell L,et al.Antioxidant and antibacterial activities of natural extracts:application in beef meatballs[J].Meat Science,2005,95:371-380.
[11]宋兴舜,宋凤杰,于广建.大蒜素对番茄三种真菌病害的影响[J].东北农业大学学报,2004,35(4):395-398.SONG Xingshun,SONG Fengjie,YU Guangjian.The effects of allicin on three kinds of tomato fungi diseases[J].Journal of Northeast Agricultural University,2004,35(4):395-398.(in Chinese)
[12]宋卫国.大蒜提取液有效成分抑菌活性及其作用机理研究[D].泰安:山东农业大学,2004.
[13]马穆英.大蒜抗真菌作用的研究[J].食品科学,1993(1):7-11.MA Muying.The research of garlic antifungal action[J].Food Science,1993(1):7-11.(in Chinese)
[14]李正英,张保军,陈忠军.杂交弧瓜中抑菌物质提取条件的优选[J].食品科学,2007,28(8):209-212.LI Zhengying,ZHANG Baojun,CHEN Zhongjun.The optimization extraction conditions of the hybrid arc melon antimicrobial substances[J].Food Science,2007,28(8):209-212.(in Chinese)

