GST-pulldown验证转录因子ZNF24与c-Myc的相互作用
赵靖凯,王聪,张籍鹏,厉建中
第二军医大学a.学员旅;b.药学院生化药学教研室;上海 200433
锌指蛋白作为一类转录因子,广泛地参与基因表达的调控。人类锌指蛋白基因ZNF24(又称ZNF191或KOX17)[1-2]由4 个外显子组成,编码包含368 个氨基酸残基的类Krüppel 蛋白。锌指蛋白或转录因子ZNF24的N端有富含亮氨酸(Leu)的SCAN结构域(又称LeR 结构域),C端有4个连续的典型的类Krüppel 锌指模体。Northern 印迹分析ZNF24的转录本,显示其在心脏、肝、肺和脾中大量存在,也存在于泌尿生殖组织(肾、睾丸、卵巢和前列腺)、淋巴组织(淋巴结、胸腺和扁桃体)、小肠和结肠中,在大脑中低水平存在[2-3]。我们通过绿色荧光蛋白(GFP)报告基因亚细胞定位实验,发现锌指蛋白ZNF24 定位于细胞核上,其核定位信号位于C 端第一和第二类Krüppel锌指区域[4]。锌指蛋白ZNF24能特异地与基因组内广泛存在的(TCAT)n四核苷酸重复序列结合[3]。体外酪氨酸羟化酶(tyrosine hydroxylase,TH)基因内含子Ⅰ上的TCAT 重复序列(微卫星HUMTH01)通过与ZNF24 的结合对TH基因的表达具有数量抑制效应[3-5],TH基因编码合成儿茶酚胺的限速酶;体外共转染实验表明,当HUMTH01 等位基因与胸苷激酶的最小启动子-报告基因融合时,ZNF24能促进其对报告基因表达的增强效应[3],暗示ZNF24 参与调控儿茶酚胺的合成。此外,在患神经精神病和心血管疾病的患者中发现儿茶酚胺能传递失调[3,6]。最近的研究表明,ZNF24 是少突胶质细胞的中枢神经系统髓鞘形成以及维持神经祖细胞分裂状态所必需的[7-8]。
小鼠锌指蛋白ZF-12(又称Zfp191,是ZNF24 的同源基因产物)与ZNF24有94%同源性,是人与小鼠SCAN 家族成员同源比对中一致性最高的蛋白[9]。ZF-12是Prost 等首先克隆得到的一个参与软骨分化的相关基因[10]。我们首次克隆了其全长基因组序列,发现其与锌指蛋白基因Zfp-35相连锁,位于18号染色体的B3-C 带上[11],同时还克隆了一个ZF-12假基因[12]。锌指蛋白ZF-12 在小鼠各种组织中广泛表达,小鼠多组织Northern 印迹分析表明,在发育过程中,小鼠ZF-12的mRNA 转录水平在胚胎期6.5~11 d 逐渐增加并达到最高水平,并在随后不同的发育阶段保持相对恒定[10,13]。这些研究暗示锌指蛋白ZF-12 除参与软骨分化外,还有其他重要的未阐明的生理功能。以人ZNF24为探针对大鼠的多组织Northern 印迹分析表明,ZF-12mRNA 在大鼠的大脑中也是低水平存在的,而在儿茶酚胺能组织(黑质、下丘脑和嗅球)中高水平存在,在纹状体、皮质和中脑中较低水平存在。令人感兴趣的是肾上腺(外周儿茶酚胺能组织)中也存在大量ZF-12mRNA。大鼠胚胎的整个头部存在高水平的ZF-12mRNA,暗示ZF-12 可能参与大脑的发育[3]。最近的研究表明,ZNF24 或ZF-12 为少突胶质细胞的中枢神经系统髓鞘形成及维持神经祖细胞分裂状态所必需[7-8];蛋白组学实验表明ZNF24 是DNA 复制因子[14]。但是,我们通过原核显微注射获得的ZNF24 转基因小鼠生长发育正常,未见明显的病理和行为改变[15]。另外,我们通过胚胎干细胞(ES 细胞)基因打靶获得了ZF-12+/-ES 细胞[16];通过囊胚腔显微注射获得的ZF-12+/-小鼠生长发育正常,而ZF-12-/-胚胎发育明显滞后,发育约7.5 d 的胚胎死亡[17]。令人感兴趣的是,小鼠胚胎早期发育过程中ZF-12 的表达主要集中于增殖区域[13],小干扰RNA(siRNA)下调ZF-12可显著抑制神经祖细胞增殖[8],这部分解释了ZF-12-/-胚胎死亡的原因。这些研究表明锌指蛋白ZNF24或ZF-12 具有重要的生理功能,暗示其参与调控不同的功能基因。我们通过基因过表达与siRNA 干扰结合基因芯片技术分析,发现ZNF24 参与激酶转录活性调控、血管增生、脑发育与DNA 损伤应答等,是多功能的因子[18]。最近,我们的酵母双杂交实验表明ZNF24 与组蛋白H2AZ 存在相互作用[19],其中另一阳性克隆编码c-Myc 蛋白。在此,我们利用GST-pulldown实验进一步验证ZNF24与c-Myc的相互作用。
1 材料与方法
1.1 材料
大肠杆菌DH5α、BL21(DE3)菌株,pcDNA3.1和pGEX-4T-2 载体由本实验室保存;氨苄西林(Amp)溶液(100 mg/mL)、卡那霉素(Kan)溶液(35 mg/mL)购自上海博光生物公司;质粒小量制备试剂盒购自爱思进生物技术(杭州)有限公司;琼脂糖凝胶DNA回收试剂盒购自天根生物技术(北京)有限公司;限制性内切酶、TaqDNA 聚合酶等工具酶及PCR 相关试剂购自TakaRa 公司;BCA 蛋白浓度测定试剂盒购自碧云天生物技术研究所;标准牛血清白蛋白(BSA)溶液及其他相关试剂由本实验室配制。
1.2 基因克隆
1.2.1ZNF24基因的克隆 查询NCBI 数据库中ZNF24的编码序列,选择其中的BglⅡ和XhoⅠ位点作为酶切位点,设计上游引物(5'-GGCAGATCTTC TGCACAGTCAGTGGAA-3')和下游引物(5'-GGCC TCGAGTTAAACTTTCACAACATTC-3'),交由上海生工生物技术有限公司合成。以HEK293 细胞的cDNA为模板,PCR扩增得到目的基因。
1.2.2c-Myc基因的克隆 查询NCBI 数据库中c-Myc的编码序列,选择其中的ApaⅠ和KpnⅠ位点作为酶切位点,设计上游引物(5'-ATTGGGCCCATGG ATTTTTTTCGGGTAGTGGA-3')和下游引物(5'-AT CGGTACCGACGCACAAGAGTTCCGTAGCTG-3'),交由上海生工生物技术有限公司合成。以HEK293细胞的cDNA为模板,PCR扩增得到目的基因。
1.3 载体构建
1.3.1 载体pGEX-4T-2-ZNF24 的构建ZNF24的PCR 产物和pGEX-4T-2 载体分别经BglⅡ和XhoⅠ双酶切,琼脂糖凝胶电泳分离,回收ZNF24目的片段和pGEX-4T-2 载体骨架片段,用T4DNA 连接酶将二者连接,随后用该体系转化感受态大肠杆菌DH5α得到pGEX-4T-2-ZNF24 载体,经酶切鉴定大小和方向正确后,DNA测序验证。
1.3.2 载体pcDNA3.1-c-Myc 的构建c-Myc的PCR 产物和pcDNA3.1 载体分别经ApaⅠ和KpnⅠ双酶切,琼脂糖凝胶电泳分离,回收c-Myc目的片段和pcDNA3.1 载体骨架片段,用T4DNA 连接酶将二者连接,转化感受态大肠杆菌DH5α得到pcDNA3.1-c-Myc载体,经酶切鉴定大小和方向正确后,DNA 测序验证。
1.4 融合蛋白的表达与纯化
1.4.1 GST-ZNF24 融合蛋白的原核表达与纯化 将构建的重组质粒pGEX-4T-2-ZNF24 转化大肠杆菌BL21(DE3)菌株,挑取单个克隆到装有5 mL LB(含100μg/mL Amp)的10 mL 试管里,37℃培养过夜;将培养菌液转移到装有500 mL LB(含100μg/mL Amp)的1 L 锥形瓶中,37℃、225 r/min 振荡培养至D600nm值为1.0~1.5,加入IPTG(终浓度1 mmol/L),28℃培养8 h,6000 r/min 离心10 min,4℃离心收集细菌,弃上清,将菌体沉淀于-20℃放置;室温冻融菌体,马上置于冰上,每500 mL培养液加入10~20 mL细菌裂解液(PBS+1% Triton-100+PMSF),吹打混匀,冰上超声波破碎(开2 s,停9 s,40~60 min)至裂解液变清,11 000 r/min 离心15 min,4℃离心分离上清,-80℃保存备用。
1.4.2 c-Myc 融合蛋白的真核表达与纯化 将编码c-Myc 蛋白的碱基序列克隆到编码标签蛋白的真核表达载体pcDNA3.1上,进行细胞转染后,常规表达、纯化。
1.5 GST-pulldown实验
取适量融合蛋白GST-ZNF24 于冰上冻融;取50~70μL GST-beads(Immobilized Glutathione)到EP 管中,用800μL PBS+1% Triton-100 润洗一次,将冻融融合蛋白GST-ZNF24 与之混匀,4℃层析柜中旋转结合1 h,用PBS+1% Triton-100 洗3 次,PBS洗3 次,留取20μL(PBS+beads)作为Offer。裂解真核融合蛋白c-Myc,弃培养基,用PBS 洗一次,加入300μL 裂解液(以6 孔为例,PBS+1% Triton-100+Cocktaier),4℃放置30 min,吹打收集至1.5 mL EP管中,超声波破碎,13 000 r/min 离心15 min,4℃离心取上清,BCA 蛋白定量(optional)留取20μL 作为Offer,其余样品加入已纯化蛋白的EP 管中,用PBS补足600μL,以便蛋白之间能充分结合,4℃旋转结合。用PBS+1% Triton-100 洗3 次,PBS 洗3 次。40μL 5×上样缓冲液溶解beads上的蛋白,煮沸3 min,高速离心,行SDS-PAGE,Western印迹检测。
2 结果
2.1 pGEX-4T-2-ZNF24的构建与鉴定
按照前述方法,通过PCR 扩增获得ZNF24的PCR产物和pGEX-4T-2载体,分别经BglⅡ和XhoⅠ双酶切,ZNF24条带约为1.1 kb,pGEX-4T-2 条带约为4.5 kb,均符合预期(图1)。经连接和转化感受态DH5α细胞,得到pGEX-4T-2-ZNF24 载体,经BglⅡ和XhoⅠ双酶切后行琼脂糖凝胶电泳,结果如图2,较大片段为pGEX-4T-2 载体骨架,较小片段为ZNF24,均符合预期。DNA 测序(序列未示)表明与GenBank 中的ZNF24基因序列一致性高达99%,其读框符合预期。
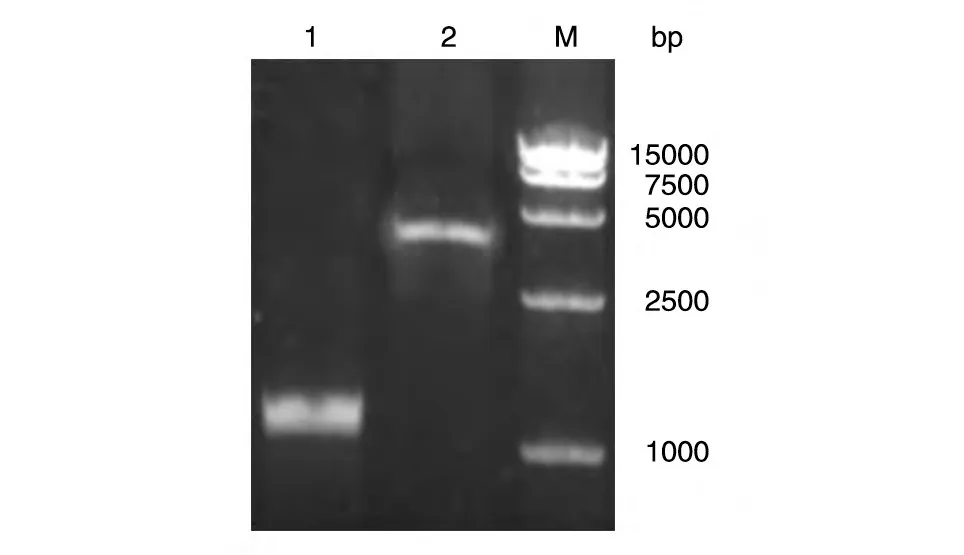
图1 ZNF24和pGEX-4T-2的BglⅡ、XhoⅠ双酶切
2.2 pcDNA3.1-c-Myc的构建与鉴定
按照前述方法,通过PCR 扩增获得c-Myc的PCR 产物和pcDNA3.1 载体,分别经ApaⅠ和KpnⅠ双酶切,c-Myc条带约为1.5 kb,pcDNA3.1 条带约为5.4 kb,均符合预期(图3)。经连接和转化感受态DH5α细胞,得到pcDNA3.1-c-Myc 载体,经ApaⅠ和KpnⅠ双酶切后行琼脂糖凝胶电泳,结果如图4,较大片段为pcDNA3.1 载体骨架,较小片段为c-Myc,均符合预期。DNA 测序(序列未示)表明与GenBank中的c-Myc基因序列一致性高达99%,其读框符合预期。
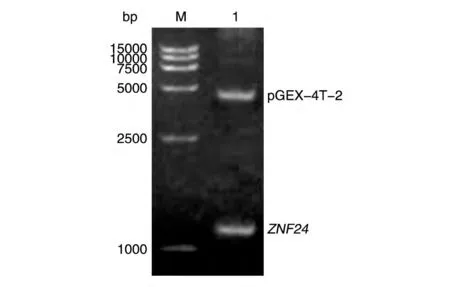
图2 BglⅡ和XhoⅠ双酶切pGEX-4T-2-ZNF24
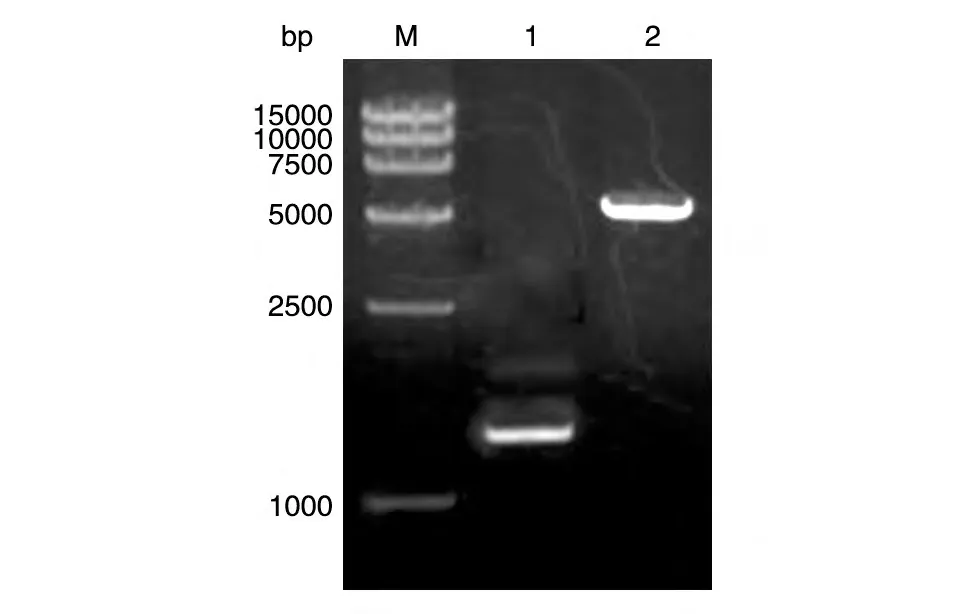
图3 c-Myc和pcDNA3.1的ApaⅠ、KpnⅠ双酶切
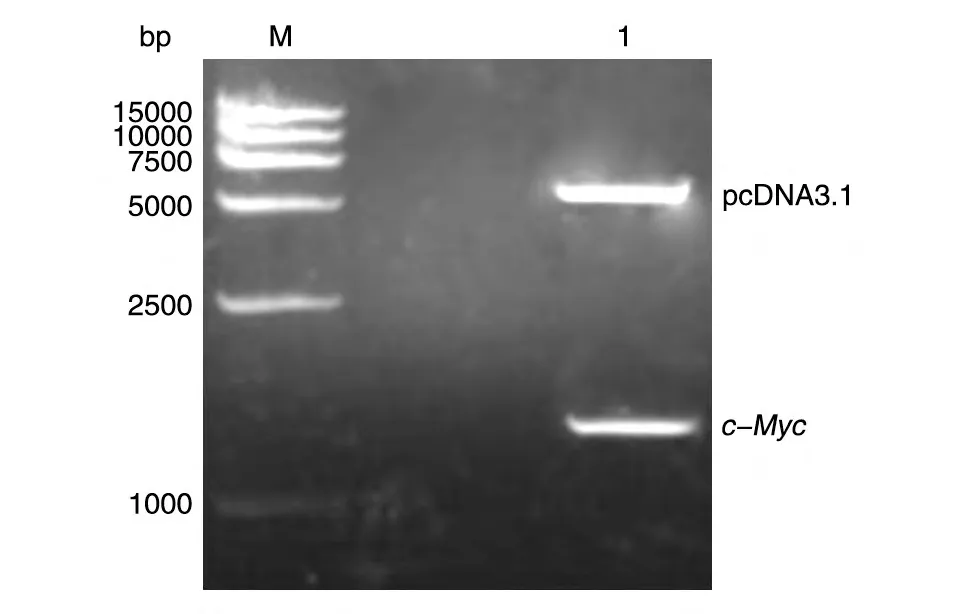
图4 ApaⅠ和KpnⅠ双酶切pcDNA3.1-c-Myc
2.3 重组蛋白ZNF24的诱导表达
用经测序验证正确的pGEX-4T-2-ZNF24 重组质粒转化大肠杆菌BL21(DE3)菌株,在28℃条件下用IPTG 诱导培养8 h,获得的蛋白与推测的融合蛋白大小相符。取适量表达菌液培养上清进行SDSPAGE,结果如图5,加入IPTG 诱导后pGEX-4T-2-ZNF24表达了目的蛋白。
2.4 GST-pulldown
采用GST-pulldown 验证原核融合蛋白GSTZNF24 与真核融合蛋白c-Myc 的体外相互作用。原核融合蛋白GST-ZNF24 与GST-beads 结合,经层析纯化后,再将真核融合蛋白c-Myc 的细胞裂解液与GST-ZNF24充分结合,用上样缓冲液将结合在GSTbeads 上的蛋白溶解,样品处理后进行SDS-PAGE,用Western 印迹检测,结果如图6,泳道1为ZNF24与c-Myc 结合后相互作用的条带,所用一抗为抗c-Myc;泳道2所加样品为GST空载体表达蛋白;泳道3为GST-ZNF24蛋白,所用一抗为抗ZNF24;泳道4所加样品为GST 空载体表达蛋白,不结合c-Myc 蛋白,无条带。
3 讨论

图5 SDS-PAGE分析pGEX-4T-2-ZNF24的诱导表达

图6 GST-pulldown验证ZNF24与c-Myc的体外相互作用
ZNF24定位于染色体18q12.1[2],该区域的缺失常在人类多种肿瘤中被发现,如浸润性乳腺癌[20]、结肠癌[21-22]、胃贲门腺癌[23]、睾丸生殖细胞瘤[24]、造血恶性肿瘤[25]等。此外,ZNF24mRNA在卵巢恶性肿瘤、结肠癌和乳腺癌组织中的表达显著下调[26-27]。这些结果提示ZNF24可能参与乳腺癌结肠癌等肿瘤的发生或发展的负调控。有文献报道了ZNF24与血管内皮生长因子(VEGF)表达的负相关性:人结肠癌和乳腺癌组织中ZNF24基因表达水平与其癌旁组织相比显著下调而VEGF表达显著上调;ZNF24的过表达导致VEGF表达下调,而用siRNA干扰沉默ZNF24导致VEGF表达上调;ZNF24与VEGF启动子报告基因共转染MDA-MB-231乳腺瘤细胞导致VEGF启动子活性显著下调[26,28]。在CHO和NIH3T3 细胞中,锌指蛋白ZNF24 具有GAL4 启动子转录抑制活性[2]。这些结果提示ZNF24 参与VEGF 的负调控[26,28]。同样,我们通过ZNF24过表达与siRNA 干扰实验,发现ZNF24 参与血小板衍生生长因子受体β(PDGFR-β)的转录抑制[29]。另有研究证明,c-Myc与雌激素受体α(ERα)相邻结合于VEGF启动子上,参与VEGF 的雌激素调控[30];c-Myc 可通过促进VEGFmRNA 的翻译起始,从而提高VEGF 的蛋白表达水平[31];c-Myc可抑制VEGF、PDGFR-β的表达[30,32-34];c-Myc 参与PDGFR-β的转录抑制[33];VEGF、c-Myc和PDGFR-β的高表达与多种肿瘤相关[35-36]。本研究结果表明ZNF24与c-Myc 相互作用。另外,我们分析了VEGF与PDGFR-β的启动子序列,都不存在ZNF24特异结合的(TCAT)n重复序列,这提示ZNF24 可能是通过与c-Myc 相互作用实现其对VEGF、PDGFR-β的转录抑制。
[1]厉建中,李坚,傅继梁.锌指蛋白基因ZNF191[J].生命的化学,2001,21(2):116-117.
[2]Han Z G,Zhang Q H,Ye M,et al.Molecular cloning of six novel Krüppel-like zinc finger genes from hematopoietic cells and identification of a novel transregulatory domain KRNB[J].J Biol Chem,1999,274(50):35741-35748.
[3]Albanese V,Biguet N F,Kiefer H,et al.Quantitative effects on gene silencing by allelic variation at a tetranucleotide microsatellite[J].Hum Mol Genet,2001,10(17):1785-1792.
[4]Li J Z,Chen X,Gong X L,et al.Identification of a functional nuclear localization signal mediating nuclear import of the zinc finger transcription factor ZNF24[J].PLoS One,2013,8(11):e79910.
[5]Meloni R,Biguet N F,Mallet J.Post-genomic era and gene discovery for psychiatric diseases:there is a new art of the trade? The example of the HUMTH01 microsatellite in the tyrosine hydroxylase gene[J].Mol Neurobiol,2002,26(2-3):389-403.
[6]Rodriguez S,Huang S,Chen X H,et al.A study of TH01 and IGF2-INS-TH haplotypes in relation to smoking initiation in three independent surveys[J].Pharmacogenet Genomics,2006,16(1):15-23.
[7]Sillars-Hardebol A H,Carvalho B,de Wit M,et al.Identification of key genes for carcinogenic pathways associated with colorectal adenoma-to-carcinoma progression[J].Tumour Biol,2010,31(2):89-96.
[8]Khalfallah O,Ravassard P,Lagache C S,et al.Zinc finger protein 191(ZNF191/Zfp191) is necessary to maintain neural cells as cycling progenitors[J].Stem Cells,2009,27(7):1643-1653.
[9]Edelstein L C,Collins T.The SCAN domain family of zinc finger transcription factors[J].Gene,2005,359:1-17.
[10]Prost J F,Negre D,Cornet-Javaux F,et al.Isolation,cloning,and expression of a new murine zinc finger encoding gene[J].Biochim Biophys Acta,1999,1447(2-3):278-283.
[11]厉建中,陈霞,王水良,等.小鼠锌指蛋白基因ZF-12的克隆与基因结构以及5'端启动子活性的分析[J].遗传学报,2003,30(4):311-316.
[12]厉建中,张亚洲,王水良,等.一个与小鼠锌指蛋白基因ZF-12相关的假基因的克隆和鉴定[J].实验生物学报,2002,35(2):127-133.
[13]Khalfallah O,Faucon-Biguet N,Nardelli J,et al.Expression of the transcription factor Zfp191 during embryonic development in the mouse[J].Gene Expr Patterns,2008,8(3):148-154.
[14]Lopez-Contreras A J,Ruppen I,Nieto-Soler M,et al.A proteomic characterization of factors enriched at nascent DNA molecules[J].Cell Rep,2013,3(4):1105-1116.
[15]Li J Z,Chen X,Yang H,et al.Establishment of transgenic mice carrying gene encoding human zinc finger protein 191[J].World J Gastroenterol,2004,10(2):264-267.
[16]厉建中,杨桦,傅继梁.小鼠锌指蛋白基因ZF-12 基因剔除的ES细胞系的建立[J].遗传学报,2002,29(10):860-864.
[17]Li J,Chen X,Yang H,et al.The zinc finger transcription factor 191 is required for early embryonic development and cell proliferation[J].Exp Cell Res,2006,312(20):3990-3998.
[18]Li J,Chen X,Gong X,et al.A transcript profiling approach reveals the zinc finger transcription factor ZNF191 is a pleiotropic factor[J].BMC Genomics,2009,10:241.
[19]Li J,Chen X,He J,et al.A yeast two-hybrid screen identifies histone H2A.Z as a transcription factor ZNF24 interactor[J].J Cell Biochem,2012,113(11):3411-3418.
[20]Richard F,Pacyna-Gengelbach M,Schluns K,et al.Patterns of chromosomal imbalances in invasive breast cancer[J].Int J Cancer,2000,89(3):305-310.
[21]Kern S E,Fearon E R,Tersmette K W,et al.Clinical and pathological associations with allelic loss in colorectal carcinoma [corrected][J].JAMA,1989,261(21):3099-3103.
[22]Vogelstein B,Fearon E R,Hamilton S R,et al.Genetic alterations during colorectal-tumor development[J].N Engl J Med,1988,319(9):525-532.
[23]van Dekken H,Alers J C,Riegman P H,et al.Molecular cytogenetic evaluation of gastric cardia adenocarcinoma and precursor lesions[J].Am J Pathol,2001,158(6):1961-1967.
[24]Skotheim R I,Kraggerud S M,Fossa S D,et al.Familial/bilateral and sporadic testicular germ cell tumors show frequent genetic changes at loci with suggestive linkage evidence[J].Neoplasia,2001,3(3):196-203.
[25]Tune C E,Pilon M,Saiki Y,et al.Sustained expression of the novel EBV-induced zinc finger gene,ZNFEB,is critical for the transition of B lymphocyte activation to oncogenic growth transformation[J].J Immunol,2002,168(2):680-688.
[26]Harper J,Yan L,Loureiro R M,et al.Repression of vascular endothelial growth factor expression by the zinc finger transcription factor ZNF24[J].Cancer Res,2007,67(18):8736-8741.
[27]张慧,崔英,余龙.ZNF191 mRNA在卵巢恶性肿瘤中的表达及临床意义[J].第二军医学学报,2003,24(12):1381-1382.
[28]Jia D,Hasso S M,Chan J,et al.Transcriptional repression of VEGF by ZNF24:mechanistic studies and vascular consequences in vivo[J].Blood,2013,121(4):707-715.
[29]Li J,Chen X,Liu Y,et al.The transcriptional repression of platelet-derived growth factor receptor-beta by the zinc finger transcription factor ZNF24[J].Biochem Biophys Res Commun,2010,397(2):318-322.
[30]Dadiani M,Seger D,Kreizman T,et al.Estrogen regulation of vascular endothelial growth factor in breast cancer in vitro and in vivo:the role of estrogen receptor alpha and c-Myc[J].Endocr Relat Cancer,2009,16(3):819-834.
[31]Mezquita P,Parghi S S,Brandvold K A,et al.Myc regulates VEGF production in B cells by stimulating initiation of VEGF mRNA translation[J].Oncogene,2005,24(5):889-901.
[32]Yang W,Wetterskog D,Matsumoto Y,et al.Kinetics of repression by modified p53 on the PDGF beta-receptor promoter[J].Int J Cancer,2008,123(9):2020-2030.
[33]Uramoto H,Hackzell A,Wetterskog D,et al.pRb,Myc and p53 are critically involved in SV40 large T antigen repression of PDGF beta-receptor transcription[J].J Cell Sci,2004,117(17):3855-3865.
[34]Izumi H,Molander C,Penn L Z,et al.Mechanism for the transcriptional repression by c-Myc on PDGF beta-receptor[J].J Cell Sci,2001,114(8):1533-1544.
[35]Kuwai T,Nakamura T,Sasaki T,et al.Targeting the EGFR,VEGFR,and PDGFR on colon cancer cells and stromal cells is required for therapy[J].Clin Exp Metastasis,2008,25(4):477-489.
[36]George D.Platelet-derived growth factor receptors:a therapeutic target in solid tumors[J].Semin Oncol,2001,28(5 Suppl 17):27-33.

