CCR7基因修饰的未成熟树突状细胞在大鼠高危角膜移植免疫排斥反应中的作用△
周琨 高晓唯 蔡岩 李文静 胡裕坤 田丽丽 付燕
各种原因所致的角膜混浊是眼科常见的致盲眼病,角膜移植术是角膜盲患者复明的主要手段。虽然角膜移植有很高的手术成功率,但是穿透性角膜移植术后排斥反应的发生率仍然较高,而术后免疫排斥反应是角膜移植失败的最主要原因[1]。尤其在高危角膜移植,术后免疫排斥反应发生率高达65%[2-3]。角膜移植术后免疫排斥反应的预防和治疗已成为目前眼科领域亟待解决的问题。
树突状细胞(dendritic cells,DC)作为主要的抗原递呈细胞(antigen presenting cells,APC),其诱导免疫耐受已成为器官移植领域的研究热点,如角膜移植、心脏移植、肾脏移植等[4]。根据 DC在免疫反应中的作用和成熟状态不同分为:成熟树突状细胞(mature dendritic cells,mDC)和未成熟树突状细胞(immature dendritic cells,imDC),mDC 刺激免疫应答,而imDC介导特异性的免疫耐受。趋化因子受体7(chemokine receptor 7,CCR7)在趋化 DC从外周组织迁移至次级淋巴器官中起关键作用[5-6]。本研究利用CCR7及imDC的特点,将含大鼠CCR7基因的腺病毒转染修饰imDC,输入受体体内,观察其对大鼠高危角膜移植免疫排斥反应的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 受体为健康清洁级 SD大鼠60只,供体为健康清洁级Wistar大鼠30只,受、供体均为雄性,6~8周龄,体质量180~220 g,购于新疆医科大学实验动物中心。所有动物喂养和实验过程符合ARVO有关用于研究目的实验动物的相关规定。1.1.2 主要试剂 重组大鼠白细胞集落刺激因子(rrGM-CSF)、重组大鼠白细胞介素-4(rrIL-4)(美国Peprotech公司);RPMI-1640培养液、胎牛血清(美国Gibco公司);Anti-CCR7抗体(英国 Abcam公司);Ad-CCR7-EGFP 溶液:滴度 36×109PFU·mL-1、Ad-EGFP溶液:滴度 0.195×1012PFU·mL-1均购自广州赛业生物科技有限公司。
1.2 方法
1.2.1 动物分组及处理 以60只 SD大鼠作为受体,30只Wistar大鼠作为供体,碱烧伤建立同种异体高危角膜移植模型。根据不同的处理,受体随机分为4组,每组15只:(1)空白对照组:受体注入磷酸盐缓冲溶液(PBS);(2)未修饰imDC组:受体注入供者源imDC;(3)imDC+腺病毒空载体组(imDC+Ad组):受体注入空载体修饰的供者源 imDC;(4)imDC+CCR7腺病毒组(imDC+Ad-CCR7组):受体注入CCR7基因修饰的供者源imDC。各组均于角膜移植术前7 d及术后3 d经尾静脉注入受体体内(每只10×106个细胞悬浮于0.1 mL PBS液中,空白对照组只注入等量PBS液)。
1.2.2 大鼠骨髓源DC的培养 参照文献[7]的方法取Wistar大鼠骨髓进行imDC的培养,细胞培养6 d即为imDC。
1.2.3 携带大鼠CCR7基因的重组腺病毒转染im-DC 采用文献报道的离心法增强腺病毒转染im-DC[8],空白对照组为腺病毒空载体。腺病毒转染48 h后收集imDC。通过电镜和流式细胞仪对imDC及转染后的imDC进行形态学和表型鉴定。
1.2.4 细胞免疫荧光检测 CCR7的表达 采用激光共聚焦显微镜观察imDC及转染Ad空载体和Ad-CCR7腺病毒后CCR7的表达情况。取培养好的im-DC 细胞悬液,分别经 40 g·L-1多聚甲醛、1 g·L-1Triton、体积分数10%山羊血清、一抗(兔源性单克隆抗体CCR7,1∶250稀释,阴性对照以 PBS代替一抗)、二抗(Tritc标记抗兔 IgG,1∶100稀释)及10 mg·L-1DAP染色剂I处理,少量PBS重悬细胞,将细胞悬液滴加在多聚赖氨酸包被的载玻片上,盖上盖玻片后立即用激光共聚焦显微镜观察。
1.2.5 大鼠高危角膜移植模型的建立 参照文献[7]的方法,碱烧伤诱导角膜新生血管,待4个象限新生血管均长入角膜中央时作为高危受体进行角膜移植;参照 Williams等[9]方法建立大鼠同种异体穿透性角膜移植模型,术前充分散瞳,用直径3.5 mm环钻在角膜中央钻取植片,直径3.0 mm环钻制作受体植床,10-0尼龙线间断缝合8针。
1.2.6 术后观察及评分标准 自术后第1天起受体大鼠每天在裂隙灯下观察,参照Larkin等[10]的评分标准,以混浊、水肿和新生血管3项作为指标,由2人同时观察并评分,3项评分之和为当日的排斥反应指数(rejection index,RI),当 RI≥5分时或植片混浊一项达到3级时视为排斥反应发生。
1.2.7 排除标准 由于手术因素造成感染、前房出血、前房消失或术后5 d内发生严重的角膜植片水肿、混浊或破坏以及白内障者,予以剔除,并及时补充实验动物。
1.2.8 角膜植片病理组织学观察 于术后14 d各组随机抽出5只大鼠处死,迅速摘除术眼取其完整角膜植片,放于40 g·L-1多聚甲醛中固定24 h,逐级脱水、置换,浸蜡,石蜡包埋后切片,行常规 HE染色。
1.3 统计学方法 应用统计分析软件SPSS 17.0进行数据处理,数据采用表示,组间比较采用单因素方差分析和进一步的LSD-t检验,若数据不符合正态分布则采用四分位数间距表示,组间比较采用非参数检验;以P<0.05为差异有统计学意义。
2 结果
2.1 imDC及CCR7重组腺病毒和空载体腺病毒转染后imDC的形态学和表型鉴定
2.1.1 形态学 扫描电镜观察见imDC呈球形或类球形,表面凹凸不平,突起较少;imDC转染CCR7重组腺病毒和空载体腺病毒后,其表面的树枝状突起较imDC增多(图1)。
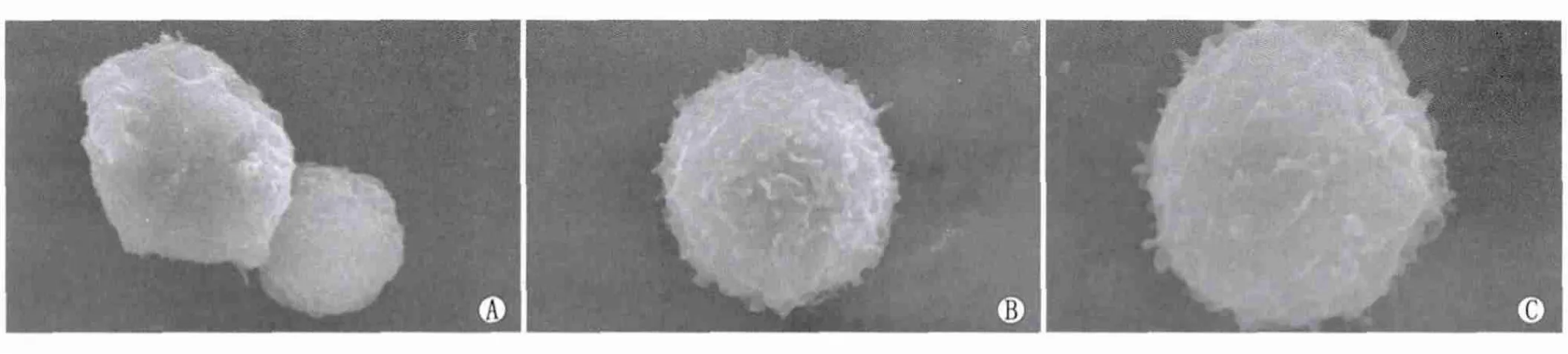
Figure 1 Observation of imDC under scanning electron microscope.A:imDC group(×10 000);B:imDC+Ad group(×10 000);C:imDC+Ad-CCR7 group(×14 000)imDC扫描电镜观察。A:imDC组(×10 000);B:imDC+Ad组(×10 000);C:imDC+Ad-CCR7组(×14 000)
2.1.2 表型 流式细胞术鉴定结果 imDC:高表达OX62(76.6%),低表达 MHC-Ⅱ (36.8%)、CD80(29.2%)、CD86(32.0%)。腺病毒转染后 48 h,im-DC+Ad 组中 OX62、MHC-Ⅱ、CD80、CD86 的阳性率分别为 78.8%、38.9%、32.4%、34.3%。imDC+Ad-CCR7 组中 OX62、MHC-Ⅱ、CD80、CD86 的阳性率分别为 79.1% 、41.4% 、32.5% 、35.9% 。
2.2 细胞免疫荧光检测CCR7的表达 细胞免疫荧光显示imDC不表达CCR7,imDC转染空载体腺病毒后不表达CCR7,imDC转染CCR7腺病毒后CCR7表达增加(图2)。

Figure 2 Expression of CCR7 by laser confocal microscope(×400).A:imDC group;B:imDC+Ad group;C:imDC+Ad-CCR7 group 激光共聚焦显微镜观察CCR7的表达(×400)。A:imDC组;B:imDC+Ad组;C:imDC+Ad-CCR7组
2.3 角膜植片存活时间比较 角膜植片存活时间:空白对照组(10.44±1.88)d,imDC 组(16.00±2.18)d,imDC+Ad 组(15.11±2.03)d,imDC+Ad-CCR7组(23.67±2.83)d;4组间差异有统计学意义(F=53.005,P=0.000)。与空白对照组相比,imDC组、imDC+Ad组、imDC+Ad-CCR7组角膜植片的存活时间均明显延长(均为 P<0.01);imDC+Ad-CCR7组较imDC组与imDC+Ad组均明显延长(均为P<0.01);imDC组与imDC+Ad组相比较差异无统计学意义(P >0.05)。
2.4 角膜植片评分比较 术后14 d空白对照组、imDC组、imDC+Ad组和imDC+Ad-CCR7组角膜植片的混浊(F=7.100,P=0.001)、水肿(F=7.998,P=0.000)、新生血管程度(F=7.467,P=0.000)及RI(F=7.739,P=0.000)评分比较,差异均有统计学意义;与空白对照组相比,imDC组、imDC+Ad组和imDC+Ad-CCR7组角膜植片评分均明显降低(均为 P<0.05);与 imDC组和 imDC+Ad组相比,imDC+Ad-CCR7组角膜植片评分明显降低,差异均有统计学意义(均为 P<0.05);imDC组和 imDC+Ad组角膜植片评分差异无统计学意义(P>0.05)。
2.5 HE染色 大鼠高危角膜移植术后14 d,空白对照组角膜植片显著水肿增厚,角膜上皮细胞肥厚,基质层板层纤维结构紊乱,可见大量炎性细胞浸润及粗大的新生血管;imDC组植片中度水肿,基质层板层纤维结构轻度紊乱,有炎性细胞浸润,少量细小的新生血管形成;imDC+Ad组较imDC组水肿严重,基质层板层纤维结构紊乱及炎性细胞浸润度较imDC组严重,有少量新生血管形成;imDC+Ad-CCR7组植片轻度水肿,角膜上皮细胞基本正常,基质层板层纤维排列整齐,仅有少量炎性细胞浸润,少见新生血管形成(图3)。

Figure 3 Graft stained by HE in different groups(×200).A:Control group;B:imDC group;C:imDC+Ad group;D:imDC+Ad-CCR7 group 角膜移植术后14 d各组植片HE染色(×200)。A:空白对照组;B:imDC组;C:imDC+Ad组;D:imDC+Ad-CCR7组
3 讨论
同种异体角膜移植术是目前同种异体组织移植中成功率最高的手术之一,但免疫排斥反应仍是角膜移植面临的重要挑战,在局部或全身应用免疫抑制剂的情况下,高危角膜移植术后角膜植片的存活率仍小于35%[11]。因此,抑制角膜移植排斥反应是角膜移植的核心问题。
DC虽在体内的数量较少,但其抗原递呈能力远强于巨噬细胞、B细胞等其他APC[12],对于诱导机体初始免疫应答尤为重要。DC摄取处理周围环境中的抗原性物质,迁移至淋巴系统递呈给T淋巴细胞,从而发挥免疫学效应。CCR7主要在幼稚T细胞、B细胞及树突状细胞等免疫细胞表面表达,在DC迁移过程中逐渐增多[13]。研究发现,imDC未检测到CCR7的表达,mDC胞膜上CCR7表达上调,只有在CCR7快速增殖并同趋化因子结合之后,捕获抗原的DC才能迁移至淋巴系统从而刺激免疫应答[6]。有研究表明,通过诱导细胞迁移并进入淋巴器官,CCR7有助于免疫耐受的发生[14]。
本实验根据CCR7及imDC的生物学特性,用含CCR7基因的腺病毒转染修饰imDC,诱导imDC表达CCR7蛋白,使其具有迁移特性,将其通过静脉于术前输入受体体内,对高危角膜移植受体进行预处理,以期诱导受体对移植角膜产生特异性的免疫耐受而保持正常的免疫功能。
本实验通过体外培养得到大量imDC,通过电镜和流式细胞仪确定其在形态和表型上均符合典型的imDC特征,表明所培养和诱导的细胞为实验所需的细胞。我们对空载体和CCR7基因腺病毒转染后的imDC重新鉴定,发现转染后的imDC树枝状突起增多,表面分子阳性表达略微升高,说明转染过程可能导致imDC趋于成熟,如何抑制转染后imDC的成熟本课题组将深入研究。
通过对 imDC、imDC+Ad和 imDC+Ad-CCR7进行激光共聚焦观察发现,imDC和imDC+Ad不表达CCR7蛋白,imDC+Ad-CCR7表达CCR7蛋白增加,表明CCR7基因有效转入imDC且可表达蛋白。
本实验结果表明,与空白对照组相比,imDC组、imDC+Ad组和imDC+Ad-CCR7组角膜植片存活时间明显延长,表明不同状态的imDC通过静脉输注给受体,均可使其处于免疫低应答状态,延缓受体对移植物的免疫排斥,延长移植物的存活时间。imDC+Ad-CCR7组较imDC+Ad组存活时间明显延长(P<0.01),表明供者源imDC在转染CCR7腺病毒后,诱导免疫耐受的能力增强,可明显提高角膜植片存活时间;imDC组与imDC+Ad组比较差异无统计学意义(P>0.05),表明imDC转染空载体后,诱导免疫耐受的能力并未提高。然而,CCR7基因修饰的im-DC是通过什么机制诱导移植物的免疫耐受目前尚不清楚,本课题组将在以后的研究中深入探讨其诱导免疫耐受的相关机制,为其在角膜移植的临床应用中提供一定的基础。
1 奚瑾,潘志强,接英,刘丽敏,王立.CD4+CD25+调节性 T细胞参与大鼠角膜移植免疫耐受的研究[J].中华眼科杂志,2007,43(12):1114-1118.
2 Yildiz EH,Hoskins E,Fram N,Rapuano CJ,Hammersmith KM,Laibson PR,et al.T hird or greater penetrating keratoplasties:indications,survival,and visual outcomes[J].Cornea,2010,29(3):254-259.
3 Shi W,Chen M,Xie L,Liu M,Gao H,W ang T ,et al.A novel cyclosporine a drug-delivery system for prevention of human corneal rejection after high-risk keratoplasty:a clinical study[J].Ophthalmology,2013,120(4):695-702.
4 M oreau A,Varey E,Bouchet-Delbos L,Cuturi M C.Cell therapy using tolerogenic dendritic cells in transplantation[J].Transplant Res,2012,1(1):13-17.
5 Randolph GJ,Angeli V,Swartz M A.Dendritic cell trafficking to lymph nodes through lymphatic vessels[J].Nat Rev Immunol,2005,5(8):617-628.
6 Pan M R,Hou M F,Chang HC,Hung W C.Cyclooxygenase-2 upregulates CCR7 via EP2/EP4 receptor signaling pathways to enhance lymphatic invasion of breast cancer cells[J].J Biol Chem,2008,283(17):11155-11163.
7 付燕,高晓唯,李文静,杜安杰,李霞,赵旭东.未成熟树突状细胞在大鼠高危角膜移植免疫排斥反应中的作用[J].眼科新进展,2013,33(2):130-134.
8 Nishimura N,Nishioka Y,Shinohara T,Ogawa H,Yamamoto S,T ani K,et al.Novel centrifugal method for simple and highly efficient adenovirus-mediated green fluorescence protein gene transduction into human monocyte-derived dendritic cells[J].J Immunol Methods,2001,253(1-2):113-124.
9 W illiams KA,Coster DJ.Penetrating corneal transplantation in the inbred rat:a new model[J].Invest Ophthalmol Vis Sci,1985,26(1):23-30.
10 Larkin DF,Calder VL,Lightman SL.Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection[J].Clin Exp Immunol,1997,107(2):381-391.
11 Niederkorn JY.T he immune privilege of corneal grafts[J].J Leukoc Biol,2003,74(2):167-171.
12 Inaba K,Inaba M,Deguchi M,Hagi K,Yasumizu R,Ikehara S,et al.Granulocytes,macrophages,and dendritic cells arise from a common major histocompatibility complex classⅡ-negative progenitor in mouse bone marrow[J].Proc Natl Acad Sci USA,1993,90(7):3038-3042.
13 Sallusto F,Geginat J,Lanzavecchia A.Central memory and effector memory T cells subsets:function,generation,and maintenance[J].Annu Rev Immunol,2004,22(7):745-763.
14 Forster R,Davalos-M isslitz AC,Rot A.CCR7 and its ligands:bal ancing immunity and tolerance[J].Nat Rev Immunol,2008,8(5):362-371.