肉毒杆菌B诱导大鼠干眼模型中泪腺Lacritin蛋白表达的研究△
高伟 程燕 吴洁 王亮 赵帅
随着人民生活环境的不断改变,干眼症的发病率不断增加,并有年轻化的倾向。有研究表明[1],55岁以上的人群中干眼症发病率高达10%~20%。引起干眼症的病因很多,其发病机制十分复杂。近年来,对于干眼症的研究也逐渐增多,动物模型的建立对干眼症的研究起到重要的基础作用,而炎症模型的建立更为重要。我们利用肉毒杆菌B诱导大鼠建立干眼炎症模型,通过观察Lacritin蛋白表达变化为干眼症的诊治提供实验基础。
1 材料与方法
1.1 材料与分组 30只(30眼)健康8周雌性 SD大鼠,体质量200~250 g,随机分为2组,实验组20只,对照组10只。实验组右侧泪腺注射肉毒杆菌B,对照组右侧泪腺注射生理盐水。肉毒杆菌B(美国Elan公司),泪液检测滤纸条(天津晶明新技术发展有限公司),抗大鼠肿瘤坏死因子-α单克隆抗体(中杉金桥生物技术有限公司),羊抗大鼠IL-6单克隆抗体(美国PeproTech公司),抗鼠Lacritin蛋白抗体(美国Sant Cruz公司)。裂隙灯显微镜(SL-1E,日本 Topcon公司),荧光显微镜(BX51,日本Olympus公司)。
1.2 方法
1.2.1 动物模型建立 实验组20只大鼠腹腔注射100 g·L-1水合氯醛(4 mL·kg-1),待动物麻醉后在手术显微镜下暴露泪腺,将大鼠的右侧泪腺注射肉毒杆菌B 0.1 mL(20 mU),对照组同样方法注射生理盐水 0.1 mL。
1.2.2 泪液分泌试验检查 分别于术前1 d及术后3 d、7 d、14 d、28 d、42 d,将大鼠基础麻醉后检测泪液的分泌,将泪液检测滤纸条置于下睑中外1/3处,5 min后测量变色长度。
1.2.3 荧光素钠染色检查 分别于术前1 d及术后3 d、7 d、14 d、28 d、42 d,使用 10 g·L-1荧光素钠溶液染色,1 min后观察角膜荧光染色并在裂隙灯显微镜下拍照。角膜荧光染色评分采用 Park计分方法[2]:0分:无着色点;1分:点状着色≤1/8象限;2分:1/8象限 <点状着色≤1/4象限;3分:1/4象限<点状着色≤1/2象限;4分:点状着色 >1/2象限。
1.2.4 免疫荧光化学染色方法 分别于术后3 d、7 d、28 d、42 d随机将实验鼠脊髓离断处死,立即取其泪腺放入40 g·L-1多聚甲醛液中固定24 h,常规石蜡包埋切片并染色,分步递加一抗 Lacritin(Santa Cruz,兔)工作浓度为1∶50,二抗为生物素标记的兔IgG(美国Vector公司)1∶200,室温孵育1 h,ABC复合物(美国Vector公司)临用前1 h按说明书配制,室温孵育1 h,然后DAB显色(显色盒购自北京中杉生物公司)。然后脱水、透明并用中性树胶封片。免疫荧光化学染色一抗浓度、时间同上,FITC标记二抗(北京中杉生物公司)工作浓度为1∶200,室温避光孵育2 h,封片前加入DAPI。在BX51荧光显微镜下对目标部位进行照相,用于定性观察Lacritin蛋白表达。免疫荧光化学染色一抗浓度、时间同上,FITC标记二抗(北京中杉生物公司)工作浓度为1∶200,室温避光孵育2 h,封片前加DAPI。
1.2.5 Western blot检测方法 大鼠麻醉后,在冰上快速切取泪腺组织,加入适量裂解液,眼科剪将组织剪碎,然后用组织机械粉碎仪将组织研碎,再用超声破碎仪使组织充分粉碎(72 kJ,20%振幅,超声5 s,间歇 25 s,共 5 min,冰浴中进行)。然后 4 ℃、12 000 r·min-1离心 10 min,将上清转移至另一个预冷的Eppendorf管中-80℃保存。提取的组织匀浆上清用Bradford法进行蛋白定量;取15 μg样品,加入等体积的2×上样缓冲液混匀,100℃沸水煮沸2 min;用120 g·L-1聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到PVDF膜,室温下用封闭液作用1 h后加入Lacritin一抗(1∶2000,Santa Cruz),4℃过夜,洗涤3次 ×10 min;辣根过氧化物酶标记的二抗(1∶2000稀释,北京中杉生物公司)孵育2 h,洗涤3次×10 min;用增强型化学发光显色系统显示蛋白条带,感光在胶片上。实验重复3次,以β-actin(1∶2000,Santa Cruz)作内参照,用英国SYNGENE公司的GeneTools软件对采集的Western blot检测结果进行分析,分析条带的变化趋势,检测术前、术后3 d、7 d、28 d、42 d 泪腺组织 Lacritin 蛋白含量变化。
1.3 统计学处理 计数资料以均数±标准差表示,各组间采用独立样本t检验,用SPSS 16.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 泪液分泌试验 实验组从术后3 d时出现泪液分泌减少,实验组为(2.56±0.72)mm,对照组为(3.04±0.72)mm,差异无统计学意义(P=0.391);术后7 d、14 d、28 d 2组差异均有统计学意义(均为P<0.05,见表1);在28 d时实验组泪液分泌减少达到最低;42 d时泪液分泌恢复,与对照组差异无统计学意义(P>0.05)。实验组从3 d开始持续到28 d与术前1 d比较,差异均有统计学意义(均为 P<0.05)。对照组术前与术后各时间点差异均无统计学意义(均为 P >0.05)。
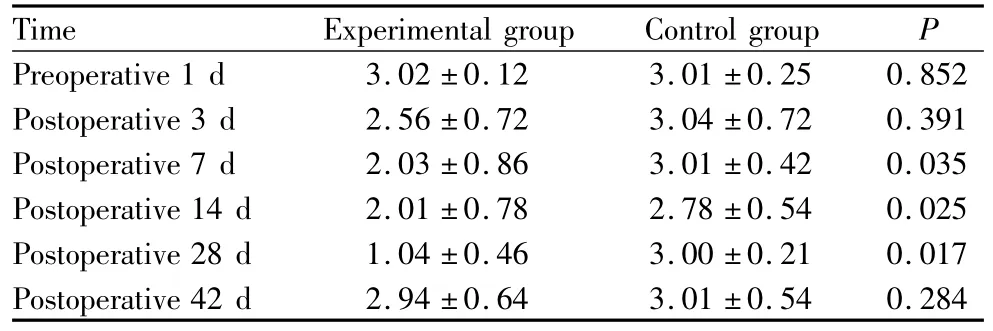
表1 2组泪液分泌结果Table 1 Results of Schirmer I test in two groups(l/mm)
2.2 荧光素钠染色结果 实验组术后3 d角膜开始出现荧光素钠着色,逐渐增多;至7 d上皮缺损逐渐融合呈片状;在术后28 d着色最重,之后角膜上皮染色范围未继续扩大且逐渐缩小;但一直到42 d时仍未恢复,即使这时泪液分泌已经恢复正常。对照组角膜光亮,无上皮损伤,除术前1 d和术后3 d外,余时间点2组评分差异均有统计学意义(均为P<0.05,见表2)。实验组术后各时间点角膜荧光染色评分与术前1 d比较,差异均有统计学意义(均为P <0.05)。
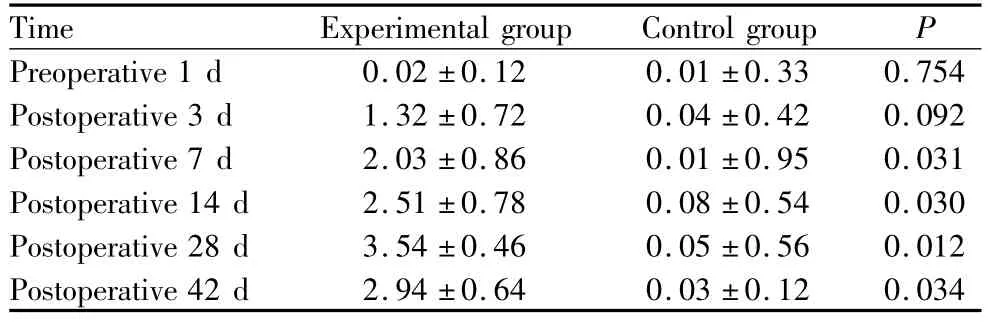
表2 2组角膜荧光染色评分Table 2 Corneal fluorescein staining scores in two groups (Score)
2.3 免疫荧光化学染色结果 在泪腺腺泡细胞的胞浆内可以看到Lacritin蛋白的表达,呈绿色荧光染色,蓝色为腺泡细胞核,腺泡细胞周围以及结缔组织周围没有发现其分布(图1)。

Figure 1 Expression of Lacritin protein in cytoplasm of lacrimal gland alveolus(green fluorescence) 泪腺腺泡细胞浆中Lacritin蛋白表达(绿色荧光)
2.4 Western blot检测结果 实验组泪腺组织Lacritin蛋白含量检测显示:术前差异不明显,术后3 d开始减少,7 d达到最低,28 d时含量仍呈低表达,42 d开始恢复。对照组Lacritin蛋白含量各时间点未出现变化(图2-图3)。
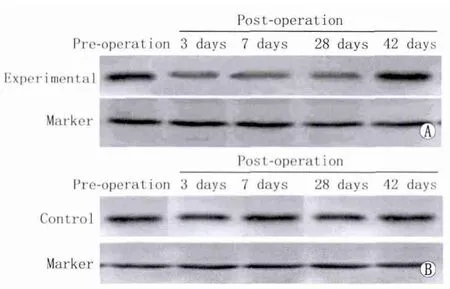
Figure 2 Lacritin protein electrophoresis images.A:Experimental group,B:Control group Lacritin蛋白电泳图。A:实验组,B:对照组

Figure 3 Western blot results of Lacritin protein expression at different time points of two groups 实验组与对照组各时间点泪腺组织Lacritin蛋白Western blot检测结果
3 讨论
随着生存环境变化和用眼习惯的变化,干眼症的发病率不断增加,并有年轻化的倾向,因此这个在过去常常被忽视的眼科疾病,也越来越受到人们的重视,它已经成为发病率最高的眼表疾病之一。
引起干眼症的病因很多,其发病机制十分复杂。但是尽管引起干眼症的起始病因不同,一旦进入进展阶段,炎症就成为干眼症发病机制中最关键的因素,T淋巴细胞浸润的泪腺分泌的泪液中含有炎症介质和细胞因子,可介导形成持续的炎症。而细胞凋亡、神经调节及性激素等也共同参与了干眼症的发病过程[3-4],因此,不同类型的干眼症表现出相似的病理生理改变,所以建立一个干眼症的炎症动物模型为干眼症的研究创造了一个重要基础。
Zhu等[5]通过实验建立了一种动物炎症模型,他们将兔一侧泪腺摘除,通过对上皮细胞的培养增殖获得自体外周淋巴细胞注射到对侧泪腺制造干燥综合征兔眼模型。组织病理图片显示与干燥综合征患者相似,可以看到泪腺组织主要为CD4+T淋巴细胞浸润,同时泪液产生的减少和角膜荧光染色均与干燥综合征患者相同。Lin等[6]将 Lewis鼠的一侧泪腺摘出匀浆,对匀浆的泪腺组织加入灭活的百日咳杆菌,进行进一步处理,然后回注入对侧泪腺,可增强其抗原性,诱导更严重的泪腺和唾液腺自身免疫反应,制成干眼症炎症模型,但都存在着创伤大、不良反应及维持时间短的缺点。
而我们通过对大鼠泪腺中注射肉毒杆菌B,在神经肌肉接头处抑制乙酰胆碱的释放而阻断胆碱能神经活动传递,达到减少泪液分泌的作用。结果显示:泪液分泌在实验组注射后3 d开始出现减少,28 d达到最低,角膜上皮缺损持续出现42 d,未出现其他眼部和全身的副作用。通过本研究我们发现泪腺注射肉毒杆菌B可成功建立大鼠干眼症炎症模型,其优点是操作简单、损伤小、耗时短(3 d)、维持时间长(1个月)、干眼症体征明显。前期的实验病理检测可见眼表炎症反应明显,分析可能是肉毒杆菌B损害了泪腺及其神经的正常功能,致使泪液分泌量下降,引起CD4+T淋巴细胞等炎症因子的产生,诱发眼表炎症反应,造成恶性循环。组织切片显示:注射肉毒杆菌B后泪腺组织没有发现炎症细胞浸润,这也就区别其他先造成泪腺炎症而后出现干眼的动物模型,为那些非干燥综合征的常见的干眼症患者提供了很好的动物模型。Zhu等[5]给大鼠泪腺注射肉毒杆菌B后4周发现促炎细胞因子白细胞介素-1、肿瘤坏死因子-α等炎症因子在泪液以及眼表组织中表达明显升高,表明其方法可以建立一种更接近人类的慢性假性免疫干眼症大鼠模型[7]。
人们在泪液中发现大约有400种蛋白,但是参与眼表疾病的蛋白不超过5%,而Lacritin蛋白是目前发现唯一促进泪液分泌功能的蛋白[8]。近年来,人们通过对其结构和功能的深入研究,逐渐发现其作为一种类生长因素蛋白,在干眼症的发生和发展中都起到重要作用[9-10],但是具体的作用机理尚未完全明了,已经是现在研究干眼症的一个重要方向。Lacritin蛋白主要由泪腺分泌,经过腺管分泌到眼表面。前期的临床研究表明有促进有丝分裂、角膜上皮细胞增殖和泪液分泌的作用。当出现干眼时,其在泪液、眼表的表达减低[11]。Samudre 等[12]用人重组体Lacritin蛋白对兔干眼模型动物滴眼,14 d后发现其可以增加泪液基础分泌量50%。目前,对Lacritin蛋白的研究为干眼疾病的病理研究和治疗提供了一个重要思路。
本研究结果显示:Lacritin蛋白的表达在泪腺腺泡细胞中,从注射3 d后出现表达减低,一直持续6周,与泪液的分泌减少和眼表损害呈同步变化,从而间接地证实Lacritin蛋白在干眼症引起的临床症状中不可或缺,同时病理切片还发现泪腺组织结构仍然保持良好,未发现T细胞浸润,说明泪腺腺泡细胞分泌的Lacritin蛋白主要随泪液分泌到眼表发挥作用。由于Lacritin蛋白主要是泪腺分泌的,而睑板腺和结膜分泌可以忽略不计,所以检测泪液或结膜组织中的含量可以作为定量观察泪腺分泌功能的一个客观指标,为观察治疗干眼症的药物疗效以及并发症的转归提供了一个重要量化指标。当然,Lacritin蛋白与炎症因子的关系及其功能和作用机理还需要进一步的实验研究。
总之,泪腺注射肉毒杆菌B可以诱导大鼠建立一种干眼症炎症模型,而Lacritin蛋白的检测可以为以后干眼症的转归以及观察药物疗效提供了一个新的量化标准。
1 Nelson JD,Helms H,Fiscella R,Southwell Y,Hirsch JD.A new look at dry eye disease and its treatment[J].Adv Ther,2000,17(2):84-93.
2 Nakamura S,Shibuya M,Nakashima H,Imagawa T,Uehara M,T subota K.D-beta-hydroxylbutyrate protects against corneal epithelial disorders in a rat dry eye model with jogging board[J].Invest Ophthalmol Vis Sci,2005,46(7):2379-2387.
3 Smith RE.T he tear film complex:pathogenesis and emerging therapies for dry eyes[J].Cornea,2005,24(1):1-7.
4 De Paiva CS,Pflugfelder SC.Rationale or anti-inflammatory therapy in dry eye syndrome[J].Arq Bras Oftalmol,2008,7(6):89-95.
5 Zhu L,Shen J,Zhang C,Park CY,Kohanim S,Yew M.Inflammatory cytokine expresion on the ocular surface in the Botulium toxin B induced urine dry eye model[J].Mol Vis,2009,15:250-258.
6 Lin Z,Liu X,Zhou T ,W ang Y,Bai L,He H,et al.A mouse dry eye model induced topical administration of benzalkonium chloride[J].Mol Vis,2011,17(31-32):257-264.
7 Park CY,Zhuang W ,Lekhanont K,Zhang C,Cano M,Lee W S,et al.Lacrimal gland inflammatory cytokine gene expression in the botulinum toxin B-induced murine dry eye model[J].Mol Vis,2007,13(252-255):2222-2232.
8 Sanghi S,Kumar R,Lumsden A,Dickinson D,Klepeis V,T rinkaus-Randall V,et al.cDNA and genomic cloning of lacritin,a novel secretion enhancing factor from the human lacrimal gland[J].J Mol Biol,2001,310(1):127-139.
9 M a P,Beck SL,Raab RW ,M cKown RL,Coffman GL,Utani A,et al.Heparanase deglycanation of syndecan-1 is required for binding of the epithelial-restricted prosecretory mitogen lacritin[J].J Cell Biol,2006,174(7):1097-1106.
10 Koo BS,Lee DY,Ha HS,Kim JC,Kim CW .Comparative analysis of the tear protein expression in blepharitis patients using two-dimensional electrophoresis[J].J Proteome Res,2005,4(3):719-724.
11 Goto E,Yagi Y,M atsumoto Y,T subota K.Impaired functional visual acuity of dry eye patients[J].Am J Ophthalmol,2002,133(2):181-186.
12 Samudre S,Lattanzio FA Jr,Lossen V,Hosseini A,Sheppard JD Jr,M cKown RL,et al.A novel human tear glycoprotein,promotes sustained basal tearing and is well tolerated[J].Invest Ophthalmol Vis Sci,2011,52(9):6265-6270.

