PTEN基因对兔晶状体上皮细胞增殖抑制作用的实验研究△
赵宁 张瑞君 刘磊 李佳 刘宁宁
白内障是世界范围内的主要致盲性眼病。白内障囊外摘出及超声乳化白内障吸出联合人工晶状体植入术是现代治疗白内障的常用方法。然而晶状体后囊膜混浊(posterior capsule opacification,PCO)是白内障术后的常见并发症,严重影响患者术后视力[1]。细胞因子刺激晶状体上皮细胞(lens epithelial cells,LEC)增殖,占据原先无细胞的后囊膜,是形成PCO的主要原因。细胞因子与细胞膜表面分布的相应受体结合后,通过多种途径将信号传递到胞核内,促进或抑制特定靶基因的表达,调节细胞生长。
在细胞因子受体介导的信号转导途径中,磷脂酰肌醇三磷酸激酶(phosphatidylinositol-3 kinase,PI-3k)/蛋白激酶B(protein kinase B,PKB)信号转导途径是调控细胞骨架及凋亡的重要途径[2-3]。PKB是PI-3k/PKB信号转导系统中重要的下游激酶,PKB磷酸化后才能表现出活性[4-5]。已有研究表明,PI3K信号转导途径参与 LEC的迁移、分化[6-7]。而 PTEN是至今为止发现的第一个具有磷酸酶活性的抑癌基因,主要通过其脂质磷酸酶活性阻断PI-3k信号转导途径,从而诱导细胞凋亡、抑制细胞生长、调节细胞迁移与黏附,在肿瘤研究领域得到大量证实[8-10]。本研究旨在为研究白内障术后LEC增殖过程中是否存在PTEN基因对PI-3k/PKB信号转导途径的抑制作用,为防治后发性白内障提供实验依据。
1 材料与方法
1.1 实验动物与分组 选用中国医科大学实验动物部提供的健康白色家兔42只(84眼),8~10周龄,雌雄各半,体质量(1.5±0.3)kg,随机分为实验组(36只)和对照组(6只)。
1.2 试剂与仪器 PTEN mRNA原位杂交检测试剂盒、鼠抗兔PCNA单克隆抗体、小鼠IgG链酶亲合素生物素复合物免疫组织化学试剂盒、二氨基联苯胺(diaminobenzidin,DAB)显色试剂盒、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)均为武汉博士德公司产品。鼠抗兔 Ser473-R多克隆抗体(美国 Santa Cruz Biotechnology,Inc公司)。RT-PCR 试剂盒、βactin引物由大连宝(Takara)生物工程有限公司提供。PKB引物由上海博亚生物技术有限公司提供。CataRhex型超声乳化仪(瑞士Oerrtli Instrumente AG公司产品);YZ20P型手术显微镜(苏州六六视觉科技股份有限公司产品);Ax70型显微镜系统(日本O-lympus公司产品);显微图像分析采用Metamorph软件(美国UIC公司产品)。
1.3 动物模型及标本制备 对照组未做处理;实验组速眠新(0.1~0.3 mg·kg-1)肌肉注射麻醉,Mydrin-P散瞳,由专人行双眼透明晶状体皮质吸出术:直径3.2 mm角巩膜缘隧道切口,前房注入黏弹剂,行4.0 mm直径开罐式截囊,注吸皮质后切口不缝合。术后10 g·L-1阿托品眼膏散瞳。分别在术后1 d、3 d、1周、2周、1个月和2个月各处死随机选择的6只实验组兔。摘除双眼,在手术显微镜下剪除角膜及虹膜,剪断晶状体悬韧带,取出晶状体。每组3只(6眼)晶状体取出后立即用40 g·L-1多聚甲醛固定24 h,石蜡包埋;然后制作连续切片,片厚5 μm(玻片经体积分数0.1%DEPC处理,并用体积分数0.1%DEPC捞片);分别行HE、PCNA及Ser473-R免疫组织化学染色、PTEN mRNA原位杂交;以 PBS取代PCNA、Ser473-R一抗作为阴性对照;已知 PCNA、Ser473-R染色阳性的膀胱癌组织切片作为阳性对照。每组另3只(6眼)晶状体取出后,以赤道内2.0 mm为界留取赤道部,置灭菌Eppendorf管中,-70℃冻存,待行RT-PCR检测;以PBS取代PTEN探针及PCNA一抗作为阴性对照;已知PTEN mRNA染色阳性的乳腺癌组织切片作为阳性对照。
1.4 指标检测方法
1.4.1 免疫组织化学SABC法检测PCNA、Ser473-R的表达 石蜡切片常规梯度乙醇脱蜡,按试剂说明书操作,封闭内源性过氧化物酶,修复抗原后,滴加PCNA、Ser473-R一抗和二抗,加 SABC。DAB显色,苏木素复染,常规脱水、透明、封片。检测术前及术后各时间点PCNA、Ser473-R的表达。
1.4.2 原位杂交检测PTEN mRNA的变化 石蜡切片常规脱蜡,体积分数0.1%DEPC冲洗,体积分数3%H2O2于室温下浸泡10 min,37℃下胃蛋白酶消化10 min;每片滴加地高辛标记的PTEN寡核苷酸探针杂交液20 μL,37℃下过夜;杂交后在37℃下梯度SSC充分洗涤,滴加稳定液,37℃下静置5 h;室温下加封闭液静置30 min,37℃下生物素化抗地高辛抗体反应20 min;DAB显色,苏木素复染,脱水、透明、封片。检测术前及术后各时间点PTEN mRNA表达。
1.4.3 RT-PCR检测PKB mRNA的表达 将冻存的兔赤道部晶状体上皮组织提取总RNA,逆转录获得cDNA。以cDNA为模板,参照 Takara RT-PCR试剂盒方法PCR扩增PKB的目的基因。检测术前及术后各时间点PKB mRNA的含量。
1.4.4 结果分析 免疫组织化学检测 PCNA阳性为胞核呈棕黄色,Ser473-R与PKB mRNA阳性表达信号为胞浆呈棕黄色,PTEN mRNA阳性表达信号为胞浆呈棕黄色。在40倍物镜下摄取每组切片随机选取的晶状体赤道部视野图像共6张,转存入计算机,用Metamorph软件计算标本晶状体赤道部单位面积PCNA和PTEN mRNA阳性细胞吸光度(A)值。
RT-PCR凝胶图像分析系统观察电泳结果并摄像,经Kadak 1D图像分析软件进行分析,计算目的基因mRNA的相对含量。目的基因mRNA的相对含量=(目的基因mRNA mass值÷内参照基因mRNA mass值)×100。
1.5 统计学方法 所有数据均采用SPSS统计软件包(12.0版本)分析。计量资料采用均数±标准差表示。各组间的对比分析采用成组设计的独立样本t检验。各指标之间的相关性采用Person相关系数进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 PCNA免疫组织化学染色检测结果 对照组赤道部LEC核可见PCNA弱阳性表达,胞核被染成弱棕黄色,术后不同时期的表达情况见表1。实验组术后1 d时吸光度(A)值迅速升高为0.86±0.02,与对照组相比,差异有显著统计学意义(P<0.001,见表1),提示PCNA的表达迅速升高;术后1~7 d PCNA的表达维持在高水平状态;2周后,随着时间的延长,PCNA表达逐渐减弱;术后1个月、2个月时大致恢复至术前状态。
2.2 Ser473-R免疫组织化学染色检测结果 对照组赤道部LEC中Ser473-R的表达极弱,胞浆中几乎看不到棕色颗粒,吸光度(A)值最小。实验组术后1 d时 A值迅速升高为0.54±0.03,与对照组相比,差异有显著统计学意义(P<0.001,见表1);术后1~3 d Ser473-R的表达维持在高水平状态;1周时,Ser473-R表达开始减弱;术后1个月、2个月时恢复术前水平(表1)。
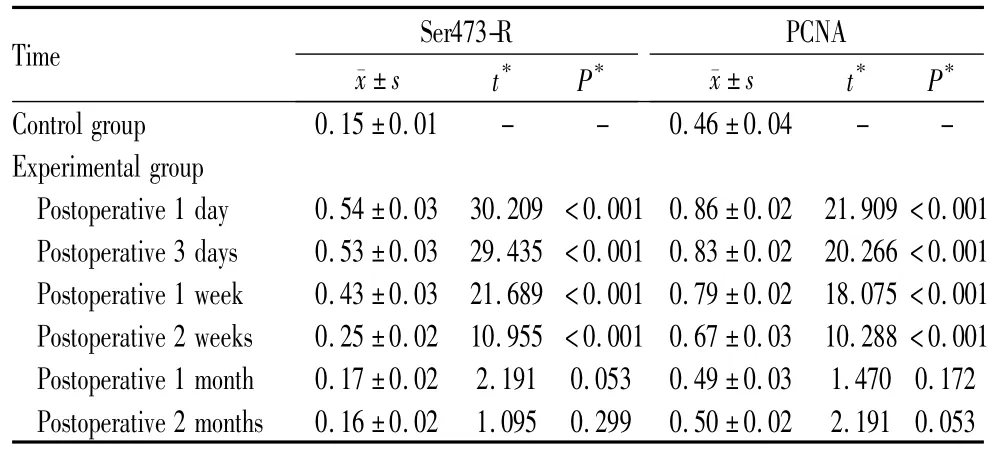
表1 实验组与对照组兔LEC中Ser473-R与PCNA的吸光度(A)值Table 1 Value of absorption optical density of Ser473-R and PCNA in two groups
2.3 PKB mRNA RT-PCR检测结果 对照组兔晶状体上皮组织中PKB表达产物片段长为261 bp,内参照β-actin为690 bp。从PKB mRNA的相对含量中可知,PKB mRNA的表达恒定,对照组与实验组各时间点PKB mRNA表达差异均无统计学意义(均为P >0.05,见表2)。
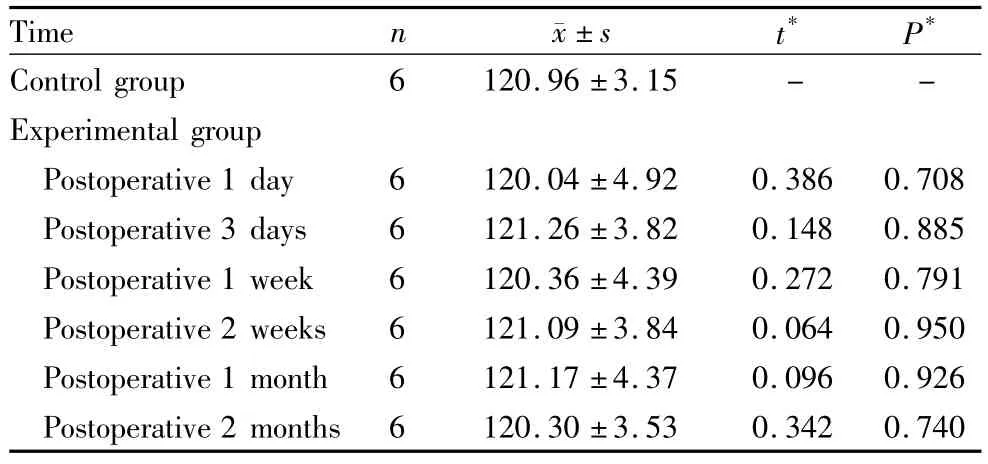
表2 实验组与对照组兔LEC中PKB mRNA的相对含量Table 2 Relative content of PKB mRNA in LEC of two groups
2.4 PTEN mRNA原位杂交染色检测结果 对照组LEC有PTEN mRNA表达(图1),吸光度(A值)为0.54±0.03。实验组术后1 d时显著低于对照组(t=23.099,P <0.001,见图2、表3),提示 PTEN mRNA 表达明显下降;术后3 d时,表达仍处于低水平状态。随着时间的延长;术后1周时略有恢复(图3);2周时趋于明显好转;术后1个月、2个月时恢复术前水平(表3)。
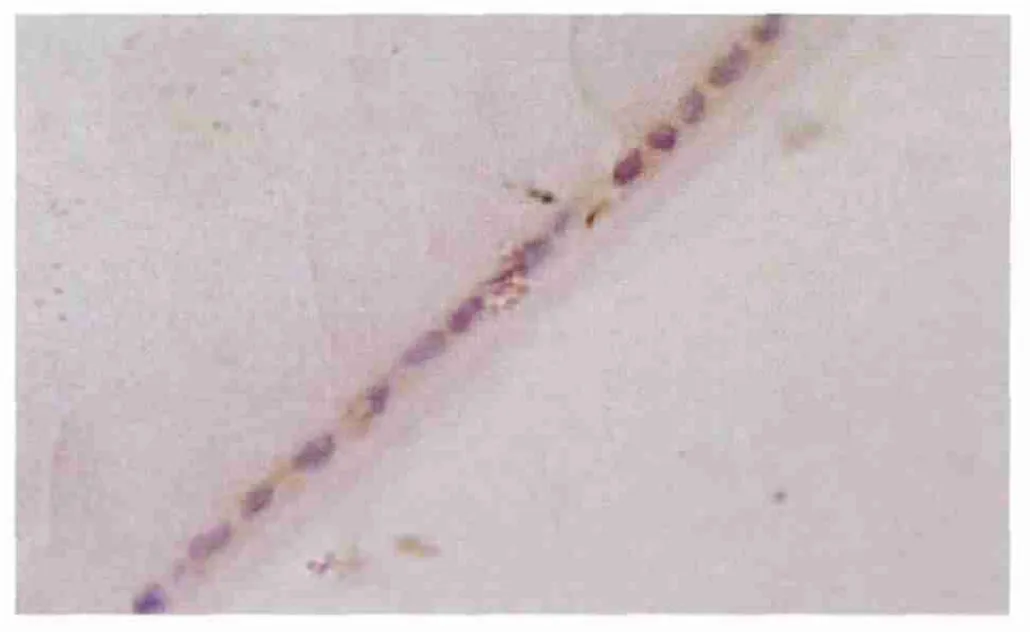
Figure 1 PTEN mRNA expressed brownish yellow in cytoplasm of LEC in control group 对照组PTEN mRNA阳性表达信号为胞浆呈棕黄色
2.5 PKB mRNA、Ser473-R与 PCNA表达的相关性分析 PKB mRNA相对含量与PCNA的阳性细胞平均吸光度(A)值呈负相关(r=-0.319,P=0.039)。Ser473-R与PCNA的阳性细胞吸光度(A)值呈明显正相关(r=0.955,P <0.001)。
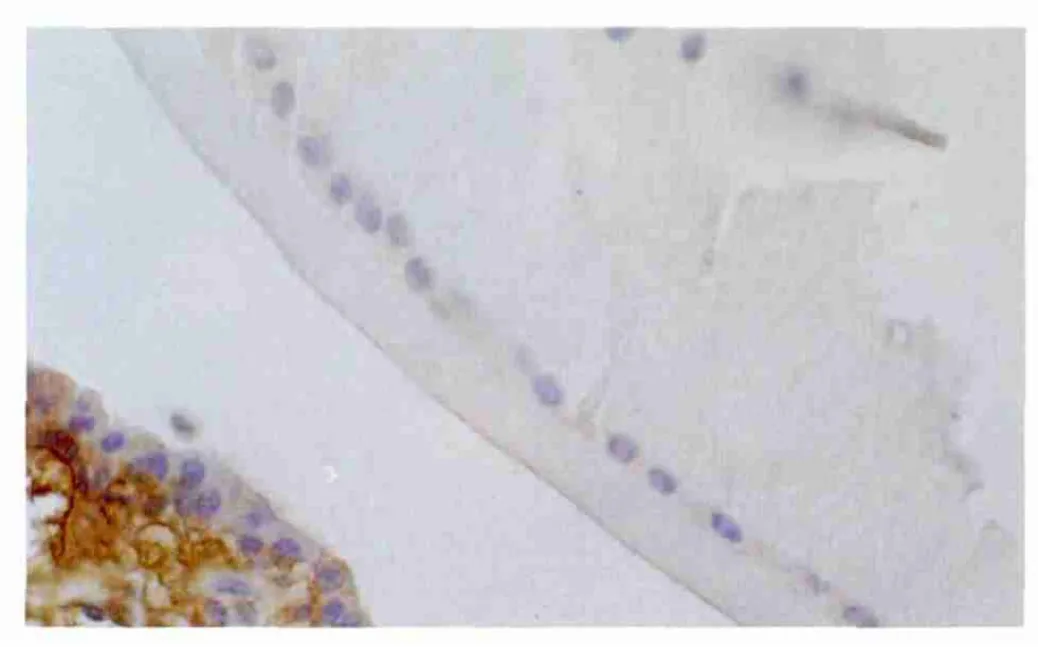
Figure 2 PTEN mRNA expressed weak brownish yellow at postoperative 1 day(situ hybridization,×400) 术后1 d时 PTEN mRNA表达呈弱阳性(原位杂交,×400)
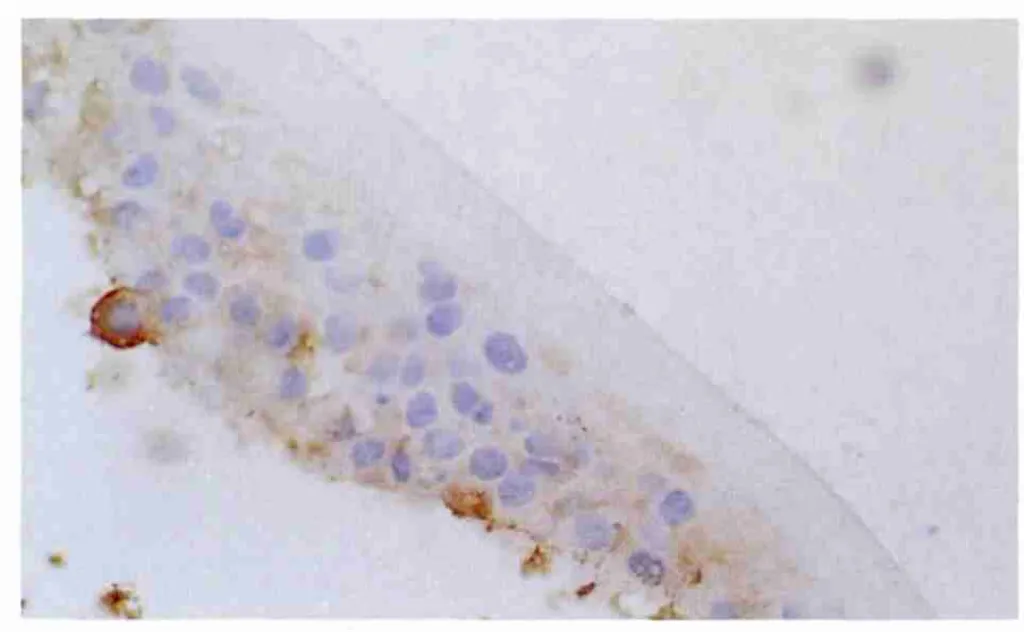
Figure 3 Expression of PTEN mRNA restored at postoperative 1 week(situ hybridization,×400) 术后1周时 PTEN mRNA表达有所恢复(原位杂交,×400)
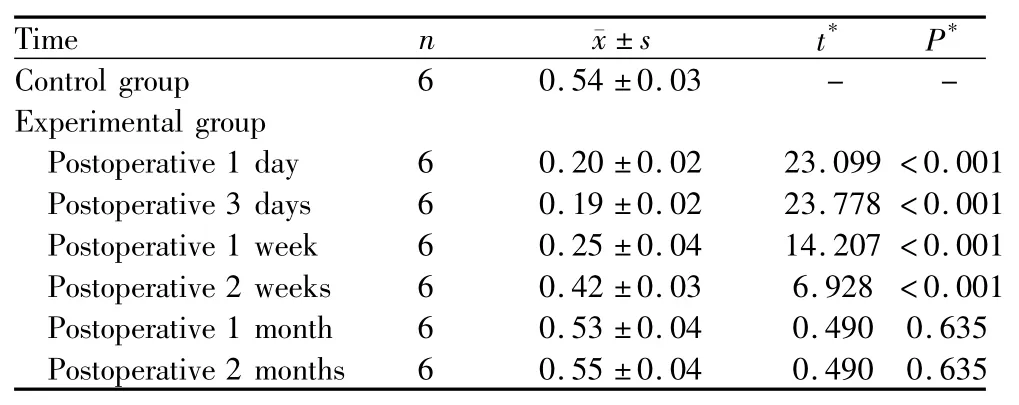
表3 实验组与对照组兔LEC中PTEN mRNA吸光度(A)值Table 3 Value of absorption optical density of PTEN mRNA in two groups
2.6 PTEN mRNA与PCNA、Ser473-R表达的相关性分析 PTEN mRNA与PCNA的阳性细胞平均吸光度(A)值呈负相关(r=-0.954,P <0.001)。Ser473-R与PTEN mRNA变化显著,两者呈明显负相关(r=-0.969,P <0.001)。
3 讨论
PCNA是真核细胞DNA合成所必需的一种核蛋白,是DNA多聚酶δ的辅助因子,是细胞增殖的可信指标[11]。本研究再次以 PCNA作为细胞增殖指标,对兔晶状体皮质吸出后LEC增殖过程中PKB的表达情况进行研究。结果显示,术后1 d PCNA表达迅速增强并达峰值,说明术后残留的LEC此时已大量进入增殖期。随着术后时间的延长,PCNA表达逐渐减弱,术后1~2个月时恢复术前水平,说明术后1个月是LEC增殖最活跃的时期。
对照组和实验组术后不同时期PKB mRNA的相对含量恒定,组间差异均无统计学意义(均为P>0.05),与文献报道 PKB mRNA的表达不随细胞增殖情况而变化的结果一致[4]。PKB mRNA相对含量与PCNA的阳性细胞吸光度(A)值之间呈负相关,说明细胞增殖不依赖PKB的含量,而是与它的活性有关。
PKB家族蛋白分子为单链结构,由3个结构域组成,其中第412-480位氨基酸构成 C末端调节区,富含疏水氨基酸和脯氨酸可以和SH3(SRC同源序列3)区结合,有一个丝氨酸位点(Ser473/Ser474)。当调节区的Ser473磷酸化以后,引发其构型改变,解除其对催化区的抑制而表现出酶活性,磷酸化的Ser473可代表PKB的活性,Ser473-R可以与磷酸化的 Ser473结合,从而反映 PKB的活性[12]。Ser473-R在术后处于高水平状态,Ser473-R与PCNA的阳性细胞吸光度(A)值之间呈明显正相关,说明LEC的增殖与PKB的活化密切相关。
PTEN基因作为一种抑制基因,在细胞的生长发育以及增殖与凋亡中有复杂而重要的作用。PTEN基因是否在眼内调节LEC的增殖尚未完全明确,有报道在先天性后囊下白内障时出现了PTEN基因的突变[13]。在对照组的兔LEC中我们检测到了PTEN mRNA的表达,说明正常状态下的LEC自然的增殖、分化、生长可能也受到 PTEN mRNA的调控。术后1~3 d,PTEN mRNA的表达明显减少;1周时,PTEN mRNA的表达有所恢复;2周后,逐渐恢复PTEN mRNA的表达。在增殖的兔LEC中PTEN mRNA的表达与PCNA的表达呈负相关,提示PCNA和PTEN在控制细胞增殖、生长的过程中可能相互拮抗,PTEN可能对LEC增殖有负调控作用。
有研究证实,PTEN基因是通过影响PI-3k途径而调节细胞增殖的[10]。本研究中Ser473-R与PTEN mRNA之间呈明显负相关,而Ser473-R与PCNA之间呈明显正相关,提示PTEN mRNA可能通过抑制Ser473的磷酸化,使PKB活性降低,影响PI-3k通路的形成,从而抑制细胞增殖和生长。在白内障术后,PTEN基因可能通过阻断 PI-3k信号转导通路,对LEC的增殖有抑制作用。
随着分子生物学技术的不断发展,人们对PTEN基因的认识逐渐深入,PTEN有非依赖P13K激酶途径调控细胞增殖、生长的作用。通过促进 PTEN基因的表达来抑制LEC的增殖、分化,是否能防止PCO的发生,还需要大量的实验来证实。
1 Huang W ,Huang G,W ang D,Yin Q,Foster PJ,He M.Outcomes of cataract surgery in urban southern China:the Liwan Eye Study[J].Invest Ophthalmol Vis Sci,2011,52(1):16-20.
2 Hawkins PT,Anderson KE,Davidson K,Stephens LR.Signalling through Class I PI3Ks in mammalian cells[J].Biochem Soc Trans,2006,34(Pt 5):647-662.
3 Rajeeve V,Pearce W,Cascante M,Vanhaesebroeck B,Cutillas PR.Polyamine production is downstream and upstream of oncogenic PI3K signalling and contributes to tumour cell growth[J].Biochem J,2013,450(3):619-628.
4 Hemmings BA,Restuccia DF.PI3K-PKB/Akt pathway[J].Cold Spring Harb Perspect Biol,2012,4(9):a011189.
5 Xue G,Hemmings BA.PKB/Akt-Dependent Regulation of Cell M otility[J].J Natl Cancer Inst,2013,105(6):393-404.
6 W eber GF,M enko AS.Phosphatidylinositol 3-kinase is necessary for lens fiber cell differentiation and survival[J].Invest Ophthalmol Vis Sci,2006,47(10):4490-4499.
7 Xiong W,Cheng BH,Jia SB,T ang LS.Involvement of the PI3K/Akt signaling pathway in platelet-derived growth factor-induced migration of human lens epithelial cells[J].Curr Eye Res,2010,35(5):389-401.
8 Oudit GY,Penninger JM.Cardiac regulation by phosphoinositide 3-kinases and PT EN[J].Cardiovasc Res,2009,82(2):250-260.
9 Matsuda S,Kobayashi M,Kitagishi Y.Roles for PI3K/AKT/PTEN Pathway in Cell Signaling of Nonalcoholic Fatty Liver Disease[J].ISRN Endocrinol,2013;2013:472432.doi:10.1155/2013/472432.
10 Carnero A,Blanco-Aparicio C,Renner O,Link W,Leal JF.T he PT EN/PI3K/AKT signalling pathway in cancer,therapeutic implications[J].Curr Cancer Drug Targets,2008,8(3):187-198.
11 M ahler M,M iyachi K,Peebles C,Fritzler M J.T he clinical significance of autoantibodies to the proliferating cell nuclear antigen(PCNA)[J].Autoimmun Rev,2012,11(10):771-775.
12 Fayard E,Xue G,Parcellier A,Bozulic L,Hemmings BA.Protein kinase B(PKB/Akt),a key mediator of the PI3K signaling pathway[J].Curr Top Microbiol Immunol,2010,346:31-56.
13 Boccone L,Dessi V,Serra G,Zibordi F,Loudianos G.Bannayan-Riley-Ruvalcaba syndrome with posterior subcapsular congenital cataract and a consensus sequence splicing PT EN mutation[J].Am J Med Genet A,2008,146(2):257-260.

