肺动脉源性室性心律失常的心电生理特征
李小荣 曹克将
大部分流出道单形性室性心动过速和无症状的单形性室性早搏起源于心室内膜,这些心律失常的心电图特征明显,消融成功率高。但也有部分心电图与它们极其相似的室性心律失常在心内膜导管消融效果差,而在肺动脉(pulmonary artery,PA)内消融却效果良好。我们将这部分起源于肺动脉的室性心律失常称为肺动脉源性室性心律失常(ventricular arrhythmias originating from the pulmonary artery,PA-VAs)。PA-VAs发病率低,约占接受消融治疗的特发性室性心律失常的 4% ~16.2%[1-2],目前文献报道多为病例报道[3-4],故了解 PA-VAs的心电生理特征对临床医生而言尤为必要。
1 肺动脉相关解剖
肺有2套血管系统,一套是支气管动与静脉系统,支气管动脉发自胸主动脉,随支气管分支而分布,为营养性血管,主要负责肺内支气管壁、肺血管壁的血液供应;另一套即为肺动、静脉系统,循环于心和肺之间,为机能性血管。PA从右心室发出,伴支气管入肺,随支气管反复分支,最后形成毛细血管网包绕在肺泡周围,之后逐渐汇集成肺静脉,回流至左心房。右心室的出口称为右心室流出道(right ventricular outflow tract,RVOT),肺动脉瓣位于RVOT与PA之间,由3个半月瓣组成。当心室舒张时,肺动脉瓣关闭,阻止血液从PA倒流入RVOT。PA与RVOT自然相连,RVOT的间隔附着在主动脉的前壁,为室间隔的延续(图1)。研究显示,在PA内,约17%的患者可见到心肌束延伸(ventricular myocardial extensions,VME)。VME 长度(3.25 ±1.3)mm,厚度(0.83 ±0.71)mm;50%为连续延伸,67%呈斜行排列,33%呈纵向排列。这些解剖特点,可能为PA成为部分室性心律失常的起源灶提供了基础[5]。而这种心肌束延伸,可能为在心脏胚胎发育阶段,流出道远端失去心肌形态而变为肺动脉内近端的肌袖[6]。
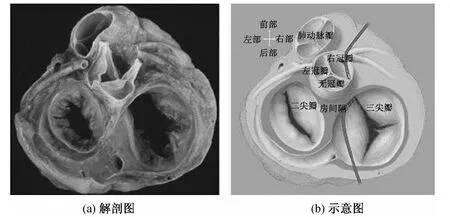
图1 肺动脉瓣与周围毗邻结构的关系Fig.1 The relationship between pulmonic valve and the adjacent structures
2 PA-VAs体表心电图特征
由于PA与RVOT紧密相连,因此PA-VAs的心电图形态学与RVOT-VAs相似。研究显示,体表心电图无法区分RVOT起源和PA起源的室性心律失常,但PA-VAs也有自身特定的心电图特征[2]:
(1)QRS波呈左束支阻滞形态;
(2)下壁导联R波振幅较大(Ⅱ导联 >1.92 mV,Ⅲ导联 >1.90 mV,aVF 导联 >1.89 mV),且通常比RVOT-VAs时大,这与PA位置较RVOT更靠左、更靠前有关;
(3)Q aVL/Q aVR>1,原因可能是PA更靠左、更靠前;
(4)Ⅰ导联呈QS或rS型;
(5)胸导联移行在V2导联或V3导联。
图2为4例典型的PA-VAs心电图。
3 腔内标测特征
PA与RVOT虽由肺动脉瓣分割,但仍然紧密相连,故PA-VAs与RVOT-VAs在心电图形态学上极其相似,难以鉴别。从而,心室腔内电生理特征对二者的鉴别就显得尤为重要。通过将导管置于右心房、His束及右心室心尖部,行程序电生理刺激和基质激动标测,可发现PA-VAs主要的腔内标测特征如下[7-8]:
(1)理想靶点处双极记录的V波振幅<1 mV;
(2)可同时记录到远场A波和V波;
(3)难以实施起搏标测,通常需要高能量起搏;
(4)局部双极电图记录到的电位较单极电图明显提前;
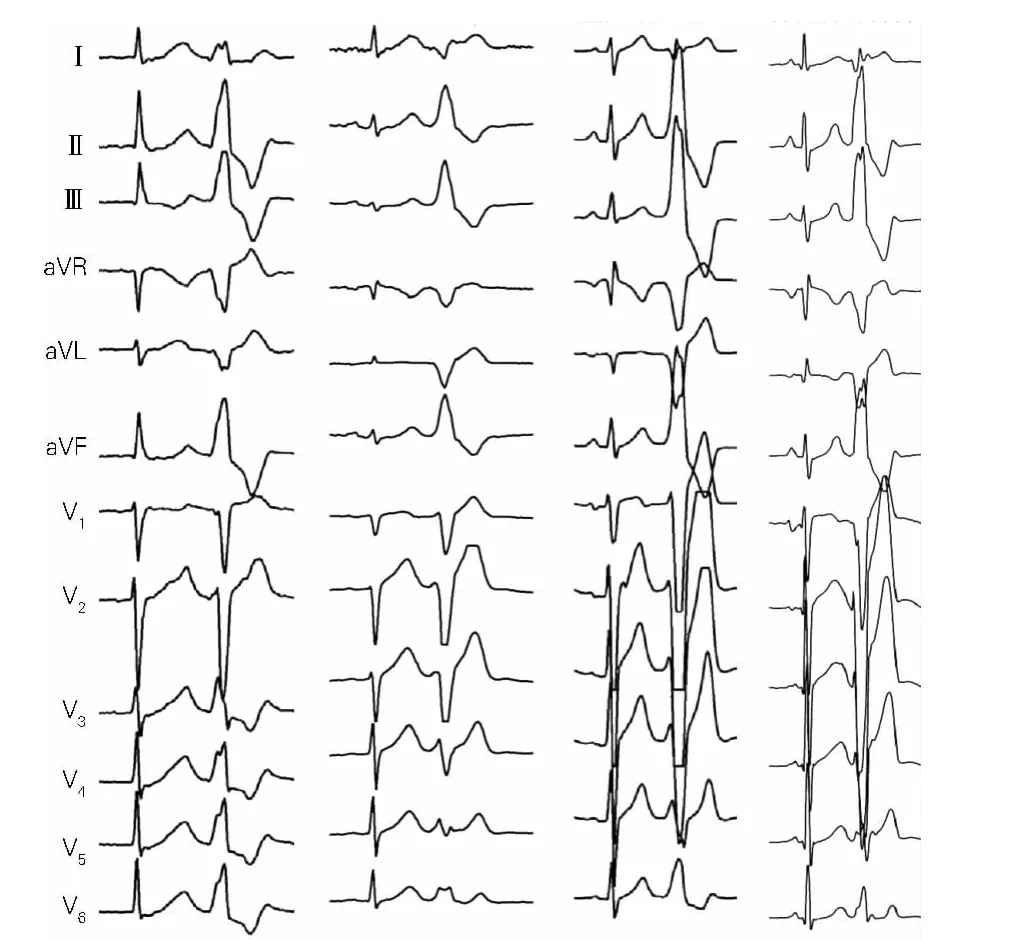
图2 4例典型的PA-VAs心电图Fig.2 Four typical ECGs of PA-VAs
(5)起源于主肺动脉干的VAs靶点图可显示特征性的Spike电位(翻转的尖峰电位,见图3);
(6)异丙或运动容易激发提示其儿茶酚胺敏感,但缺乏药理试验支持;
(7)由于心电图形态学貌似起源于RVOTVAs,因此若在肺动脉瓣下标测、消融失败且有心电图的改变,则需要在肺动脉瓣上详细标测,以确认是否为 PA-VAs[1]。
4 心电图鉴别
在解剖结构上,PA与RVOT、主动脉窦、His束位置相近,故由PA来源的室性心律失常在心电图形态上与这3种位置来源的室性心律失常形态相近,需仔细鉴别。
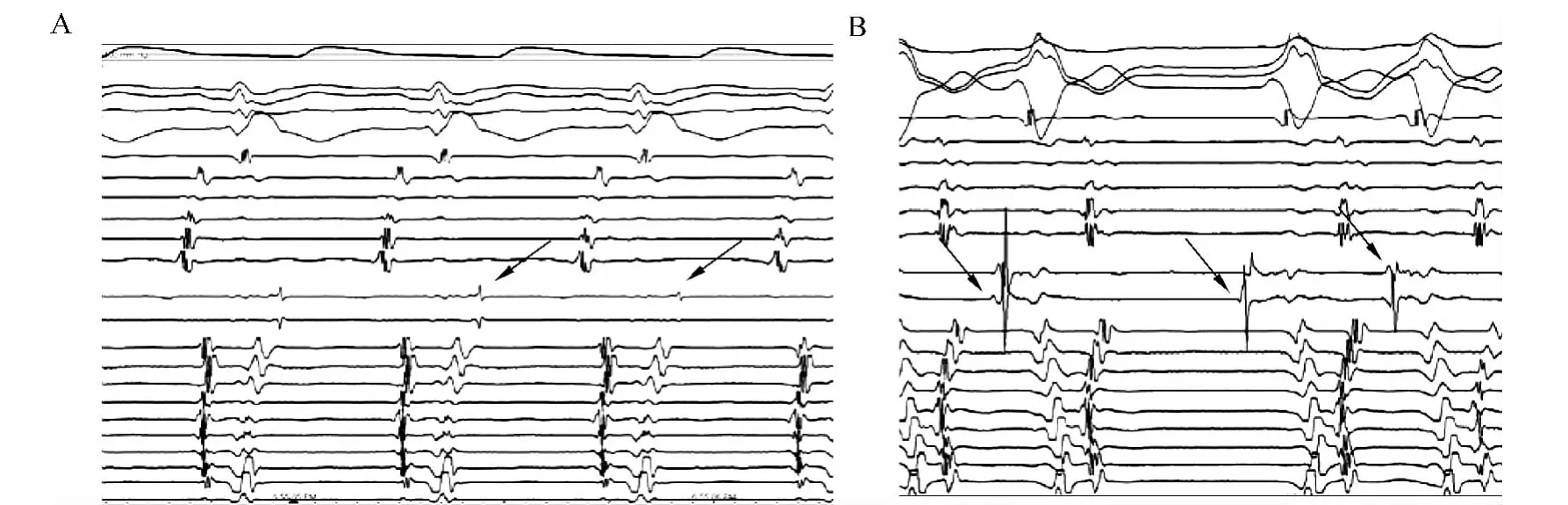
图3 典型的PA-Spike电位Fig.3 Typical PA-Spike potential
4.1 PA-VAs与 RVOT-VAs心电图鉴别
因PA与RVOT紧密相连,小样本研究提示PA-VAs的心电图形态学与 RVOT-VAs极其相似——二者的心电图在R波振幅、QRS宽度、aVR/aVL Q波值,以及V1~V3导联R/S值等方面并无显著差异[9]。较大样本量的研究还提示,除前文所述的PA-VAs心电图特征外,下列心电图体征可为二者的鉴别诊断提供更多的线索[2]:
(1)与RVOT-VAs相比,PA-VAs的 R波在下壁导联振幅更大;
(2)与 RVOT-VAs相比,PA-VAs的 QaVL/QaVR值>1;
(3)与RVOT-VAs相比,PA-VAs的V2导联R/S值更大,胸前导联移行更早。
上述这些心电图特点均与PA的解剖位置有关。与RVOT相比,PA位置更高、更靠左,也更靠前。
4.2 PA-VAs与主动脉窦起源者心电图鉴别
主动脉窦可以分为左冠窦、右冠窦以及无冠窦,如图1所示。主动脉窦较RVOT和PA更偏后、偏右侧,因此主动脉窦起源者R波时程更长、振幅更大(图2)。主动脉窦起源者除下壁导联QRS波呈高大直立的R型外,左冠窦起源者胸前导联通常移行在V1、V2导联之间,Ⅰ导联为 rs(r<s),RⅢ>RⅡ,QSaVL>QSaVR;右冠窦起源者通常在 V2、V3导联移行,RⅡ>RⅢ,QSaVR>QSaVL,Ⅰ导联多呈直立 R型,见图4(引自文献[10])。

图4 PA-VAs与主动脉窦起源室性心律失常的心电图鉴别Fig.4 The electrocardiographic characters of VAs originating from PA and aortic sinus
4.3 PA-VAs与His束附近起源者心电图鉴别
如图1所示,在解剖学上RVOT最右侧为His束,最左侧为PA,也即PA较His束更靠左、更靠上,从而可为二者来源的室性心律失常的鉴别提供下列心电图线索[11]:
(1)His束附近室性心律失常心电图Ⅲ导联R波显著小于PA-VAs;
(2)几乎所有PA-VAs在aVL导联上为QS型,而60%的His束附近起源室性心律失常在aVL导联为R型,见图5。
5 标测与消融
PA-VAs与RVOT-VAs的心电图形态学相似,故而首先容易被判断为RVOT-VAs。导管消融时,消融导管首先进入RVOT,在肺动脉瓣下进行标测、消融。PA-VAs在RVOT内EA消融时可能无效,或受到消融影响而使心电图发生改变。如需肺动脉瓣下反复消融或高能量消融时,则提示病例可能为PAVAs,从而需PA标测、消融。由于PA与冠状动脉位置毗邻,在消融前后,必要时应行冠状动脉造影,以评估和确定其安全性。若消融导管电极与冠状动脉相距<5 mm,则不建议行导管消融。另外,鉴于PA特定的解剖特点,在PA内消融时需格外小心,应适当降低消融能量并适当延长消融时间[1,9]。
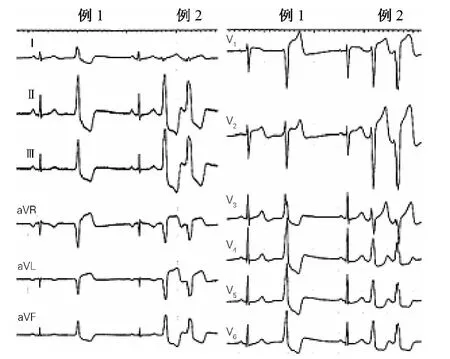
图5 PA-VAs与His束附近起源室性心律失常的心电图鉴别Fig.5 The electrocardiographic characteristics of VAsoriginating from PA and His bundle
对于临床上常见的移行导联早于V3导联的特发性室性心动过速(idiopathic ventricular tachycardia,IVT),建议首先经静脉途径进入RVOT标测,不满意则行PA标测;若静脉途径标测不满意,可经动脉途径进入左心室流出道(left ventricular outflow tract,LVOT)标测,再不满意则进入冠状窦标测;若上述两者均不满意,则可穿刺心包尝试行心外膜标测。
总之,PA-VAs与RVOT-VAs等在心电图上很相似,其发病率虽低,但根据体表心电图的一些特点可辅助快速定位,而要做到精确定位和确诊仍需借助于心内电生理的细致标测。对于形态似RVOT-VAs而消融效果差的患者,应考虑PA-VAs的可能。
[1]Tada H,Tadokoro K,Miyaji K,et al.Idiopathic ventricular arrhythmias arising from the pulmonary artery:prevalence,characteristics,and topography of the arrhythmia origin[J].Heart Rhythm,2008,5(3):419-426.
[2]Sekiguchi Y,Aonuma K,Takahashi A,et al.Electrocardiographic and electrophysiologic characteristics of ventricular tachycardia originating within the pulmonary artery[J].J Am Coll Cardiol,2005,45(6):887 -895.
[3]Lee DI,Park SW,Kook H,et al.Unusual polymorphic ventricular tachycardia originating from the pulmonary artery[J].Korean Circ J,2013,43(2):119 -122.
[4]Maruyama M,Yamamoto T,Miyauchi Y,et al.Exit from the right ventricular outflow tract through the preferential conduction pathway in premature ventricular contractions originating from the pulmonary artery[J].Heart Rhythm,2013,10(9):1407-1408.
[5]Hasdemir C,Aktas S,Govsa F,et al.Demonstration of ventricular myocardial extensions into the pulmonary artery and aorta beyond the ventriculo-arterial junction[J].Pacing Clin Electrophysiol,2007,30(4):534 -539.
[6]Moorman AF,Christoffels VM.Cardiac chamber formation:development,genes,and evolution[J].Physiol Rev,2003,83(4):1223-1267.
[7]Timmermans C,Rodriguez LM,Crijns HJ,et al.Idiopathic left bundle-branch block-shaped ventricular tachycardia may originate above the pulmonary valve[J].Circulation,2003,108(16):1960-1967.
[8]Timmermans C,Rodriguez LM,Medeiros A,et al.Radiofrequency catheter ablation of idiopathic ventricular tachycardia originating in the main stem of the pulmonary artery[J].J Cardiovasc Electrophysiol,2002,13(3):281 -284.
[9]Yamashina Y,Yagi T,Namekawa A,et al.Clinical and electrophysiological difference between idiopathic right ventricular outflow tract arrhythmias and pulmonary artery arrhythmias[J].J Cardiovasc Electrophysiol,2010,21(2):163 -169.
[10]Ouyang F,Fotuhi P,Ho SY,et al.Repetitive monomorphic ventricular tachycardia originating from the aortic sinus cusp:electrocardiographic characterization for guiding catheter ablation[J].J Am Coll Cardiol,2002,39(3):500 -508.
[11]Yamauchi Y,Aonuma K,Takahashi A,et al.Electrocardiographic characteristics of repetitive monomorphic right ventricular tachycardia originating near the His-bundle[J].J Cardiovasc Electrophysiol,2005,16(10):1041 -1048.

