小鼠肺细小动脉平滑肌细胞原代培养和鉴定以及低氧对其增殖与凋亡的影响*
虞晓明, 郭 瑞, 唐江锋, 黄晓颖, 王良兴
近年来基因敲除和基因导入小鼠模型已广泛应 用于肺循环疾病的在体研究[1]。而体外模型仍以大鼠为主要研究对象,基因敲除小鼠由于技术问题难以进入体外研究领域,特别是小鼠肺细小动脉平滑肌细胞(pulmonary arteriolar smooth muscle cells,PASMCs)的传代培养,国内外鲜少报道。国内外肺循环离体培养目前大多采用大鼠为研究对象,难以与在体研究的基因敲除小鼠模型研究相匹配。体循环虽可见少数主动脉平滑肌细胞培养的体外研究[2],但与主动脉相比,肺细小动脉更难分离,平滑肌细胞更加脆弱,技术上更加困难。国外关于小鼠PASMCs培养仅限于原代培养,且所用的试剂复杂[3],目前尚未见PASMCs传代的研究报告。因此,如何便捷、高效地培养小鼠原代PASMCs及传代,对传统的体外培养提出了一个新的挑战。本研究室不断探索与研究,发现采用酶消化结合血清铺底法培养小鼠原代PASMCs方法简单、重复性好,改良传代法可以更好地保持细胞的活性,并经初步探索发现低氧促进小鼠PASMCs的增殖,抑制其凋亡,为肺循环疾病[4]的研究提供可靠的体外模型。
材料和方法
1 主要材料
健康雄性BALB/c小鼠(23±2)g,购自上海斯莱克实验动物有限公司;DMEM、胎牛血清(fetal bovine serum,FBS)、青-链霉素(双抗)、0.25% 胰酶/EDTA和0.25%胰酶(不含EDTA)均为Gibco产品;磷酸盐缓冲液(PBS)和苏木素购自Solarbio;小鼠源性 α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体购自Abcam;DyLightTM488结合的山羊抗小鼠IgG、Triton X-100购自上海博蕴生物科技公司;胶原酶I和4′,6-二脒基-2-苯吲哚盐酸(DAPI)购自Sigma;鼠二步法检测试剂盒和DAB显色试剂盒购自北京中杉金桥;Cell Counting Kit-8(CCK-8)购自日本同仁研究所;In Site Cell Death Detection Kit和POD检测试剂盒购自Roche。
2P ASMCs的培养
2.1 胶原酶I消化结合血清铺底法培养原代
PASMCs(1)麻醉小鼠:健康雄性BALB/c小鼠,用10%水合氯醛0.1 mL经腹腔注射麻醉,放入预先配好的75%乙醇中浸泡3~5 min。(2)取心肺组织:颈椎脱臼法处死小鼠后在超净平台内,迅速剖开胸腔取心肺组织,放入盛有无菌PBS液体的培养皿中,清洗2~3次。(3)分离肺细小动脉:在超净平台内,体视显微镜直视下分离肺细小动脉。把肺动脉外纤维膜剥离干净,保留2~4级的肺细小动脉用于原代培养,将分离的动脉放于含双抗的PBS中漂洗数次。小鼠肺动脉细而薄,内皮细胞数量少,为避免损伤平滑肌细胞,勿需去除内皮细胞。(4)消化:将肺动脉剪成约1 mm×1 mm大小,放入盛有0.2%胶原酶I的离心管中,轻柔摇动数次。置于CO2培养箱中,消化50~80 min。(5)细胞贴壁:待动脉碎块消化成絮状物,1 000 r/min离心5 min,弃上清。加入1 mL含10%FBS的DMEM,吹打均匀后,转移至预先500 μL FBS铺底的25 cm2培养瓶后置于37℃、5%CO2培养箱继续培养。(6)24~48 h后,观察细胞贴壁情况,补充1 mL含10%FBS的DMEM,3~5 d可见细胞呈梭形。1周前后细胞融合生长,约长满培养瓶80%,即可传代培养。
2.2 PASMCs的传代培养 细胞生长达培养瓶80% ~90%时,弃培养液,PBS清洗培养瓶2~3次,加入适量0.25%胰酶/EDTA,均匀摇晃2~3次培养瓶后迅速吸去胰蛋白酶,留约12 μl/cm2的胰蛋白酶量,再补 8 μl/cm20.25% 胰酶(不含 EDTA),置于CO2培养箱中消化约1~3 min,镜下观察胞质回缩,细胞大量浮于液体中时加入适量含10%FBS的DMEM终止消化,反复吹打制成单细胞悬液,弃去传统的离心步骤。按1∶2将细胞悬液均匀分置于培养瓶中,加适量含10%FBS的DMEM培养液,培养箱中继续培养。5~7 d即可传代,3~5 d换液,依据细胞活性可传3~5代。
3P ASMCs的纯化
3.1 人工纯化 在分离肺动脉的过程中,尽量剥离干净肺动脉外纤维膜是关键。本实验采用体视显微镜(Nikon SMZ 745T),高效剥除肺动脉外膜,为小鼠PASMCs的培养传代提供了明显的优势。在培养过程中仍混有的细胞可用以下方法除去。(1)机械刮除法:即采用机械方法去除不需要的细胞区域,而保留PASMCs区域:显微镜下观察细胞形态(成纤维细胞多呈瘦长状,有触角),用记号笔标记成纤维细胞区域后,用弯头滴管反复推刮标记区域,不要伤及PASMCs区域,推刮后用PBS冲洗,加培养液继续培养。反复多次可以纯化细胞,操作过程中严格无菌,防止污染。(2)酶消化法:成纤维细胞和PASMCs对胰蛋白酶的耐受性不同,在消化培养细胞时,常是成纤维细胞先于PASMCs脱壁,特别是在原代和培养早期的细胞这种差别尤为明显,因而可以利用这种差别来纯化。在小鼠PASMCs的传代过程中,实际上也利用了酶消化法来纯化。(3)反复贴壁法:小鼠成纤维细胞与PASMCs相比,其贴壁过程快,贴壁时间大约10~15 min,而PASMCs贴壁时间一般在1~4 h以上,可以利用这个特点来纯化细胞:0.25%胰蛋白酶消化细胞后,加入含10%血清培养基吹打制成细胞悬液后接种于培养瓶内,放入培养箱内静置约10 min,镜下观察有部分成纤维细胞贴壁,将未贴壁细胞转到第2个培养瓶中,再次静置约10 min,未贴壁细胞转到第3个培养瓶中,第3瓶中即为较纯的PASMCs。
3.2 自然纯化法 平滑肌细胞的组织量较上皮细胞和内皮细胞的组织量多,利用PASMCs的增殖优势抑制前两者细胞的生长,最后留下增殖较旺盛的平滑肌细胞。平滑肌细胞的纯度会随着传代次数的增加而逐渐增高。
4P ASMCs的鉴定
4.1 细胞形态鉴定 镜下观察原代培养细胞的形态,并摄片保存。
4.2 免疫细胞化学鉴定 (1)将PASMCs接种于含有盖玻片的6孔板中,培养1~2 d。(2)弃培养液,加入PBS,漂洗细胞爬片,5 min×3次。(3)4%多聚甲醛室温固定30 min,PBS漂洗5 min×3次。(4)用0.1%Triton X-100(PBS配制)室温下渗透细胞10 min,PBS漂洗5 min×3次。(5)加入小鼠源性 α-肌动蛋白单克隆抗体(稀释比1∶200,PBS稀释),4℃过夜。(6)在PBS液中漂洗5 min×3次,加入鼠二步法试剂,并于37℃水浴箱中孵育30 min。(7)PBS漂洗5 min×3次。(8)DAB溶液显色,苏木素复染,清水漂洗。(9)在浓度为75%→85%→95%→100%梯度乙醇脱水,最后中性树胶封片保存。
4.3 免疫荧光染色法鉴定 (1)细胞爬片后固定及通透过程如免疫细胞化学鉴定中的1~4步骤。(2)3%山羊血清(PBS配制)封闭非特异性抗原30 min。(3)小鼠源性 α-肌动蛋白单克隆抗体(稀释比1∶100,PBS稀释),4 ℃过夜。(4)PBS漂洗5 min×3次后,滴加 DylightTM488山羊抗小鼠 IgG(稀释比1∶200,PBS稀释)室温避光孵育细胞1 h,PBS漂洗5 min×3次。(5)滴加细胞核染色液DAPI(1 mg/L)室温避光孵育3~5 min,PBS漂洗5 min×3次。(6)免疫荧光显微镜下对同一视野以不同激发波长(Dylight488:488 nm和DAPI:358 nm)观察并摄片。
4.4 细胞常氧与低氧实验分组 取生长良好的对数生长期细胞,消化后分组接种。一般细胞长满80%左右时,换无血清培养液饥饿培养24 h同步化,然后分别常氧条件(37 ℃、21%O2、5%CO2、74%N2)和低氧条件(37 ℃、5%O2、5%CO2、90%N2)下培养24 h。
4.5 CCK-8染色法检测细胞的活性 细胞接种于96 孔培养板,密度约为 8 ×107cells/L,100 μL/well,用含10%FBS的 DMEM 补到200 μL,在37℃、5%CO2条件下培养约24 h。每组均6孔,每孔溶液总体积均为200 μL,并设置不含细胞的空白对照组。显微镜下见细胞长满80%左右时换无血清的DMEM培养基饥饿同化24 h,分别于常氧和低氧下培养24 h。干预结束后,弃上清,各孔加入无血清DMEM 100 μL+CCK-8试剂10 μL,避光继续培养2 ~4 h。酶标仪测定450 nm波长处各孔吸光度(absorbance,A值)。
4.6 TUNEL法测定细胞的凋亡 分组干预结束后,细胞爬片用PBS液短暂漂洗2次(1 min×2次),4%多聚甲醛(PBS配制,pH 7.4)在15~25℃下固定1 h;PBS漂洗5 min×3次后,3%H2O2(甲醇配制),15~25℃下孵育10 min后,PBS漂洗5 min×3次。0.1%Triton X-100(0.1%柠檬酸钠配制),2~8℃促渗2 min,PBS漂洗5 min×3次,吸干样品周围的水分,每张玻片滴加现配TUNEL reaction mixture(体积比 enzyme solution:label solution=1∶9)50 μL,置湿盒中,于37℃恒温水浴箱孵育60 min后,PBS漂洗5 min×3次;滴加50 μL Convert-POD,置37 ℃恒温水浴箱孵育30 min后,PBS漂洗5 min×3次;室温下滴加DAB显色试剂混合液,显色约5 min,显微镜下观察,适时终止反应。苏木素复染,清水漂洗,封片同免疫细胞化学鉴定。按下法制备阳性对照样品:将经固定和通透处理的细胞与重组的DNase I反应10 min。阴性对照样品的制备:将经固定和通透处理的细胞与50 μL/well的标记溶液一起孵育,余步骤同上。
5 统计学处理
用SPSS 17.0统计软件分析。数据用均数±标准差(mean±SD)表示,方差齐性采用Levene检验,两组间比较采用两独立样本的t检验。以P<0.05为差异有统计学意义。
结 果
1 细胞生长情况
倒置相差显微镜下,刚种植的细胞呈圆形、透亮、单个或呈细胞团分布,组织块则变得疏松,细胞间隙变大;1~2 d后见大部分单细胞贴壁,呈圆形,少量未贴壁细胞上浮;3~5 d可见贴壁细胞数量明显增多,多呈梭形,或呈三角形等形状,见图1。5~7 d细胞可铺满80% ~90%的25 cm2的培养瓶。传代后的细胞形态上与原代相比差异较大,见图2,细胞多铺展开来,形态各异,经鉴定确定为PASMCs。

Figure 1.Primary culture of pulmonary arteriolar smooth muscle cells.A:explant method after digestion(×100);B:digestion method(×100);C:digestion method(×200).图1 原代肺细小动脉平滑肌细胞

Figure 2.Passages of cultured pulmonary arteriolar smooth muscle cells(×100).A:the 2nd generation;B:the 3rd generation.图2 传代肺细小动脉平滑肌细胞
2 鉴定结果
免疫细胞化学结果显示约95%细胞都能表达α-SMA,细胞胞浆呈棕黄色,胞质中有细丝状物质,为肌动蛋白,见图3;免疫荧光结果也同样显示约95%细胞为平滑肌细胞,见图4。
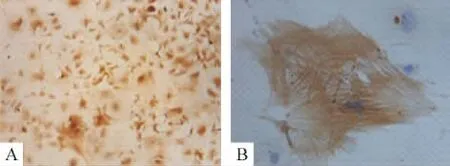
Figure 3.Immunocytochemistry staining with α-smooth muscle actin antibody showed brown parallel myofilament(A:×50;B:×400).图3 免疫细胞化学法结果
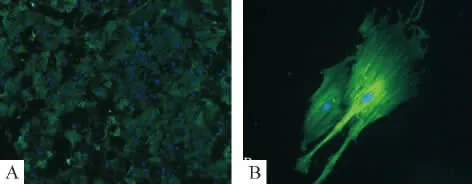
Figure 4.Immunofluorescence staining with α-smooth muscle actin antibody showed myofilament(A:×100;B:×200).图4 免疫荧光染色法结果
3 CCK-8测定细胞增殖结果
CCK-8 A值与细胞数量成正比,其值大小可作为细胞相对数量的比较。如表1所示,低氧组A值高于常氧对照组(P<0.05),提示低氧组小鼠PASMCs增殖明显。
4 TUNEL法测定细胞的凋亡结果
细胞核染成棕黄色为阳性细胞,即凋亡细胞,随机取6个高倍视野(×400)计算凋亡指数(apoptotic Index,AI),AI=(视野内凋亡 PASMCs数/视野内所有PASMCs数)×100%。如图5、表1所示,低氧组AI值低于常氧对照组(P<0.05),提示低氧组小鼠PASMCs凋亡减少。
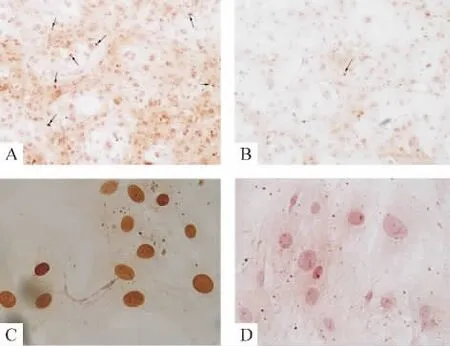
Figure 5.Effects of normoxia and hypoxia interventions on apoptosis of mouse PASMCs(TUNEL method).A:control group(×100);B:hypoxia(24 h)group(×100);C:positive control(×400);D:negative control(×400).Arrows show the apoptotic nuclei.图5 TUNEL检测常氧和低氧干预对小鼠PASMCs凋亡的影响
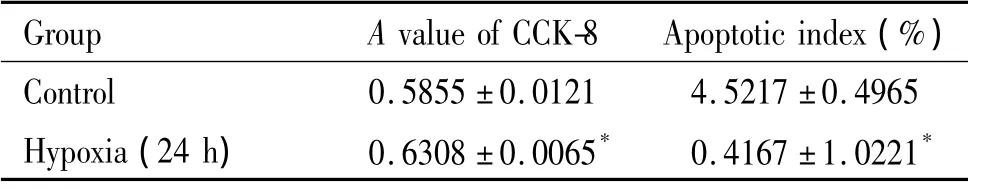
表1 常氧和低氧干预对小鼠PASMCs CCK-8 A值和凋亡指数的影响Table 1.Effects of normoxia and hypoxia interventions on CCK-8 A value and apoptotic index of mouse PASMCs(Mean±SD.n=6)
讨 论
基因敲除小鼠在体模型广泛应用于肺循环的研究,对离体PASMCs培养技术提出了挑战。基因敲除动物皆为小鼠,如离体研究采用大鼠,则与在体研究无法匹配。离体小鼠PASMCs培养方法的研究成为十分迫切的研究课题。
肺细小动脉较主动脉或肠动脉等其它体循环动脉更难获得,需要精密的仪器和熟练的分离技术,分离较多的肺细小动脉量及剥离干净纤维外膜在培养和纯化中起了关键的作用。近年来对PASMCs的原代培养方法主要有组织贴壁法和酶消化法,但单纯组织贴壁法培养周期长且难传代,本研究室结合前期较为成熟的大鼠PASMCs的原代培养方法[5],建立了胶原酶 I消化结合血清铺底法培养小鼠PASMCs,方法简单、酶消化时间易控制、培养周期短、重复性好,易于传代,并发现低氧可以促进小鼠PASMCs的增殖,抑制其凋亡。
实验过程中,以下步骤需要注意:(1)乙醇浸泡小鼠过程中,注意使其头向上,避免乙醇吸入气管;(2)为保证得到充足的肺细小动脉量,尽量分离并保留多级肺动脉分支(图6),外膜尽可能剥离干净;(3)传代过程中弃除传统的离心步骤减少对细胞损伤;(4)传代后待细胞基本贴壁后及时换液,减少胰酶/EDTA对细胞的影响。
此外,增加肺细小动脉组织量可以大大减少原代生长时间;原代培养初期减少培养基量可以加速细胞的贴壁;PASMCs在培养瓶里较培养皿更容易贴壁生长,生长状态更好。传代后的小鼠PASMCs没有像大鼠PASMCs典型的“峰-谷”样生长规律,而是大面积地铺展开生长,形态万千,但经过鉴定仍为平滑肌细胞。小鼠PASMCs的形态不典型性影响研究者对传代成功与否的判断。
胶原酶I消化结合血清铺底法培养小鼠PASMCs,是一种值得推广的小鼠PASMCs体外培养方法,低氧可以促进小鼠PASMCs的增殖,抑制其凋亡。
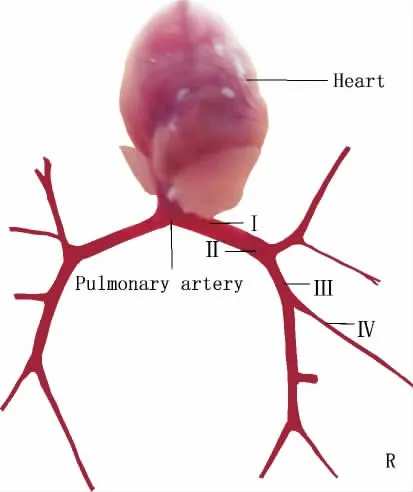
Figure 6.The separated pulmonary artery(×5).Ⅰ:primary branch;Ⅱ:secondary branch;Ⅲ:third branch;Ⅳ:fourth branch.图6 各级肺动脉
[1] Mizuno S,Bogaard HJ,Kraskauskas D,et al.p53 Gene deficiency promotes hypoxia-induced pulmonary hypertension and vascular remodeling in mice[J].Am J Physiol Lung Cell Mol Physiol,2011,300(5):L753-L761.
[2] 周晓莉,雷 寒,柳 青.小鼠主动脉平滑肌细胞的培养[J].基础医学与临床,2005,25(6):564-567.
[3] Ng Lc,O’Neill KG,French D,et al.TRPC1 and Orai1 interact with STIM1 and mediate capacitative Ca2+entry caused by acute hypoxia in mouse pulmonary arterial smooth muscle cells[J].Am J Physiol Cell Physiol,2012,303(11):C1156-C1172.
[4] Hoeper MM,Mayer E,Simonneau G,et al.Chronic thromboembolic pulmonary hypertension [J]. Circulation,2006,113(16):2011-2020.
[5] 钱国清,王良兴,陈 蝉,等.大鼠细小肺动脉平滑肌细胞原代培养和鉴定方法的研究[J].中国应用生理学杂志,2010,26(1):125-128.

