动脉粥样硬化性脑梗死患者血浆抗凝血酶Ⅲ的变化及其机制*
林旭红, 魏丹丹, 王慧超, 徐 静, 王见涛,白春洋, 王亚强, 赵耀亭, 李倩一, 任学群
脑梗死又称缺血性脑卒中(cerebral ischemic stroke,CIS),是指急性起病迅速出现的脑组织因缺血、缺氧而发生的局限性或弥漫性脑功能缺损征象的血管性事件,其导致的死亡率居全球第三[1]。脑梗死的主要病理是由于供应脑部血液的动脉出现粥样硬化和血栓形成,使管腔狭窄甚至闭塞,导致局灶性急性脑供血不足而发病。脑卒中以其高发病率、高病死率、高致残率而构成对人类健康的巨大威胁,因此探讨其发病机制对防治脑血管病具有重大社会意义。本研究通过检测55例脑梗死患者血浆抗凝血酶Ⅲ(antithrombinⅢ,AT-Ⅲ)水平,探讨其与脑动脉血栓形成的关系,以及AT-Ⅲ在脑动脉血栓形成中变化的机制,为脑卒中的防治提供有意义的理论基础。
材料和方法
1 研究对象与分组
病例来自2012年11月~2013年4月河南大学淮河医院神经内科住院患者。实验组55例,其中男35例,女20例,年龄30~82岁,平均年龄(64.2±11.3)岁。符合1995年第四届全国脑血管病会议修订的诊断标准,经头部CT或MRI证实,并且经TCD(经颅彩色多普勒超声)及颈部CDFI(颈部彩色多普勒超声)证实除外血管狭窄及硬化;同时符合美国国立卫生研究院卒中量表积分(National Institutes of Health Stroke Scale,NIHSS)>2,从症状发生到血标本收集时间间隔≤48 h。患者生理功能及神经损伤程度根据NIHSS[2]评估,分值越大,卒中程度越重。另选我院同期健康体检者55例为正常对照组,其中男30例,女25例,年龄28~77岁,平均年龄(62.3±5.8)岁,与实验组相匹配,见表1。所有病例均除外3个月内手术史、外伤、急慢性肝病、血液系统疾病、肾病综合征、急慢性炎症疾病及口服避孕药等情况。
2 方法
2.1 标本采集和制备 受试者于入院次日晨空腹抽静脉血,部分全血用于分离、鉴定、培养单核细胞,取3.6 mL加入0.109 mmol/L枸橼酸钠0.4 mL抗凝
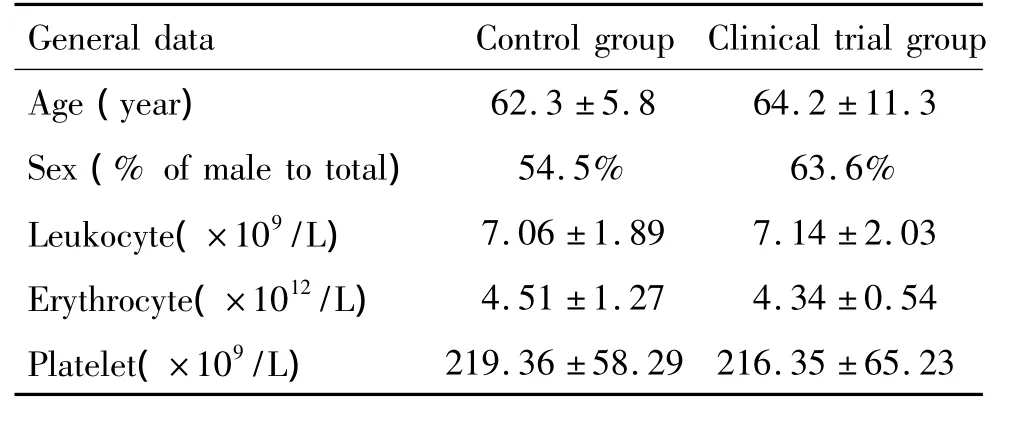
表1 试验组与对照组一般情况比较Table 1.Comparison of the general clinical data(Mean±SD.n=55)
试管中,3 000 r/min离心10 min,上层血浆测定AT-Ⅲ活性;另取肝素抗凝血血浆,分成3份备用,分别测定免疫复合物、常规生化项目及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素 6(interleukin 6,IL-6)水平;EDTA抗凝血分离单核细胞,进行流式细胞术检测。对照组空腹采集肘静脉血,标本处理与试验组相同。
2.2 发色动物法测定AT-Ⅲ活性 应用STAGO-R Evolution全自动血凝仪以发色动物法直接上机测定血浆AT-Ⅲ活性,试剂为配套 AT-Ⅲ试剂1(凝血酶)、2(底物)和3(凝血酶溶剂)。
2.3 常规生化项目的检测 用Olympus 2700全自动生化分析仪对所有肝素抗凝血血浆进行常规生化项目的测定,包括空腹血糖、甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白和同型半胱氨酸。
2.4 循环免疫复合物水平测定 参照Thomas等[3]的方法,根据说明书操作,应用商业化MicroVue CICRaji Cell Replacement EIA kit(Quidel)试剂盒测定血浆循环免疫复合物水平,每个样本重复2次,求均值。
2.5 血浆TNF-α和IL-6水平 另1份肝素抗凝血浆置于-80℃冰箱中保存,采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒(Sigma)进行血浆TNF-α和IL-6水平测定,严格按照说明书操作。
2.6 外周血单核细胞分离 参照姚婷等[4]的方法,分离外周血单核细胞,即全血经Hanks液稀释1倍后用淋巴细胞分离液常规分离,取单个核细胞层,Hanks液洗涤3次后,用10% 牛血清培养液调整细胞浓度为1×1010/L。将该浓度的外周血单个核细胞悬液加入96孔细胞培养板,每孔200 μL,置CO2培养箱中过夜,以使单个核细胞充分贴壁;用温Hanks液洗涤3次,去除非黏附细胞,贴壁的即为单核细胞。经CD14单克隆荧光抗体染色后上流式细胞仪检测,证实所得细胞80% 以上为单核细胞。
2.7 单核细胞数量及表型测定 获取培养好的单核细胞,用分离缓冲液(PBS;20 mmol/L HEPES,pH 7.4;10 mmol/L EDTA;0.5%BSA)准备单细胞悬液,剧烈吹打。洗完后分别与 CD14、CD16、CD32、CD64抗体孵育,固定于1%多聚甲醛。参照 Scaldaferri等[5]的方法,用Coulter Epics XL流式细胞仪(Beckman Coulter)测定单核细胞数量及表型,进行定量流式细胞分析。细胞表面分子表达定量采用WinList 5.0软件分析。
2.8 免疫复合物刺激对外周血单核细胞TNF-α和IL-6分泌的影响 参照Prehn等[6]的方法,制备板固定交联人类IgG(复合IgG),即12孔板中每孔加入1 mL溶于PBS(0.5 g/L)中的人类IgG(Jackson ImmunoResearch Laboratories)共孵育过夜,PBS洗,与750 μL溶于 PBS(20 mg/L)中的小鼠抗人 IgG(Jackson ImmunoResearch Laboratories)共孵育1 h。包被好的孔板在加入细胞之前用PBS洗。将分离好的单核细胞用加入含有不同浓度(0.1~1 000 mg/L)Ig-IC复合物的12孔板刺激18 h,收集细胞上清,ELISA法测定上清液中TNF-α和IL-6水平。可溶性人类IgG(hIgG)作为对照。
2.9 TNF-α和IL-6对人脑血管内皮细胞AT-Ⅲ表达的影响 人脑血管内皮细胞(human brain vascular endothelial cells,HBVECs;源于胎脑血管,ScienCell提供)复苏后置于5%CO2、37℃恒温培养箱中培养16 h,贴壁后以5 mL 0.25%胰酶消化,并加入约10 mL胰蛋白酶中和液,用滴管吹打,使细胞全部脱离培养瓶壁,1 000 r/min离心5 min,沉淀细胞,进行分装传代。将传至4代的HBVECs分别接种于60 mm培养皿和6孔板中,当细胞生长至60% ~70%融合时,弃培养液,PBS清洗3遍后,加入TNF-α或IL-6刺激24 h,培养结束后离心取细胞上清液,参照Li等[7]的方法,用Western blotting法测定上清中AT-Ⅲ蛋白表达水平。
3 统计学处理
应用SPSS 11.5软件分析,数据以均数±标准差(mean±SD)表示,组间比较采用t检验,多元线性相关分析用来评价血浆AT-Ⅲ活性与神经损伤程度、脑血管病危险因素(血压、空腹血糖及血脂、同型半胱氨酸等)的关系。以P<0.05为差异有统计学意义。
结 果
1 血浆AT-Ⅲ活性的变化
如图1所示,与对照组[(97.10±11.63)%]相比,实验组血浆 AT-Ⅲ活性明显降低(84.96±10.37)%,二者差异有统计学意义(P<0.05)。
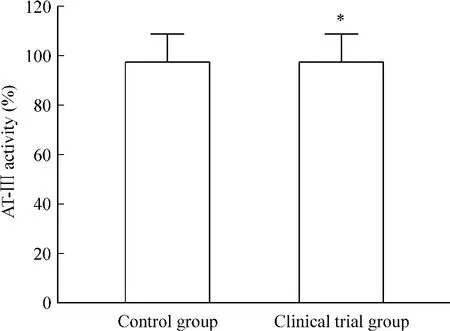
Figure 1.Comparison of AT-Ⅲactivity in the plasma between clinical trial group and control group.Mean±SD.n=55.*P<0.05 vs control group.图1 实验组与对照组血浆AT-Ⅲ活性比较
2 血浆AT-Ⅲ活性与神经系统功能损伤及脑梗死危险因素的相关性分析
将神经功能损伤积分、收缩压、舒张压、空腹血糖、甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白、同型半胱氨酸作为自变量,将血浆AT-Ⅲ活性作为应变量,进行多元线性相关分析,研究发现脑梗死患者血浆AT-Ⅲ活性与神经功能损伤程度呈负相关(r=-0.53,P <0.05),与收缩压(r=-0.18)、舒张压(r=-0.35)、空腹血糖(r=-0.29)、胆固醇(r=-0.79)、甘油三酯(r=-0.61)、低密度脂蛋白(r=-0.75)、同型半胱氨酸(r=-0.80)呈负相关(P<0.05),与高密度脂蛋白呈正相关(r=0.45,P <0.05)。
3 血浆TNF-α和IL-6水平的变化
与对照组[TNF-α(100.00±34.29)%和 IL-6(100.00±46.15)%]比较,实验组的TNF-α和IL-6水平分别为(1 022.98±115.09)%和(505.20±57.57)%,差异均有统计学意义(P<0.01),见图2。
4 血浆免疫复合物水平的变化
如图3所示,与对照组[(8.9±1.5)Eq/L]比较,实验组免疫复合物水平明显升高[(25.3±3.9)Eq/L,P <0.01]。
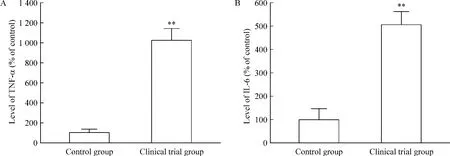
Figure 2.Comparison of TNF-α (A)and IL-6(B)levels in the plasma between clinical trial group and control group.Mean±SD.n=55. **P <0.01 vs control group.图2 试验组与对照组血浆TNF-α和IL-6水平比较
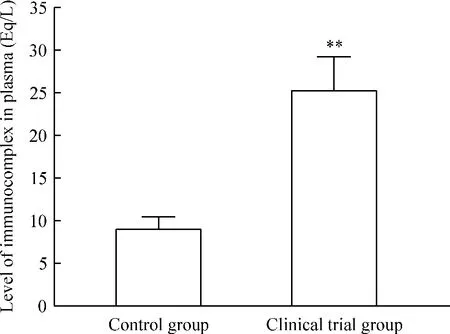
Figure 3.Comparison of immunocomplex level in the plasma between clinical trial group and control group.Mean±SD.n=55.**P<0.01 vs control group.图3 实验组与对照组血浆免疫复合物水平比较
5 外周血单核细胞表面标志物的变化
流式细胞术检测发现,对照组外周血CD14+CD16+单核细胞的百分比为(0.63±0.15)%,CD14+CD32+单核细胞为(5.32±0.98)%,CD14+CD64+单核细胞为(4.81±0.76)%,实验组三者比例分别为(0.71±0.19)%、(5.51±0.27)% 和(8.79±0.42)%,其中CD14+CD64+的单核细胞比例与对照组比较明显升高,差异显著(P<0.05),而CD14+CD16+和 CD14+CD32+单核细胞无明显变化,见图 4、5。
6 免疫复合物刺激对外周血单核细胞TNF-α和IL-6分泌的影响
与对照组比较,经免疫复合物刺激后,外周血单核细胞TNF-α和IL-6的分泌水平均呈浓度依赖性明显升高,在1 000 mg/L hIgG时分别达到3 700 ng/L和1 100 ng/L(P <0.01),见图6。
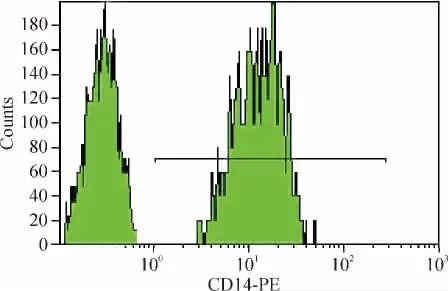
Figure 4.Isolation and identification of monocytes in the peri-pheral blood.Left:negative control;right:CD14+cells.图4 外周血单核细胞的分离和鉴定
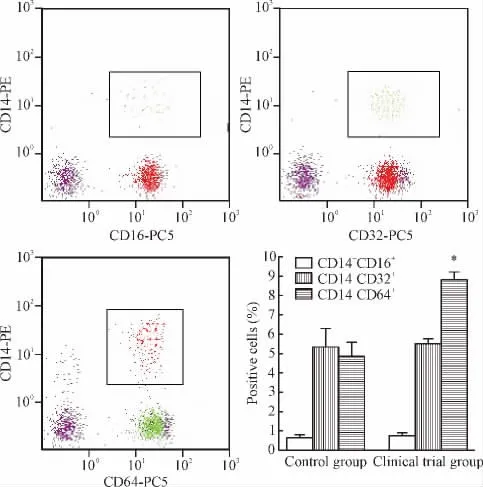
Figure 5.Comparison of the monocyte surface markers in the peripheral blood between clinical trial group and control group.Mean±SD.n=55.*P<0.05 vs control group.图5 实验组与对照组外周血单核细胞表面标志物比较
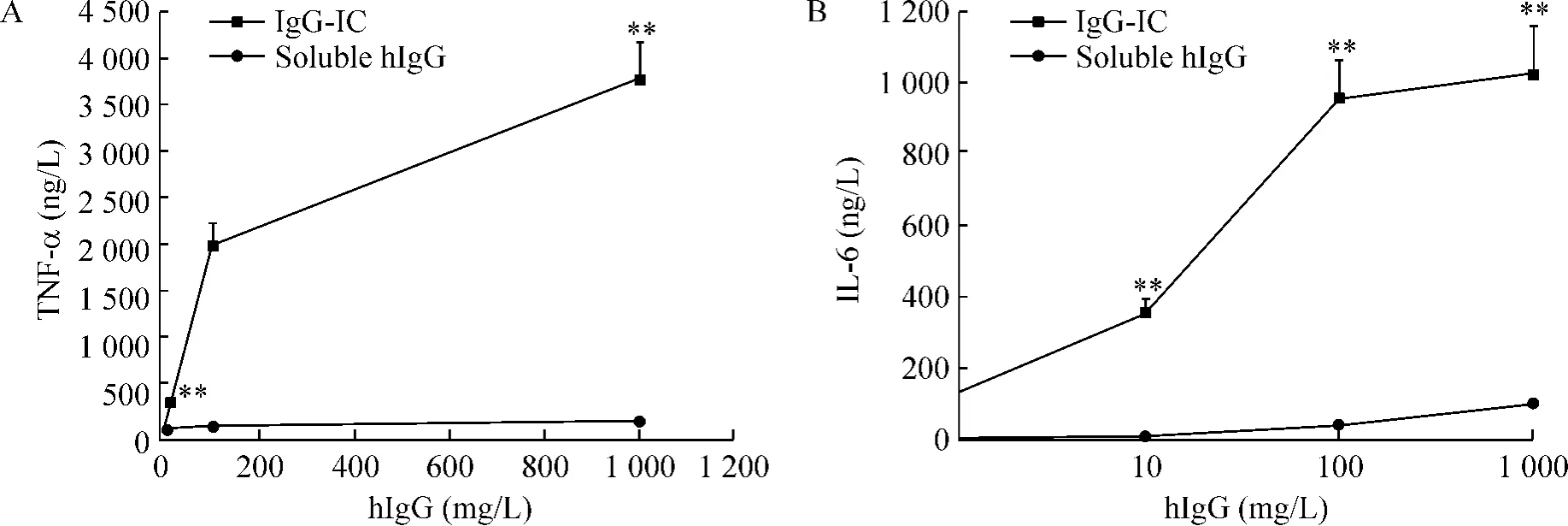
Figure 6.The levels of TNF-α (A)and IL-6(B)induced by stimulation of immunocomplex in the peripheral blood.Mean±SD.n=55.**P<0.01 vs control group.图6 免疫复合物刺激对外周血单核细胞TNF-α和IL-6分泌的影响
7 TNF-α和IL-6对人脑血管内皮细胞AT-Ⅲ表达的影响
由图7可知,与TNF-α或IL-6共孵育后,HBVECs AT-Ⅲ蛋白表达水平明显下调(P<0.05或P<0.01)。

Figure 7.The effects of TNF-α (A)and IL-6(B)on the expression of AT-Ⅲ in human brain vascular endothelial cells.Mean ±SD.n=10.*P <0.05,**P <0.01 vs control group.图7 TNF-α和IL-6对人脑血管内皮细胞AT-Ⅲ表达的影响
讨 论
动脉粥样硬化性脑梗死的发病机理主要是血管病变基础上,内膜损伤破裂形成溃疡后,血小板等血中有形成份黏附、聚集并释放更多促凝血因子,同时血液成分中脂蛋白、胆固醇、纤维蛋白原等含量增加,使血黏度增高,血流缓慢、凝固性增高,局部脑组织出现急性缺血症状。因此动脉粥样硬化性脑梗死的发生与凝血和抗凝系统的失衡有关,而对凝血系统起制约作用的抗凝系统在动脉粥样硬化性脑梗死的发病中有重要意义。
AT-Ⅲ是主要由肝脏合成的单链糖蛋白,并作为丝氨酸蛋白酶抑制物,作用于诸多凝血因子含丝氨酸残基的活性中心,为血浆生理性抑制凝血的关键物质,参与保持体内抗凝血功能和纤溶系统与凝血系统的动态平衡[8],正常情况下约占血浆总抗凝血酶活性的50% ~70%[9]。当血浆中AT-Ⅲ活性小于70%时,血栓形成的危险性就会增加。有报道指出,冠状动脉粥样硬化可使血管内皮细胞大量受损,故必累及抗凝因子,而其中以抗凝物质减低居多[10]。本研究发现,与冠状动脉粥样硬化相似,动脉粥样硬化性脑梗死患者急性期AT-Ⅲ活性明显降低,可能与凝血酶大量活化,凝血功能亢进消耗有关,加之长期的动脉粥样硬化和高血压等危险因素,使血管内皮细胞不同程度的受损,抗凝因子合成减少,故AT-Ⅲ活性的下降与消耗及合成减少有关。这一结果与最近一项早期应用AT-Ⅲ可降低小鼠脑缺血程度、保护脑神经的研究[11]结果一致;而且血浆AT-Ⅲ活性与脑梗死危险因素相关性分析发现,血浆AT-Ⅲ活性与收缩压、舒张压、空腹血糖、胆固醇、甘油三酯、低密度脂蛋白、同型半胱氨酸呈负相关,与高密度脂蛋白呈正相关。分析其中原因可能为高血压可以导致小动脉的损伤,高血糖、高胆固醇、高甘油三酯和低密度脂蛋白伴随的动脉粥样硬化也会损伤小血管。因此,AT-Ⅲ可能是动脉粥样硬化性脑梗死的危险因子,它反映了动脉粥样硬化的程度和其它原因(高血压等)所致的小血管损伤。实验中还发现,脑梗死患者神经损伤程度与AT-Ⅲ活性也呈负相关,检测AT-Ⅲ活性,可有助于病情监测及指导临床治疗。
越来越多的证据表明,炎症和凝血两大系统间存在很强的相互作用和广泛的交互通话[12],其中促炎细胞因子是最重要的连接炎症和凝血的桥梁。TNF-α主要由巨噬细胞、NK细胞和T细胞产生,主要和局部炎症有关,实验研究证实了其在炎症诱导凝血激活的过程中的重要核心地位:将TNF-α注入人体后检测多种凝血指标,结果显示凝血途径被激活[13]。IL-6是一种也可以激活凝血系统的促炎细胞因子[14],抗IL-6的抗体可以阻止系统感染导致的凝血异常[15]。本研究发现,血浆中的TNF-α和IL-6水平在试验组明显升高,可能是由于局部不稳定斑块中升高的TNF-α和IL-6表达水平导致血浆的TNF-α和IL-6水平升高[16],也可能是由血液中某些细胞直接产生,提示这些促炎细胞因子水平的升高可能与降低的AT-Ⅲ活性有关。
炎症过程和免疫反应是动脉粥样硬化斑块的核心病理过程[17-18]。组织病理学结果进一步显示:斑块中单核细胞、巨噬细胞、淋巴细胞的激活和复杂相互作用,在动脉粥样硬化和斑块不稳定相关的炎症过程中发挥重要作用[19],这种复杂的作用最终引起动脉粥样硬化斑块破裂和急性冠脉综合征。在本实验中发现,血浆病理产物免疫复合物水平也明显升高,为了进一步阐明免疫复合物和细胞因子在动脉粥样硬化性脑梗死患者AT-Ⅲ活性变化中的关系及其机制,我们分离外周血单核细胞并对其表面标志物进行分析,结果发现,CD14+CD16+单核细胞和CD14+CD32+单核细胞数量在对照组和实验组无明显差别,而实验组CD14+CD64+单核细胞数量明显升高,因此我们推测在脑梗死患者,免疫复合物可能通过结合CD14+CD64+的单核细胞,刺激其产生大量促炎细胞因子,导致AT-Ⅲ活性改变。
为了进一步验证上述假设,深入探讨AT-Ⅲ在脑梗死患者变化的机制,我们在体外模拟免疫复合物,并观察其对外周血单核细胞TNF-α和IL-6分泌的影响,结果发现,经免疫复合物刺激后,这些促炎细胞因子的水平均明显升高,通过进一步检测TNF-α和IL-6对人脑血管内皮细胞AT-Ⅲ表达的影响,发现二者均能抑制AT-Ⅲ表达。因此,我们认为动脉粥样硬化性脑梗死患者升高的促炎细胞因子主要来源于血液中受刺激的的单核细胞,这些细胞因子使血管内皮细胞不同程度的受损,抗凝因子合成减少,可能是血浆AT-Ⅲ活性下降的主要原因。
综上所述,AT-Ⅲ活性在动脉粥样硬化性脑梗死患者血浆中明显降低,是脑梗死发病的危险因素之一,且与病情严重程度相关,其可能的机制是免疫复合物通过CD14+CD64+单核细胞介导促炎细胞因子产生,并进一步损伤脑血管内皮细胞,抑制AT-Ⅲ合成。因此,升高AT-Ⅲ活性对缺血脑组织具有保护作用。
[1] Hermus L,Schuitemaker JH,Tio RA,et al.Novel serum biomarkers in carotid artery stenosis:Useful to identify the vulnerable plaque?[J].Clin Biochem,2011,44(16):1292-1298.
[2] Lin HS,Tsai TH,Liu CF,et al.Serum level and prognostic value of neopterin in patients after ischemic stroke[J].Clin Biochem,2012,45(18):1596-1601.
[3] Thomas BN,Diallo DA,Noumsi GT,et al.Circulating immune complex levels are associated with disease severity and seasonality in children with malaria from Mali[J].Biomark Insights,2012,7:81-86.
[4] 姚 婷,王慧娟,秦浚川,等.M-CSF和IL-10对人单核细胞表面分子表达的影响[J].上海免疫学杂志,2003,23(6):374-377.
[5] Scaldaferri F,Sans M,Vetrano S,et al.Crucial role of the protein C pathway in governing microvascular inflammation in inflammatory bowel disease[J].J Clin Invest,2007,117(7):1951-1960.
[6] Prehn JL,Thomas LS,Landers CJ,et al.The T cell costimulator TL1A is induced by FcγR signaling in human monocytes and dendritic cells[J].J Immunol,2007,178(7):4033-4038.
[7] Li YY,Lu S,Li K,et al.Down-regulation of HSP60 expression by RNAi increases lipopolysaccharide-and cerulein-induced damages on isolated rat pancreatic tissues[J].Cell Stress Chaperones,2010,15(6):965-975.
[8] Fourrier F,Chopin C,Goudemand J,et al.Septic shock,multiple organ failure,and disseminated intravascular coagulation.Compared patterns of antithrombin III,protein C,and protein S deficiencies[J].Chest,1992,101(3):816-823.
[9] 苏学飞,黄秋莲.凝血抑制物检测在血栓性疾病的价值[J].国际医药卫生导报,2006,12(7):80-81.
[10]董存岩,周志芳.肝病患者血浆AT-Ⅲ活性检测及意义[J].实用预防医学,2004,11(2):264-265.
[11] Cuomo O,Pignataro G,Gala R,et al.Antithrombin reduces ischemic volume,ameliorates neurologic deficits,and prolongs animal survival in both transient and permanent focal ischemia[J].Stroke,2007,38(12):3272-3279.
[12] Zöller B,Li X,Sundquist J,et al.Autoimmune diseases and venous thromboembolism:a review of the literature[J].Am J Cardiovasc Dis,2012,2(3):171-183.
[13] Olejár T,Matej R,Zadinová M,et al.Expression of proteinase-activated receptor 2 during taurocholate-induced acute pancreatic lesion development in Wistar rats[J].Int J Gastrointest Cancer,2001,30(3):113-121.
[14]Kerr R,Stirling D,Ludlam CA.Interleukin 6 and haemostasis[J].Br J Haematol,2001,115(1):3-12.
[15]Levi M,van der Poll T,ten Cate H,et al.The cytokinemediated imbalance between coagulant and anticoagulant mechanisms in sepsis and endotoxaemia[J].Eur J Clin Invest,1997,27(1):3-9.
[16] Hermus L,Lefrandt JD,Tio RA,et al.Carotid plaque formation and serum biomarkers[J].Atherosclerosis,2010,213(1):21-29.
[17]Yip HK,Sun CK,Chang LT,et al.Strong correlation between serum levels of inflammatory mediators and their distribution in infarct-related coronary artery[J].Circ J,2006,70(7):838-845.
[18]Yip HK,Wang PW,Chang LT,et al.Cytotoxic T lymphocyte antigen 4 gene polymorphism associated with ST-segment elevation acute myocardial infarction[J].Circ J,2007,71(8):1213-1218.
[19] Sugioka K,Naruko T,Hozumi T,et al.Elevated levels of neopterin are associated with carotid plaques with complex morphology in patients with stable angina pectoris[J].Atherosclerosis,2010,208(2):524-530.

