免疫纳米微粒靶向胰腺癌细胞输送siRNA的方法研究*
李佳佳, 陈茵婷, 曾林涓, 练国达, 陈少杰, 李雅晴, 黄开红△
胰腺癌是常见的消化道恶性肿瘤之一,具有发病隐匿、易转移和长期生存率低的特点[1]。除了手术治疗和化疗,基因治疗是一个具有前景的治疗方法,而发展一种安全、高效和肿瘤靶向性的基因输送体系是基因治疗的关键。聚乙烯亚胺(polyethyleneimine,PEI)是最为广泛应用的纳米载体,其具有阳性电荷,能与带阴性电荷的细胞膜结合,获得较高的转染率[2]。IONP(iron oxide nanocrystal with carboxylic acid group)是一种能向细胞输送药物且具有磁共振成像(magnetic resonance imaging,MRI)功能的载体[3]。抗 CD44v6 单链抗体 (anti-CD44v6 single chain variable fragment,scFvCD44v6)是一种具有高度亲和力和靶向性的抗黏附因子,能够靶向地识别CD44v6阳性的肿瘤细胞[4]。课题组前期研究表明,载药(基因)纳米微粒与单克隆抗体进行交联制成免疫纳米微粒,可提高药物对肿瘤细胞的选择性,达到提高疗效和降低毒副作用的目的[5-6]。本研究将IONP、PEI及 scFvCD44v6复合,制备一种高效、靶向地向胰腺癌细胞输送siRNA的免疫纳米载体。
材料和方法
1 材料
人胰腺癌细胞株Panc-1(KRAS突变型)购自上海生物化学与细胞研究所;胎牛血清和高糖型DMEM培养基(Gibco);PEI和MAL-PEG-NHS{O-[N-(3-maleimidopropionyl)aminoethyl]-O-[3-(N-succinimidyloxy)-3-oxopropyl]heptacosaethylene glycol}购自Sigma;IONP购自美国大洋纳米科技公司;兔抗人KRAS单克隆抗体购自Gene Tex;小鼠抗人Tubulin单克隆抗体购自Cell Signaling;FITC标记小鼠抗6×His-tag单克隆抗体购自AbD。CD44v6单链抗体按本课题组已建立的方法合成;siKRAS和siNC(negative control)由上海吉玛公司设计合成;Cy3.3-siNC由广州锐博公司设计合成。
2 方法
2.1 IONP-PEI的制备及其表征的检测 IONP和PEI分别溶于灭菌的去离子水稀释,IONP质量为5 μg,与PEI按照不同质量比混匀,室温下静置20min,得到不同质量比的IONP-PEI复合物。用去离子水稀释至1 500 μL,Zeta-Plus粒度分析仪测粒径和电位。每个样本测5次。
2.2 IONP、PEI以及 IONP/PEI的细胞毒性测定Panc-1细胞接种于96孔板,每孔8×103个细胞,总体积100 μL,3个复孔,贴壁生长24 h后去除旧培养基,加入一定浓度 IONP、PEI、IONP/PEI及新鲜培养基,空白组仅含 DMEM培养基,对照组含细胞和DMEM培养基。37℃、5%CO2培养72 h,去除旧培养基,每孔加入80 μL 新鲜培养基和 20 μL MTS,37℃、5%CO2培养箱中孵育3 h,酶标仪490 nm处测吸光度。独立重复3次。
2.3 IONP-PEI/siRNA的制备及其表征的检测 按IONP 质量为5 μg,IONP 和 PEI质量比为 0.75,制备IONP-PEI复合物;按照不同N/P比值向复合物中加入siRNA,混匀,室温下孵育20 min,得到不同 N/P比的IONP-PEI/siRNA复合物。去离子水稀释至1 500 μL,Zeta-Plus粒度分析仪测粒径和电位。每个样本测5次。
2.4 琼脂糖凝胶阻滞电泳 制备不同N/P比值IONP-PEI/siRNA复合物,siRNA量设定为10 pmol,IONP和PEI的质量比为0.75。将复合物与6×DNA上样缓冲液、胶体金混匀后上样,1%的琼脂糖凝胶,1×TBE缓冲液,恒压100V电泳20 min;在UV凝胶成像仪上观察条带并照相。
2.5 不同N/P比值的IONP-PEI/siRNA对细胞的毒性 Panc-1细胞接种在96孔板,每孔8×103个细胞,总体积100 μL,3个复孔,贴壁生长24h去除旧培养基,加入不同N/P比值的IONP-PEI/siRNA,siRNA的终浓度设定为100 nmol/L,IONP和PEI的质量比为0.75。空白组仅含DMEM培养基,对照组含细胞和DMEM培养基。37℃、5%CO2培养72 h,去除旧培养基,每孔加入80 μL新鲜培养基和20 μL MTS,37℃、5%CO2培养箱中孵育 3 h,酶标仪 490 nm处测吸光度。独立重复3次。
2.6 scFvCD44v6-IONP-PEI/siRNA 的制备 制备IONP-PEI复合物;将MAL-PEG-NHS溶于灭菌去离子水,与PEI按照摩尔比为10∶1加入复合物中,混匀,室温孵育30 min;将已制备的scFvCD44v6与PEI按照质量比为1∶1加入上述复合物中,4℃过夜,使用前5 kD的Millipore超滤离心管3 000 r/min离心10 min去除游离的抗体,得到scFv-IONP-PEI,与siRNA按照 N/P=20复合,室温孵育20min,得到 scFv-IONP-PEI/siRNA。
2.7 转染率的测定 Panc-1细胞每孔5×104个接种在24孔板,贴壁生长24 h。制备不同N/P比值的IONP-PEI/siNC-FAM和N/P比值为20的scFv-IONP-PEI/siNC-FAM,Lipo-2000做阳性对照。siNCFAM的终浓度为100 nmol/L。转染6 h后弃上清,胰酶消化细胞离心,PBS重悬,上流式细胞仪检测荧光率。以上均为避光操作,独立重复3次。
2.8 细胞免疫荧光 制备 scFv-IONP-PEI/siNCCy3,转染6 h后,弃上清,PBS轻洗,4%多聚甲醛室温固定10 min,PBS 轻洗,0.2%Triton X-100/PBS 室温透化10 min;PBS轻洗,1%BSA/PBS室温低速摇床封闭30 min;去除封闭液,孵育FITC标记小鼠抗6×His-tag单克隆抗体(10 mg/L),室温低速摇床孵育30 min;去除抗体,PBS轻洗,Hoechest 33342工作液染核5 min,PBS轻洗;加入PBS,置于荧光显微镜下观察、拍照。观察结束后,去除PBS,加入含3%HCl和1%亚铁氰化钾的普鲁士蓝染色液,37℃孵育30 min。去除染色液,PBS轻洗后显微镜下观察铁染色。
2.9 实时荧光定量 PCR(real-time PCR)检测IONP-PEI/siKRAS和scFv-IONP-PEI/siKRAS转染48 h后,以Trizol试剂提取细胞总RNA,紫外分光光度仪测定RNA纯度及浓度,逆转录,采用SYBR Green染料法,罗氏荧光PCR仪进行荧光PCR反应。以GAPDH为内参照,引物设计如下:KRAS-F:5’-CAGGGTACTTCATTGATGCCACAAC-3’;KRAS-R:5’-GCTGGTCTCCAGGTAACGAACAATA-3’;GAPDH-F:5’-GCACCGTCAAGGCTGAGAAC-3’;GAPDH-R:5’-TGGTGAAGACGCCAGTGGA-3’。PCR反应条件:95℃ 2 min预变性,循环内95℃ 30 s变性,60℃退火35 s,45 个循环。
2.10 Western印迹分析(Western blotting) IONPPEI/siKRAS和scFv-IONP-PEI/siKRAS转染细胞72 h;冷PBS洗2次,用含有蛋白酶抑制剂(PMSF)的RIPA裂解缓冲液裂解细胞,BCA法测定总蛋白浓度。取等量总蛋白于10%SDS-PAGE胶电泳。然后将SDS-PAGE凝胶转移至 PVDF膜中,恒流(200 mA)转膜90 min。取出PVDF膜,置于5%脱脂奶粉中封闭 2 h。加入Ⅰ抗(KRAS 1∶1 000,Tubulin 1∶2 000),4℃过夜,TBST洗膜;Ⅱ抗37℃摇床孵育1 h,TBST洗膜。ECL化学发光试剂盒显影,曝光。
3 统计学处理
应用SPSS 13.0统计软件分析,结果以均数±标准差(mean±SD)表示,均数比较采用χ2和t检验。以P<0.05为差异有统计学意义。
结 果
1 表征检测
IONP-PEI复合物的粒径和电位随着质量比的增大而逐渐减少,在IONP/PEI的质量比等于0.75的时候,复合物的电位为(25.53±2.10)mV,粒径为(45.0±3.1)nm,见表1。较小的粒径和微弱的表面正电利于细胞内吞,故选择IONP/PEI的质量比为0.75制备不同 N/P比值的 IONP-PEI/siRNA,随着N/P比值的增加,该复合物电位逐渐增大,提示siRNA复合得更加完全;粒径则趋于较稳定的状态,见表2。
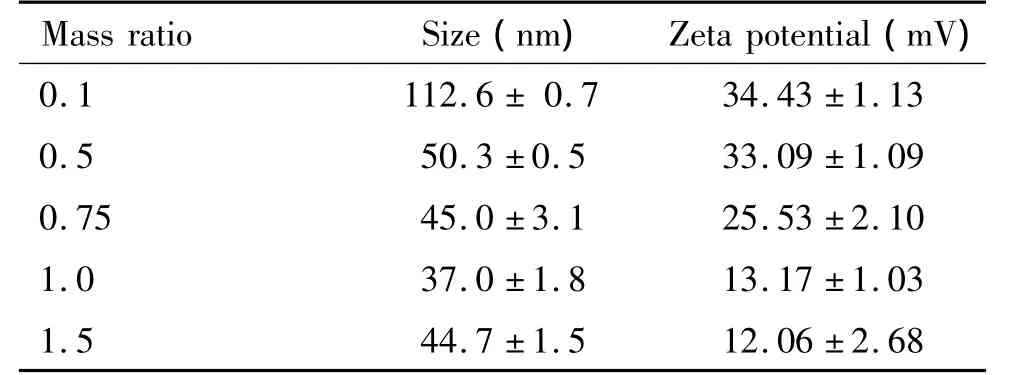
表1 不同质量比IONP-PEI复合物的电位和粒径Table 1.The particle size and zeta potential of IONP-PEI complexes(Mean±SD.n=5)
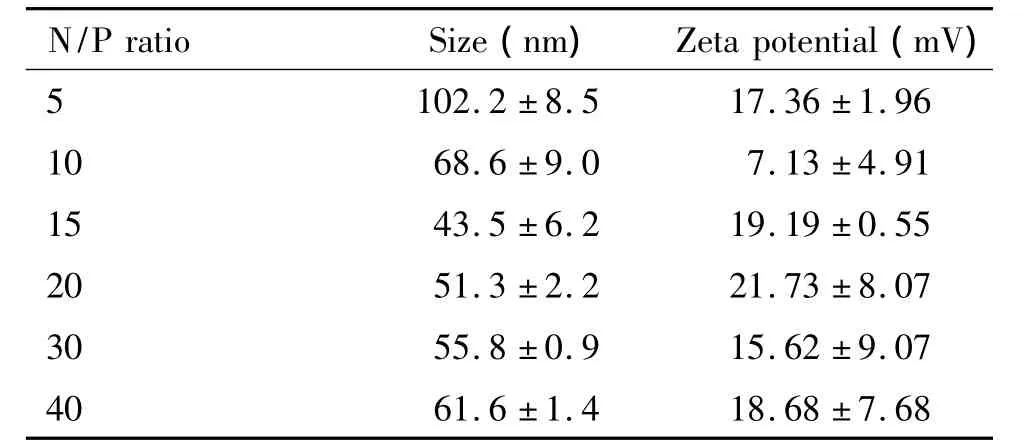
表2 不同N/P比值IONP-PEI/siRNA复合物的电位和粒径Table 2.The particle size and zeta potential of IONP-PEI/siRNA complexes(Mean±SD.n=5)
2 MTS法测细胞存活率
当浓度为 0.01 g/L时,IONP、PEI和 IONP-PEI复合物的细胞毒性都不大,但随着浓度的增加,细胞活力逐渐下降。当浓度为0.5 g/L时,细胞活力分别降至(51.77 ±7.80)%、(65.14 ±3.82)%、(58.53 ±3.38)%,见图1A。IONP-PEI/siRNA的细胞毒性随着N/P比值的增大逐渐增大,在N/P=5时,细胞存活率为(102.97 ±2.94)%,N/P=40 时,细胞存活率降为(93.30 ±3.21)%,见图1B。

Figure 1.Cytotoxicity induced by the polymers of a variety of concentrations in Panc-1 cells(A)and cytotoxicity induced by IONP-PEI/siRNA complexes at different N/P ratios after transfection into Panc-1 cells(B).Mean ±SD.n=3.图1 不同浓度的PEI、IONP和IONP-PEI和不同N/P比值的IONP-PEI/siRNA对Panc-1细胞的毒性
3 琼脂糖凝胶实验
N/P=1时,从复合物中泳出的siRNA条带的亮度较裸siRNA条带明显减弱,表明siRNA的负电荷被阳离子聚合物部分中和。当N/P升至15时,泳出的siRNA条带的亮度非常弱,上升至20或以上,复合物中没有siRNA泳出,提示siRNA的负电荷被阳离子聚合物完全中和,见图2。
4 转染率测定、荧光显微镜观察
N/P比值为5时,转染率为(16.55±1.68)%;随着N/P比值增加,转染率逐渐增加,N/P比值为20时,转染率为(59.87±4.52)%,见图3。在最适N/P比值下,既具有较高的转染率,同时对细胞的活力影响不大,综合细胞毒性、琼脂糖凝胶电泳以及转染率的结果,我们选择N/P比值为20进行后续试验。为了比较scFv靶向组和非靶向组的转染率,分别于转染Panc-1细胞6 h后进行转染率检测和荧光显微镜观察;非靶向组的转染率为(59.87±4.52)%,靶向组的转染率为(89.75±1.81)%,靶向组的转染率明显高于非靶向组,有统计学意义(P<0.05),见图4;且荧光显微镜观察靶向组的红色荧光强度高于非靶向组,见图5。

Figure 2.Gel electrophoresis of IONP-PEI/siRNA complexes at different N/P ratios.Lane 1:naked siRNA;Lane 2:IONP-PEI/siRNA at N/P=1;Lane 3:IONP-PEI/siRNA at N/P=5;Lane 4:IONP-PEI/siRNA at N/P=7.5;Lane 5:IONP-PEI/siRNA at N/P=10;Lane 6:IONP-PEI/siRNA at N/P=15;Lane 7:IONPPEI/siRNA at N/P=20;Lane 8:IONP-PEI/siRNA at N/P=30;Lane 9:IONP-PEI/siRNA at N/P=40.图2 不同N/P比值的IONP-PEI/siRNA复合物的琼脂糖凝胶电泳
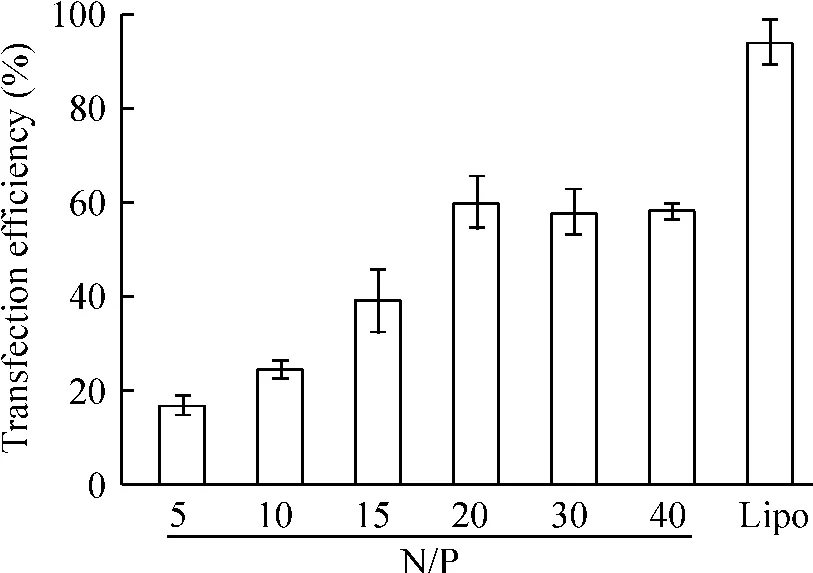
Figure 3.The transfection efficiencies of IONP-PEI/siRNA at different N/P ratios measured by flow cytometry.Mean±SD.n=3.图3 不同N/P比值IONP-PEI/siRNA的转染效率
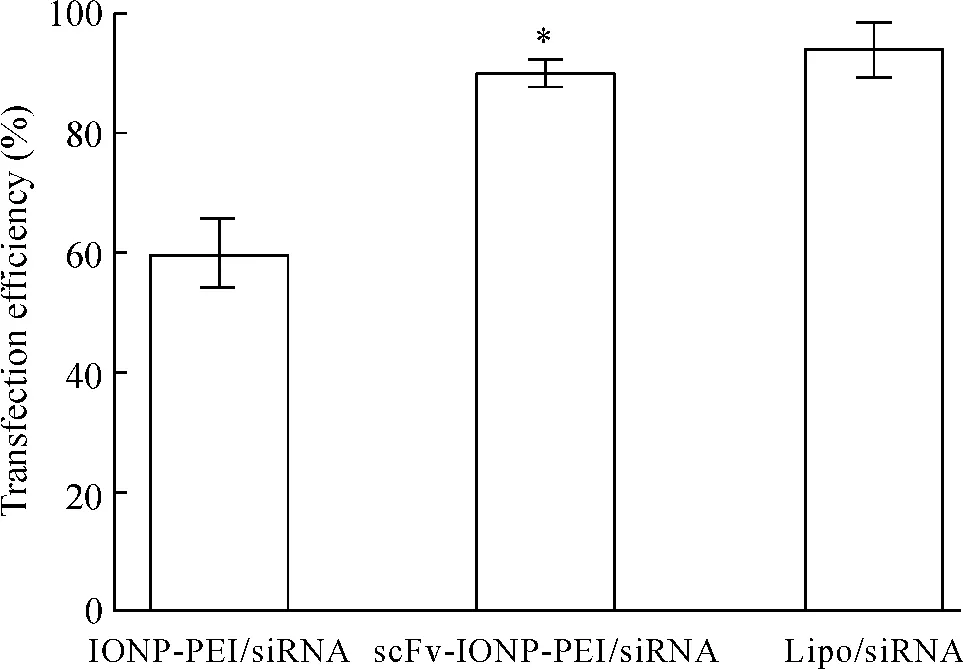
Figure 4. The transfection efficiencies of IONP-PEI/siRNA,scFv-IONP-PEI/siRNA and lipo/siRNA measured by flow cytometry.Mean ± SD.n=3.*P < 0.05 vs IONP-PEI/siRNA.图4 非靶向组IONP-PEI和靶向组scFv-IONP-PEI转染效率的比较

Figure 5.Fluorescence images of Panc-1 cells transfected with siNC-Cy3 by scFvCD44v6-IONP-PEI and IONP-PEI at an N/P ratio of 20 were investigated under a fluorescence microscope.图5 靶向的scFv-IONP-PEI和非靶向的IONP-PEI转染细胞后荧光显微镜下观察转染情况
5 细胞免疫荧光及普鲁士蓝染色
scFv-IONP-PEI/siNC-Cy3转染细胞后,胞浆内出现红色荧光;多聚甲醛固定,FITC标记小鼠抗6×His-tag单克隆抗体孵育,由于scFvCD44v6带有His-tag标签蛋白,所以出现绿色荧光,证实 scFvCD44v6与IONP-PEI偶联成功;普鲁士蓝染色胞浆内出现蓝色颗粒;以上结果均表明 scFv-IONP-PEI/siNC-Cy3成功地进入到肿瘤细胞内,见图6。

Figure 6.Fluorescence and Prussian blue staining images of Panc-1 cells transfected with siNC-Cy3 by scFvCD44v6-IONP-PEI at an N/P ratio of 20 were investigated under a fluorescence microscope.IONP in the cells were detected as blue-stained cells.Nucleus in the cells was measured using the DNA-binding dye Hoechst 33342.Red fluorescence indicated the siNC-Cy3.Green fluorescence from the fluorescein isothiocyanate(FITC)-conjugated mouse monoclonal antibody appeared in the scFvCD44v6-IONP-PEI group,indicating that scFvCD44v6had successfully attached to IONP-PEI.图6 scFvCD44v6-IONP-PEI/siNC-Cy3复合物转染Panc-1细胞后的细胞免疫荧光及普鲁士蓝染色实验
6 Real-time PCR和Western blotting检测KRAS mRNA和蛋白的表达水平
靶向组的KRAS mRNA的相对表达量为对照组的(34.02±6.15)%,低于非靶向组的相对表达量(51.09 ±6.70)%,有统计学意义(P <0.05)。Western blotting表明,两者的蛋白表达量均低于对照组的表达量,见图7,说明scFv-IONP-PEI可以有效地输送和释放siRNA,从而发挥干扰效果。
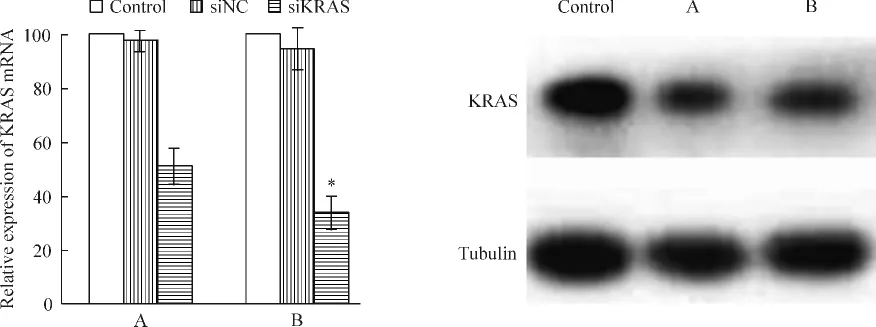
Figure 7.The result of RT-PCR analysis and Western blotting after transfection with IONP-PEI/siKRAS and scFv-IONP-PEI/siKRAS.A:IONP-PEI/siKRAS;B:scFv-IONP-PEI/siKRAS;control:no treatment group.Mean±SD.n=3.*P <0.05 vs A.图7 不同组别转染Panc-1细胞后的real-time PCR和Western blotting结果分析
讨 论
胰腺癌是严重危及人类健康的重大疾病,其发病隐匿、预后差[7];大部分患者在确诊时处于晚期,目前主要治疗方法有手术和化疗,这些方法对患者产生一定的打击和损害,且疗效不能令人满意。随着对肿瘤发生机制的研究,以抑制癌基因表达为重要内容之一的基因治疗成为人们关注热点,被认为是新世纪人类攻克恶性肿瘤的希望所在[8]。基因治疗的目标是将外源基因靶向性输送到肿瘤组织,其能够成功进行依赖于合适的基因载体。纳米载体是近年倍受关注的新型基因载体,与脂质体及其它非病毒载体相比,其性质比较稳定,结构灵活,易调整分子量,可以通过引入侧链和特异靶向性基团来修饰多聚物骨架,进而调整和改善载体的性能,其体积比脂质体小,易于通过血管内皮间隙。其中PEI正电荷密度高,转染能力较强[9],故在多种细胞中被广泛应用;但同时其表面电荷太大,易引起细胞膜破裂而导致细胞毒性很大,因此其临床应用受到很大限制。IONP是一种水溶性的、表面有羧基的氧化铁纳米粒子;具有很好的生物相容性和可降解性,在体内可作为靶向的磁共振显像试剂,并且能够通过化学键与一些抗肿瘤药物连接,把化疗药物带到细胞内,从而达到向肿瘤细胞输送药物的功能;还可以用作细胞分离、热疗以及磁传感器等[10-13]。
本实验中,利用IONP表面的负电荷部分中和PEI表面的正电荷,即减小PEI对细胞的毒性;也能够为后续连接化疗药物的实验提供纳米载体。目前研究的基因载体具有很高转染效率的同时,却缺乏了将siRNA靶向运送到肿瘤细胞的功能。人源性单链片段抗体可以与纳米微粒体或多肽重组成融合蛋白,便于携带基因物质,可考虑用作RNAi药物选择性投递的向导[14],并且其与输送载体结合,可构建出高效、低毒和向肿瘤细胞靶向输送基因的载体[15]。本课题组在前期研究中已经合成并验证了针对肿瘤细胞表面表达的CD44v6黏附分子的单链抗体——scFvCD44v6。CD44v6在胰腺癌中的表达明显高于周围正常的胰腺组织和慢性胰腺炎组织,scFvCD44v6能够特异性地识别CD44v6表达阳性的肿瘤细胞[4]。本实验中,将scFvCD44v6与PEI复合,形成具有肿瘤细胞靶向的载 体——scFv-IONP-PEI。实 验结 果 表明,scFvCD44v6不仅能成功地与IONP-PEI偶联,而且能将更多的siRNA带到细胞中。荧光显微镜观察,scFv靶向组显示比非靶向组更强的红光,流式转染率结果进一步验证了这点,靶向组的转染率达到了(89.75±1.81)%,明显地高于非靶向组。为了进一步验证scFvCD44v6的靶向作用,用FITC标记的小鼠抗6×His tag单克隆抗体做细胞免疫荧光,在细胞膜上出现能够特异识别CD44v6的绿色荧光,从而说明scFvCD44v6不仅能够成功地与IONP-PEI复合,而且能将siRNA靶向地输送到肿瘤细胞。IONP是一种含铁的纳米材料,在普鲁士蓝染色反应中呈现蓝色,结果显示细胞浆内出现蓝色颗粒,进一步说明复合物在细胞内。采用RT-PCR和Western blotting来验证转染效果,本实验中选择的靶基因是KRAS,Panc-1细胞是KRAS突变的细胞。结果表明,非靶向组和靶向组的KRAS mRNA和蛋白表达水平均低于对照组,并且靶向组的干扰效果明显高于非靶向组;证明scFv-IONP-PEI能够将siRNA靶向输送到肿瘤细胞,且起到更明显的干扰作用。
相关研究表明,scFv-IONP-PEI不仅能够向细胞输送基因,还能够通过IONP的化学基团与化疗药物连接,达到同时向细胞输送药物和基因的两种功能,并且IONP含有铁原子,能够作为磁共振增强的显像试 剂[3]。因 此,scFvCD44v6靶 向 的 IONP-PEI,即scFvCD44v6-IONP-PEI,在载药纳米微粒治疗肿瘤的研究中具有很好的应用前景,是一种安全、高效的输送siRNA的载体。
[1] Li D,Xie K,Wolff R,et al.Pancreatic cancer[J].Lancet,2004,363(9414):1049-1057.
[2] Zhu J,Tang A,Law LP,et al.Amphiphilic core-shell nanoparticles with poly(ethylenimine)shells as potential gene delivery carriers[J].Bioconjug Chem,2005,16(1):139-146.
[3] Lee GY,Qian WP,Wang L,et al.Theranostic nanoparticles with controlled release of gemcitabine for targeted and MRI of pancreatic cancer[J].ACS Nano,2013,7(3):2078-2089.
[4] Qian C,Wang Y,Chen Y,et al.Suppression of pancreatic tumor growth by targeted arsenic delivery with anti-CD44v6 single chain antibody conjugated nanoparticles[J].Biomaterials,2013,34(26):6175-6184.
[5] 黄开红,王凌云,赵晓龙,等.抗VEGF单克隆抗体偶联5-FU纳米微粒的初步研究[J].中国病理生理杂志,2007,23(2):256-261.
[6] 黄开红,刘建化,王凌云,等.载5-FU免疫纳米微粒的体外释药及其抗癌效应研究[J].中国肿瘤临床,2007,34(11):601-603.
[7] Vincent A,Herman J,Schulick R,et al.Pancreatic cancer[J].Lancet,2011,378(9791):607-620.
[8] Riley LB,Desai DC.The molecular basis of cancer and the development of targeted therapy[J].Surg Clin North Am,2009,89(1):1-15.
[9] Kim OK,Je J,Baldwin JW,et al.Solubilization of single-wall carbon nanotubes by supramolecular encapsulation of helical amylose[J].J Am Chem Soc,2003,125(15):4426-4427.
[10] Pouliquen D,Le Jeune JJ,Perdrisot R,et al.Iron oxide nanoparticles for use as an MRI contrast agent:pharmacokinetics and metabolism[J].Magn Reson Imaging,1991,9(3):275-283.
[11]Lee JH,Huh YM,Jun YW,et al.Artificially engineered magnetic nanoparticles for ultra-sensitive molecular imaging[J].Nat Med,2007,13(1):95–99.
[12] Moore A,Medarova Z,Potthast A,et al.In vivo targeting of underglycosylated MUC-1 tumor antigen using a multimodal imaging probe[J].Cancer Res,2004,64(5):1821-1827.
[13] Nasongkla N,Bey E,Ren J,et al.Multifunctional polymeric micelles as cancer-targeted,MRI-ultrasensitive drug delivery systems[J].Nano Lett,2006,6(11):2427-2430.
[14] Li SD,Chen YC,Hackett MJ,et al.Tumor-targeted delivery of siRNA by self-assembled nanoparticles[J].Mol Ther,2008,16(1):163-169.
[15]陈茵婷.载siRNA免疫纳米微粒构建及靶向作用胃癌的研究[D].广州:中山大学,2012.

