转录因子ZFP580在缺氧预处理抗大鼠心肌细胞缺氧/复氧损伤中的作用*
孟祥艳, 于海龙, 买 霞, 张文成, 徐瑞成
缺氧预处理(hypoxic preconditioning,HPC)是指机体在经受轻度或中度的缺氧刺激后,对后续的严重刺激产生耐受性的一种生物学效应[1]。预处理作为机体内源性保护机制之一,不仅可对抗在体器官的缺血/再灌注(ischemia reperfusion,I/R)损伤,也可对抗离体细胞的缺氧/复氧(hypoxia reoxygenation,H/R)损伤[2]。然而,HPC的心肌保护机理尚未完全阐明,HPC保护作用及其机制的研究对于临床更好地预防和治疗缺血/缺氧性心脏病具有重要意义。
ZFP580是本组克隆的一种新的C2H2型锌指核转录因子,ZFP580广泛存在于各种大鼠细胞内,并在心肌细胞和内皮细胞的表达量最高[3]。前期实验研究证明ZFP580可能参与维持细胞的正常功能,对细胞的存活和增殖等生理活动具有明显意义[4-5]。在大鼠心肌I/R损伤研究中,L-精氨酸预处理可明显上调大鼠心肌组织中ZFP580的表达并发挥细胞保护作用[6]。据此,本实验旨在通过观察HPC对心肌细胞H/R损伤的保护作用及锌指核转录因子ZFP580表达的改变,探讨ZFP580的作用及相关的信号调控,为进一步揭示HPC的心肌保护机制及ZFP580的功能奠定实验基础。
材料和方法
1 材料
大鼠H9c2心肌细胞株由中国科学院上海细胞研究所提供;胎牛血清(Gibco);高糖 DMEM(Hy-Clone);ZFP580Ⅰ抗(Abcam);β-actinⅠ抗(Sigma);CK-MB含量ELISA检测试剂盒(R&D);LDH活力生化检测试剂盒(南京建成);Annexin V-PE/7-AAD染色试剂(Invitrogen);其余试剂为国产分析纯。模拟缺血的缺氧培养基配方(mmol/L,pH 6.2):1.0 KH2PO4,10.0 NaHCO3,1.2 MgCl2·6H2O,25.0 HEPES,74.0 NaCl,16.0 KCl,1.2 CaCl2,20.0 Na lactate。
2 方法
2.1 H9c2大鼠心肌细胞的培养 H9c2心肌细胞于含有10%胎牛血清的高糖DMEM、37℃恒温培养箱(5%CO2)中培养,隔天换液,3 d传代1次,各组细胞在实验前8~12 h利用无血清DMEM饥饿使细胞同步化。
2.2 缺氧/复氧损伤模型的建立及实验分组 实验分为:(1)缺氧/复氧(H/R)组:H9c2心肌细胞换用缺氧培养基(预先用氮气饱和30 min)后,置入缺氧装置后密闭。然后从进气口充入混合气(95%N2+5%CO2),持续通气3 h后,将细胞换用无血清高糖DMEM培养基置于37℃恒温培养箱中继续培养2 h,实现复氧;(2)缺氧预处理(HPC)组:将心肌细胞用D-Hanks液洗1次后加入无血清高糖DMEM培养基,将培养板置于95%N2+5%CO2平衡的低氧密闭容器中,37℃低氧10 min,将培养板转移至CO2培养箱(含湿润的95%air+5%CO2)复氧20 min,重复该步骤3次后进行H/R实验;(3)对照(control)组:细胞换用无血清高糖DMEM培养基于37℃恒温培养箱中持续培养5 h。
2.3 MTT染色及LDH水平测定 接种于96孔板的H9c2心肌细胞分别进行各实验组处理后,每孔加入 10 μL MTT 溶液(5 g/L),继续培养 4 h,终止培养,每孔加入100 μL DMSO后低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度值(A)。细胞存活率(%)=实验组A/正常对照组A×100%。LDH的测定:收集各组细胞培养基后离心取上清,按照LDH活性生化检测试剂盒说明进行检测。
2.4 阻断ERK的研究 H9c2心肌细胞在无血清培养基中饥饿12 h后,在培养基中加入ERK阻滞剂PD98059(预先溶解于 DMSO中),终浓度为 10 μmol/L。同时设DMSO对照组,即在培养基中加入等量DMSO。2组细胞在PD98059或等量DMSO预处理1 h后,均进行H/R实验,经Western blotting观察ZFP580的表达情况。
2.5 慢病毒介导的ZFP580基因转染实验 按照刘彬等[7]的方法,分别重组表达 ZFP580全长基因(Lenti-ZFP580)或针对ZFP580的siRNA(Lenti-siRNA)的慢病毒载体,并设空载体(Lenti-NC)的阴性对照,其中,载体构建、慢病毒包装及滴度检测均由吉玛公司(上海)完成。按照感染复数(MOI值)200将稀释好的病毒液加入细胞培养基中感染H9c2心肌细胞,即每1×105细胞约加入病毒液(滴度为1012TU/L)20 μL,并添加 polybrene(5 mg/L)提高感染效率。慢病毒介导的基因转染实验在H9c2心肌细胞H/R实验前72 h进行。
2.6 Annexin V-PE/7-AAD染色及流式细胞术检测H9c2细胞凋亡 采用流式细胞术以Annexin V-PE/7-AAD染色法检测H9c2心肌细胞凋亡情况。各组细胞用胰蛋白酶消化后,调整浓度至1×106cells/L,经预冷的PBS洗涤后分别用PE标记的Annexin V和7-AAD进行染色,随后采用流式细胞术进行凋亡细胞的计数及分析。细胞早期凋亡时,细胞膜中的磷脂酰丝氨酸由脂膜内侧翻向外侧并与Annexin V结合;细胞晚期凋亡时,细胞膜已不完整,7-AAD能够透过细胞膜进入细胞而使细胞核染红。据此原理,Annexin V与7-AAD染色可以将处于不同凋亡时期的细胞区分开来,并经流式细胞术分选计数。
2.7 Western blotting 检测 ZFP580、ERK1/2 和caspase-3的表达 提取各实验组H9c2心肌细胞总蛋白,用BCA法测定蛋白质浓度,将样品与SDS凝胶加样缓冲液混合,煮沸10 min使蛋白变性。取60 μg总蛋白上样,经聚丙烯酰胺凝胶电泳,转膜,封闭后,加入Ⅰ抗(1∶1 000稀释),4℃孵育过夜,漂洗后加入辣根过氧化物酶标记的Ⅱ抗(1∶2 000稀释),室温摇床上孵育2 h,充分漂洗后按ECL发光试剂盒说明书操作,曝光后X光片用凝胶图像分析软件扫描,测定蛋白条带的灰度值。ZFP580、caspase-3表达结果用实测灰度值与内参照 β-actin的比值表示,ERK1/2磷酸化程度用p-ERK1/2与总ERK1/2的比值表示。
3 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 11.0软件处理。样本均数的比较采用t检验和方差分析,以P<0.05为差异有统计学意义。
结 果
1H PC对H/R处理后MTT染色和LDH活性的影响
H9c2心肌细胞经H/R处理后,细胞存活率降低,漏出至培养基的LDH活性增加(均P<0.05),HPC能显著升高细胞存活率和降低培养基中LDH活性,与H/R组比较差异均有统计学意义(P<0.05),见图 1。

Figure 1.Effects of HPC on viability(MTT assay;A)and LDH leakage(B)of the H9c2 cells subjected to H/R injury.Mean±SD.n=6.*P <0.05 vs control(no treatment);#P <0.05 vs H/R.图1 HPC对H/R处理后细胞存活率和LDH活性的影响
2 HPC对H/R处理后心肌细胞中ZFP580及ERK1/2表达的影响
经H/R处理后,H9c2心肌细胞中ZFP580表达及ERK1/2磷酸化程度明显上调(均P<0.05),而HPC组心肌细胞中ZFP580表达及ERK1/2磷酸化程度较H/R处理后上升更加明显,与H/R组比较差异有统计学意义(均P<0.05),见图2。

Figure 2.Effects of HPC on ZFP580 expression(A)and ERK1/2 phosphorylation(B)in the H9c2 cells.Mean ± SD.n=6.*P <0.05 vs control(no treatment);#P<0.05 vs H/R.图2 HPC对H/R处理后心肌细胞中ZFP580表达及ERK1/2磷酸化的影响
3 PD98059对HPC处理后ZFP580表达的影响
H9c2心肌细胞经PD98059预处理1 h后进行HPC及 H/R实验,Western blotting结果显示PD98059预处理明显抑制HPC诱导的ZFP580的表达上调,而DMSO对照组细胞ZFP580在HPC及H/R后表达未受影响,见图3。
4 慢病毒介导ZFP580基因转染对H/R处理后caspase-3表达的影响
经Western blotting方法验证,慢病毒介导的基因转染能明显改变H9c2心肌细胞中ZFP580的表达水平,见图4A。转染Lenti-ZFP580使ZFP580高表达的H9c2心肌细胞在H/R损伤后,心肌细胞中活化caspase-3表达下降,明显低于转染Lenti-NC的阴性对照组。转染Lenti-siRNA使ZFP580低表达或不表达的H9c2心肌细胞在H/R损伤后,心肌细胞中活化caspase-3表达上升,明显高于ZFP580高表达组及阴性对照组,见图4B。

Figure 3.Effects of PD98059 on HPC-induced ZFP580 expression.Mean ± SD.n=6.*P < 0.05 vs DMSO alone;#P <0.05 vs HPC+H/R+DMSO.图3 PD98059对HPC处理后ZFP580表达的影响
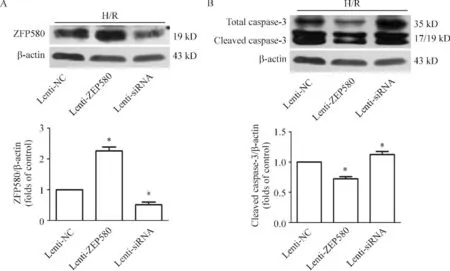
Figure 4.Lentivirus-mediated transfection of ZFP580(A)affected H/R-induced caspase-3 activation(B)in H9c2 cells.Mean±SD.n=6.*P <0.05 vs Lenti-NC group.图4 慢病毒介导的ZFP580基因转染对H/R处理后caspase-3表达的影响
5 Annexin V-PE/7-AAD染色及流式细胞术检测结果
转染不同慢病毒载体的H9c2心肌细胞经H/R处理后,流式细胞仪均可检测到凋亡细胞。转染Lenti-ZFP580后高表达ZFP580的H9c2心肌细胞在H/R损伤后细胞凋亡率明显低于转染Lenti-NC的阴性对照组,转染 Lenti-siRNA后低表达或不表达ZFP580的H9c2心肌细胞在H/R损伤后细胞凋亡率升高,明显高于ZFP580高表达组及阴性对照组,见图5。
讨 论

Figure 5.The results of Annexin V-PE/7-AAD staining and flow cytometry quantification.Mean ± SD.n=6.*P <0.05 vs Lenti-NC group.图5 Annexin V-PE/7-AAD染色及流式细胞术检测结果
缺氧预处理能增强机体对缺血、缺氧、缺血/再灌注等损伤的耐受性,然而其发挥保护作用的机制尚未完全阐明。有研究认为HPC的保护机制与其引起的大量内源性保护物质的释放有关,如腺苷、氧自由基清除酶、缓激肽及多种保护蛋白均被证实参与了HPC的保护作用[8-9]。然而,从细胞感受细胞外的缺氧信号,并将信号传至胞内,最终引起内源性保护物质的释放,其中必然存在复杂的信号转导机制。近年研究发现丝裂原活化蛋白激酶(mitogen-activated protein kinase 1/2,MAPK)家族是联系细胞膜表面信号与决定性基因表达之间的重要信号调节酶之一,对缺血、缺氧等刺激均可作出不同的反应,控制着细胞的适应、增殖、分化、存活和死亡等过程[10]。细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)是MAPK家族成员之一。离体心肌I/R模型缺血15 min后再灌注5 min,心肌细胞中ERK活性增加,另有研究表明短时缺氧后的复氧也可使心肌细胞中的ERK激活[11-12]。同时大量研究证实,作为联系细胞浆与细胞核之间信号转导的信使,ERK参与的信号转导途径在心肌I/R损伤中发挥了心肌细胞保护作用[13]。
本研究发现,经HPC的心肌细胞在H/R后的细胞损伤减轻,细胞存活率升高,验证了文献报道的HPC的细胞保护作用。同时,我们还发现心肌细胞在H/R后ZFP580表达增加而HPC可引起ZFP580表达的进一步上调,并且心肌细胞中ZFP580表达上调和ERK1/2磷酸化的水平升高趋势相一致。由此,我们设想,H/R诱导的ZFP580表达上调是否如ERK的激活一样参与了心肌细胞自身的抗损伤反应?另外,作为核转录因子,H/R诱导的ZFP580表达上调是否受到ERK1/2通路的调控?通过应用ERK1/2磷酸化的特异性抑制剂 PD98059发现,PD98059预处理能明显抑制HPC后心肌细胞中ZFP580的表达上调。可见,HPC引起的ZFP580表达上调和ERK1/2磷酸化有关,ZFP580作为ERK1/2途径调控的下游靶点在HPC保护心肌细胞的过程中发挥作用。
细胞凋亡是指触发细胞内死亡程序而发生的细胞死亡过程。研究认为,心肌缺血主要导致心肌细胞的坏死,而再灌注则加速细胞的凋亡,细胞凋亡是再灌注后引起心肌细胞死亡的主要形式[14]。据此,抗凋亡作用或特异性影响凋亡相关信号通路成为I/R损伤后保护心肌的有效措施之一。Li等[15]在心肌I/R模型中发现,激活ERK后再灌注引起的心肌细胞凋亡减少,阻断ERK通路可增加心肌细胞的凋亡。尽管ERK1/2抑制细胞凋亡的分子机制尚未完全阐明,然而现有研究表明,ERK1/2被激活后通过诱导下游靶分子的活化来发挥心脏保护作用。其中转录因子Egr-1(early growth response gene-1)、内皮型一氧化氮合酶等下游靶分子均被证实参与了ERK1/2通路的抗凋亡作用[16]。为了证实转录因子ZFP580在细胞凋亡中发挥的作用,我们利用慢病毒介导的基因转染技术获得了高/低表达ZFP580的H9c2细胞,并进行H/R损伤实验。实验结果发现,ZFP580高表达明显抑制H/R损伤导致的心肌细胞凋亡和心肌细胞中caspase-3的活化,可见ZFP580通过抑制caspase-3的活化实现了抗心肌细胞凋亡的作用。
总之,本实验通过建立HPC及H/R损伤的细胞模型,证实转录因子ZFP580作为ERK1/2信号通路的下游靶分子之一,具有抗细胞凋亡的作用。据此,我们推断HPC诱导的ZFP580表达上调作为内源性保护机制之一介导了HPC的细胞保护作用,然而ZFP580调控的下游靶基因及其参与细胞保护作用的具体机制仍待进一步研究。
[1] Lawson CS,Downey JM.Preconditioning:state of the art myocardial protection[J].Cardiovascular Res,1993,27(4):542-550.
[2] Webester KW,Discher DJ,Bishopric NH.Cardioprotection in an in vitro model of hypoxic preconditioning[J].J Mol Cell Cardoal,1995,27(1):453-458.
[3] 张文成,陈保生,曾武威,等.低密度脂蛋白降调节新基因cDNA的克隆及结构分析[J].中华医学杂志,2001,81(7):435-436.
[4] Sun HY,Wei SP,Xu RC,et al.Sphingosine-1-phosphate induces human endothelial VEGF and MMP-2 production via transcription factor ZNF580:Novel insights into angiogenesis[J].Biochem Biophy Res Com,2010,395(3):361-366.
[5] Luo YY,Hu WL,Xu RC,et al.ZNF580,a novel C2H2 zinc-finger transcription factor,interacts with the TGF-beta signal molecule Smad2[J].Cell Biol Int,2011,35(11):1153-1157.
[6] 孟祥艳,宋立新,罗玉玉,等.大鼠心肌缺血-再灌注损伤中转录因子ZFP580表达的变化[J].中国病理生理杂志,2011,27(6):1127-1131.
[7] 刘 彬,黄佳城,周迎春,等.慢病毒介导LOX-1基因RNA干扰抑制氧化应激诱导心肌细胞凋亡[J].南方医科大学学报,2012,32(2):165-172.
[8] Neckar J,Ostadal B,Kolar F.Myocardial infarct sizelimiting effect of chronic hypoxia persists for five weeks of normoxic recovery[J].Physiol Res,2004,53(6):621-628.
[9] Yellon DM,Downey JM.Preconditioning the myocardium:from cellular physiology to clinical cardiology[J].Physiol Rev,2003,83(4):1113-1151.
[10]Vassalli G,Milano G,Moccetti T.Role of mitogen-activated protein kinases in myocardial ischemia-reperfusion injury during heart transplantation[J].J Transplant,2012,2012:928954.
[11]武 蓓,陈 红,任景怡,等.心肌缺血/再灌注损伤中细胞凋亡的信号转导通路[J].临床医学,2007,9(5):364-367.
[12] Ballard Croft C,Locklar AC,Kristo G,et al.Regional myocardial ischemia-induced activation of MAPKs is associated with subcellular redistribution of caveolin and cholestero1[J].Am J Physiol Heart Circ Physiol,2006,291(2):H658-H667.
[13] Das A,Salloum FN,Xi L,et al.ERK phosphorylation mediates sildenafil-induced myocardial protection against ischemia-reperfusion injury in mice[J].Am J Physiol Heart Circ Physiol,2009,296(13):H1236-H1243.
[14] Eefting F,Rensing B,Wigman J,et al.Role of apoptosis in reperfusion injury[J].Cardiovasc Res,2004,61(3):414-426.
[15] Li DY,Tao L,Liu H,et al.Role of ERK1/2 in the antiapoptotic and cardioprotective effects of nitric oxide after myocardial ischemia and reperfusion[J]. Apoptosis,2006,11(6):923-930.
[16] Hausenloy DJ,Yellon DM.New directions for protecting the heart against ischaemia-reperfusion injury:targeting the reperfusion injury salvage kinase(RISK)-pathway[J].Cardiovasc Res,2004,61(3):448-460.

