c-Myc抑制剂10058-F4对伊马替尼耐药细胞的增殖抑制作用*
龙梓洁, 方志刚, 潘晓娜, 范蕊芳, 林东军
慢性粒细胞白血病(chronic myeloid leukemia, CML)是一种血液系统恶性肿瘤,其产生的大量白细胞在骨髓内聚集,抑制骨髓的正常造血。目前,酪氨酸激酶小分子抑制剂伊马替尼(imatinib)已经成为治疗CML的一线用药,使得CML患者的5年生存率明显提高,但是仍有部分患者对伊马替尼缺乏敏感性,产生耐药或复发[1]。因此,寻找新的有效治疗方法克服CML对伊马替尼的耐药性成为当前迫切需要解决的问题。
myc基因编码的蛋白在肿瘤发生发展中起重要作用。人类 c-myc基因定位于 8q24,c-Myc蛋白与Max蛋白形成异二聚体,异二聚体与靶基因的E-box DNA(5’-CACGTG-3’)区域结合,发挥转录功能,调节下游基因[2]。c-Myc蛋白参与细胞的生长、增殖、凋亡、分化、肿瘤形成及肿瘤耐药等各个过程,并参与了多种信号通路的调控,包括 Wnt/β-catenin、phosphatidylinositol 3-kinase/Akt(PI3K/Akt)和Ras GTPase/MAP kinase(Ras/MAPK)等。在乳腺癌、前列腺癌、胃肠道肿瘤和黑色素瘤等多种实体瘤以及血液肿瘤中均发现c-Myc的异常表达,且与肿瘤的分期和预后相关[3]。研究报道c-Myc在白血病的发病及疾病进程中起关键作用[4]。鉴于c-Myc作为肿瘤治疗靶点的潜在性,各研究机构纷纷致力于c-Myc小分子抑制剂的研发。其中,10058-F4在多种肿瘤如肝癌以及白血病研究中均显现出良好的抗肿瘤效果[5-6]。本文旨在探讨c-Myc小分子抑制剂10058-F4对K562及伊马替尼耐药的K562/G细胞的抑制作用,从而为临床上治疗CML提供新的治疗策略。
材料和方法
1 主要试剂
胎牛血清及RPMI-1640培养基购自Gibco,c-Myc小分子抑制剂10058-F4、c-Myc抗体及GAPDH抗体为Santa Cruz产品,甲磺酸伊马替尼为Selleckchem产品,甲基纤维素为R&D产品,其它生化试剂均为进口分装或国产分析纯。
2 主要方法
2.1 细胞培养 K562细胞(购自American Type Culture Collection)及伊马替尼耐药的K562/G细胞(由K562细胞通过逐渐增加伊马替尼浓度培养筛选得到)用含10% 胎牛血清的RPMI-1640培养基于37℃、5%CO2及饱和湿度条件下培养,取对数生长期细胞进行实验并根据实验需要分组。
2.2 Western blotting检测蛋白的表达水平 用细胞裂解液[20 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,0.25%NP40,2.5 mmol/L sodium pyprophosphate,1 mmol/L EGTA,1 mmol/L EDTA,1 mmol/L βglycerophosphate,1 mmol/L Na3VO4,1 mmol/L PMSF,1 mg/L leupeptin]提取K562及K562/G细胞总蛋白。用考马斯亮蓝法进行蛋白定量后,等量蛋白上样,10%SDS-PAGE进行蛋白分离,将蛋白转移至硝酸纤维素膜,I抗孵育,4℃过夜,HRP标记的II抗孵育1 h,于暗室中曝光。以glyceraldehyde-3-phosphate dehydrogenase(GAPDH)作为内参照。
2.3 MTT法检测细胞增殖情况 K562及K562/G细胞培养于96孔板,分别进行不同的处理,检测前每孔加入20 μL MTT溶液,继续孵育4 h,离心弃上清液后,每孔加入150 μL DMSO溶解沉淀,于490 nm波长的酶标仪测定吸光度。
2.4 流式细胞术检测细胞周期 收集细胞后,1 500 r/min离心5 min,PBS洗涤2次,后用70% 冰乙醇固定过夜,碘化丙啶 (propidium iodide,PI)染色后流式细胞仪测定细胞周期。
2.5 甲基纤维素克隆形成实验 对照组及药物处理组细胞(K562及K562/G)分别培养于甲基纤维素中,37℃、5%CO2及饱和湿度条件下培养6 d后显微镜下观察克隆。
2.6 Annexin V-PI染色检测细胞凋亡 K562及K562/G细胞分别进行不同的处理,检测前每孔用500 μL binding buffer 重悬,加入 5 μL Annexin VFITC及5 μL PI,避光孵育15 min后流式细胞仪检测细胞凋亡情况。
3 统计学处理
数据用SPSS 16.0统计软件分析,数据均采用均数±标准差(mean±SD)表示,组间比较分析用t检验或方差分析,以P<0.05为差异有统计学意义。
结 果
1 伊马替尼对K562及K562/G细胞的作用
将K562及K562/G细胞培养于96孔板,分别用不同剂量(0、0.1、0.5、1、5、10 μmol/L)的伊马替尼进行处理,48 h后MTT法检测细胞的增殖情况。与对照组相比,伊马替尼可剂量依赖性地抑制K562及K562/G细胞的增殖。K562细胞对伊马替尼较敏感,而K562/G在同样剂量的伊马替尼处理下出现耐药。1 μmol/L的伊马替尼作用下,K562细胞的存活率是53.9% ±2.0%,K562/G的存活率为77.4% ±5.9%(P<0.01),见图1A。Western blotting实验结果显示,K562/G细胞比K562细胞表达更高的c-Myc蛋白,见图1B。
2 c-Myc抑制剂10058-F4对K562及K562/G细胞增殖及周期的影响
由于c-Myc在K562/G细胞中具有较高的表达,为了验证c-Myc靶向抑制剂10058-F4对耐药细胞的作用,10058-F4 以不同浓度(0、25、50、100 μmol/L)及不同时间(0、24、48、72 h)作用于K562及K562/G细胞,MTT法分析10058-F4对白血病细胞的增殖抑制作用。结果显示:与对照组相比,10058-F4对K562及K562/G细胞均有抑制作用,且呈剂量和时间依赖性,并且对耐药的K562/G细胞较K562细胞抑制作用更强,耐药细胞对10058-F4更敏感,见图2。50 μmol/L的10058-F4作用48 h,K562及K562/G细胞的存活率分别为73.3%±3.2%及63.7%±3.0%;100 μmol/L 的 10058-F4 作用 48 h,K562 及K562/G细胞的存活率分别为61.7%±3.6%及42.0%±3.2%,与对照组相比均具有显著差异(P<0.01)。流式细胞术检测K562及K562/G细胞周期结果显示,10058-F4能阻滞细胞于G0/G1期(图3),因此10058-F4对细胞增殖的抑制作用可能与细胞周期的阻滞相关。
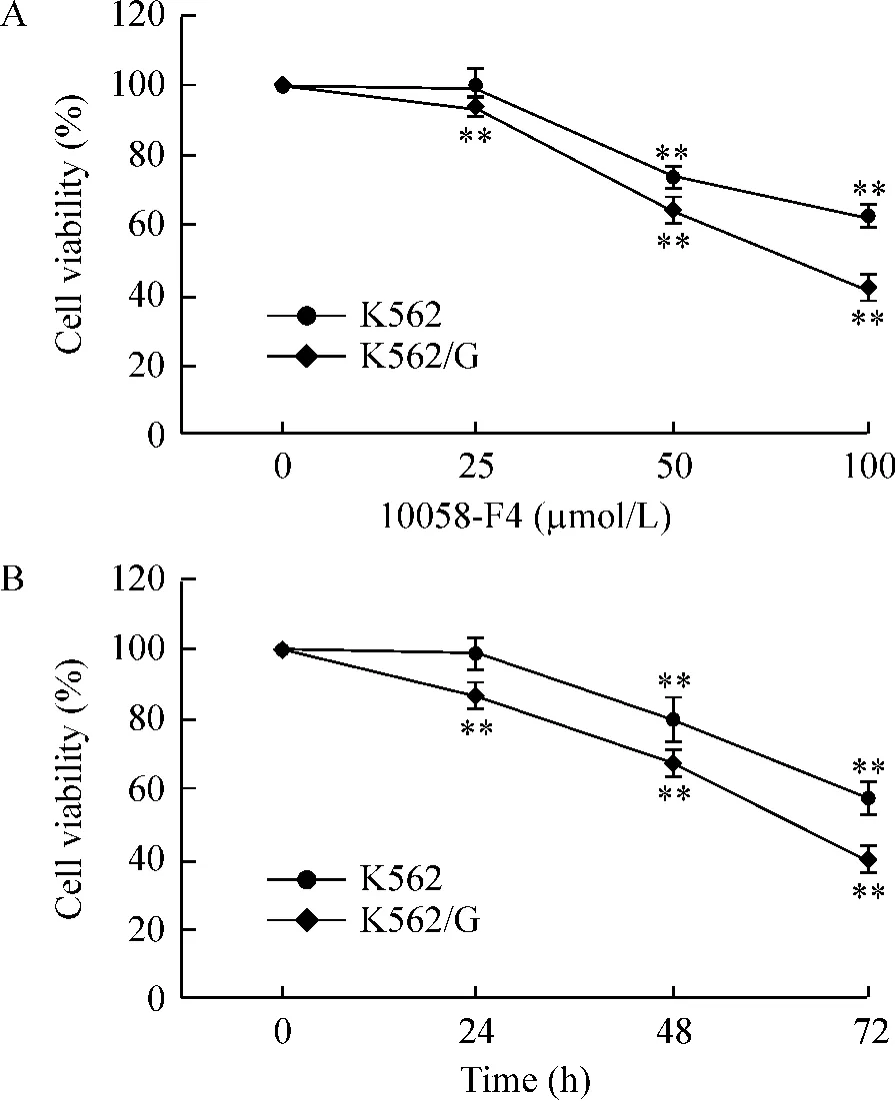
Figure 2.10058-F4 inhibited proliferation of K562 and K562/G cells.A:K562 and K562/G cells were treated with various concentrations of 10058-F4 for 48 h and then subjected to MTT assay;B:K562 and K562/G cells were treated with 50 μmol/L 10058-F4 for indicated time and then subjected to MTT assay.Mean±SD.n=3. **P <0.01 vs 0 μmol/L or 0 h.图2 10058-F4抑制K562及K562/G细胞的增殖
3 c-Myc抑制剂10058-F4促进K562及K562/G细胞凋亡
100 μmol/L的10058-F4处理 K562及 K562/G细胞48 h后,Annexin V-PI染色并采用流式细胞仪检测细胞凋亡情况,结果表明10058-F4可促使K562及K562/G细胞发生凋亡,见图4。
4 c-Myc抑制剂10058-F4对K562及K562/G细胞克隆形成能力的影响
克隆形成实验结果显示,相对于K562细胞,K562/G细胞表现出更强的克隆形成能力(P<0.01),见图5。伊马替尼对于K562细胞的抑制作用明显大于K562/G细胞(P<0.01),进一步表明K562/G细胞对伊马替尼的耐药性。10058-F4可抑制K562及 K562/G细胞的克隆形成能力,且对K562/G细胞的作用更加显著(P<0.01)。10058-F4与伊马替尼联合作用于细胞6 d后,两药联用组比对照组及单药组作用效果更加明显,提示10058-F4可以逆转K562/G细胞对伊马替尼的耐药性。

Figure 3.10058-F4 induced cell cycle arrest in K562 and K562/G cells.K562 and K562/G cells were treated with 50 μmol/L 10058-F4 for 48 h and then subjected to flow cytometry for cell cycle analysis.Mean±SD.n=3.**P <0.01 vs control.图3 10058-F4导致K562及K562/G细胞周期阻滞
讨 论
作为肿瘤治疗的潜在靶点,c-Myc在人类多种实体肿瘤及血液肿瘤中异常高表达。研究报道,c-Myc的异常表达可促进肿瘤的形成和进展[7];抑制c-Myc的表达可抑制肿瘤细胞生长,促进细胞凋亡、衰老和分化。更重要的是,c-Myc的高表达在白血病发生过程中起关键的作用[8],抑制c-Myc能够阻止白血病的发生[9]。c-Myc通过调节一系列下游基因决定细胞的存活。c-Myc在CML患者的CD34+造血前体细胞中通过调控ATP-binding cassette(ABC)转运蛋白的基因转录从而导致细胞对化疗药物的耐药[10]。另外,c-Myc可调节多种micro RNA,包括增加促进肿瘤发生的microRNA及降低肿瘤抑制作用的micro-RNA的表达。在K562细胞中,c-Myc可通过调控miR-144/451的表达使K562细胞获得对伊马替尼的抗药性[11]。
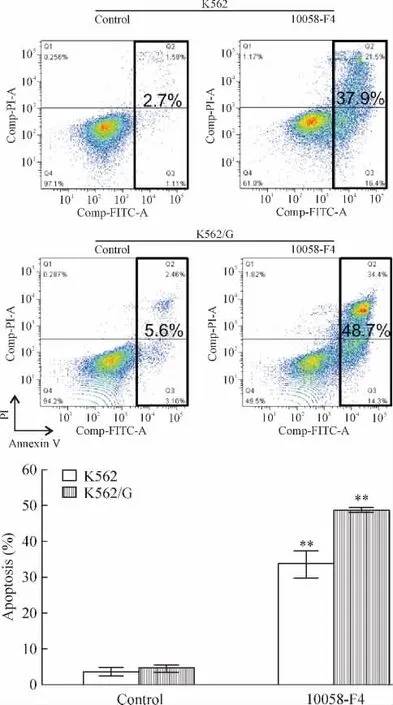
Figure 4.10058-F4 induced apoptosis of K562 and K562/G cells.K562 and K562/G cells were treated with 100 μmol/L 10058-F4 for 48 h and then subjected to flow cytometry for Annexin V-PI analysis.Mean±SD.n=3. **P <0.01 vs control.图4 10058-F4促进K562及K562/G细胞发生凋亡
本研究发现c-Myc表达上调是耐药细胞克隆形成能力增强的细胞遗传学特征之一,c-Myc的高表达可能导致K562/G细胞对于伊马替尼的敏感性降低。c-Myc抑制剂10058-F4可抑制K562及K562/G细胞的增殖,并且对K562/G细胞表现出更强的杀伤作用,可能与其高表达c-Myc相关。细胞周期检测显示10058-F4能阻滞细胞于G0/G1期,因此10058-F4抑制细胞增殖可能与细胞周期阻滞相关,与之前的研究结果一致[6]。同时,10058-F4可促进K562及K562/G细胞发生凋亡。此外,细胞克隆形成实验显示,K562/G细胞对10058-F4具有更高的敏感性。在肝癌[5]、肺癌[12]及黑色素瘤[13]的研究中,抑制 c-Myc的表达可增强细胞对化疗药物的敏感性。我们的研究发现10058-F4可恢复耐药K562/G细胞对于伊马替尼的敏感性,减少细胞的克隆形成数目。因此,高表达c-Myc的K562/G细胞可能通过上调c-Myc的表达增强对伊马替尼的抵抗作用,提高细胞的耐药性。10058-F4作为一个有效的c-Myc的小分子抑制剂,可杀伤白血病细胞,逆转耐药。
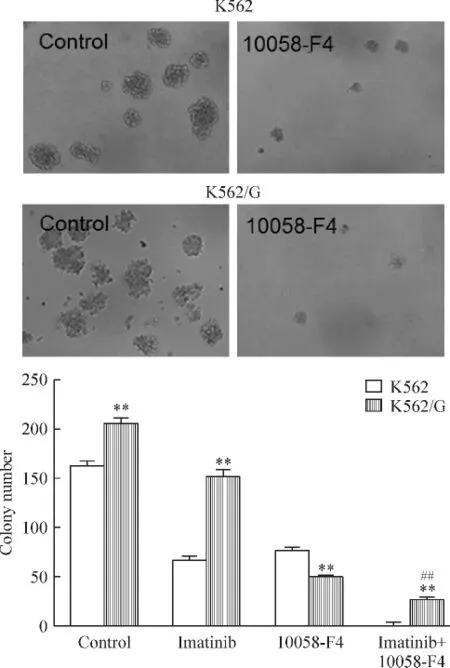
Figure 5.10058-F4 supressed colony formation of K562 and K562/G cells.K562 and K562/G cells were treated with 50 μmol/L 10058-F4 or/and 1 μmol/L imatinib for 6 d and subjected to colony formation analysis(×100).**P<0.01 vs K562;##P<0.01 vs imatinib.图5 10058-F4抑制K562及K562/G细胞的克隆形成能力
本实验初步分析了c-Myc对CML耐药细胞特性的影响。结果表明c-Myc在CML细胞耐药性中起重要作用,c-Myc的小分子抑制剂可有效杀伤K562细胞及伊马替尼耐药的K562/G细胞,预示通过抑制c-Myc的表达可以克服CML治疗过程中的耐药问题,为临床提供新的治疗策略。
[1] Kantarjian HM,Talpaz M,Giles F,et al.New insights into the pathophysiology of chronic myeloid leukemia and imatinib resistance[J].Ann Intern Med,2006,145(12):913-923.
[2] Dang CV,O′Donnell KA,Zeller KI,et al.The c-Myc target gene network[J].Semin Cancer Biol,2006,16(4):253-264.
[3] Nesbit CE,Tersak JM,Prochownik EV.MYC oncogenes and human neoplastic disease[J].Oncogene,1999,18(19):3004-3016.
[4] Hoffman B,Amanullah A,Shafarenko M,et al.The proto-oncogene c-myc in hematopoietic development and leukemogenesis[J].Oncogene,2002,21(21):3414-3421.
[5] Lin CP,Liu JD,Chow JM,et al.Small-molecule c-Myc inhibitor,10058-F4,inhibits proliferation,downregulates human telomerase reverse transcriptase and enhances chemosensitivity in human hepatocellular carcinoma cells[J].Anticancer Drugs,2007,18(2):161-170.
[6] Huang MJ,Cheng YC,Liu CR,et al.A small-molecule c-Myc inhibitor,10058-F4,induces cell-cycle arrest,apoptosis,and myeloid differentiation of human acute myeloid leukemia[J].Exp Hematol,2006,34(11):1480-1489.
[7] 潘晓娜,方志刚,龙梓洁,等.上调c-myc基因的表达对U937白血病细胞的影响[J].中国病理生理杂志,2013,29(11):1984-1989.
[8] Delgado MD,Albajar M,Gomez-Casares MT,et al.MYC oncogene in myeloid neoplasias[J].Clin Transl Oncol,2013,15(2):87-94.
[9] Roderick JE,Tesell J,Shultz LD,et al.c-Myc inhibition prevents leukemia initiation in mice and impairs the growth of relapsed and induction failure pediatric T-ALL cells[J].Blood,2014,123(7):1040-1050.
[10] Porro A,Iraci N,Soverini S,et al.c-MYC oncoprotein dictates transcriptional profiles of ATP-binding cassette transporter genes in chronic myelogenous leukemia CD34+hematopoietic progenitor cells[J].Mol Cancer Res,2011,9(8):1054-1066.
[11] Liu L,Wang S,Chen R,et al.Myc induced miR-144/451 contributes to the acquired imatinib resistance in chronic myelogenous leukemia cell K562[J].Biochem Biophys Res Commun,2012,425(2):368-373.
[12] Knapp DC,Mata JE,Reddy MT,et al.Resistance to chemotherapeutic drugs overcome by c-Myc inhibition in a Lewis lung carcinoma murine model[J].Anticancer Drugs,2003,14(1):39-47.
[13] Citro G,D′Agnano I,Leonetti C,et al.c-myc antisense oligodeoxynucleotides enhance the efficacy of cisplatin in melanoma chemotherapy in vitro and in nude mice[J].Cancer Res,1998,58(2):283-289.

