外源性ATP诱导PC12细胞的膜孔形成*
沈 慧, 尹雅玲, 李超堃, 赵红岗, 马 洁, 李东亮△
长期以来三磷酸腺苷(adenosine triphosphate,ATP)一直被为是细胞能量供应和利用的物质形式,在线粒体产生,进入细胞浆(约5~10 mmol/L)发挥作用[1]。但近年来越来越多的实验表明,胞外高浓度ATP是一种细胞死亡因子[2],文献指出低浓度ATP短暂作用于P2X7受体,仅仅形成允许阳离子透过的通道;而高浓度ATP,反复持久作用于P2X7受体,形成允许各种阳离子和900 D以下的有机物质通过的“膜孔”[3-4]。膜的通透性随着ATP浓度和作用时间的增加发生了质的变化,低于900 D的分子和离子均可通透,导致细胞水肿,空泡形成、凋亡和坏死[5]。
大鼠肾上腺嗜铬细胞瘤PC12细胞起源于神经嵴,在神经生长因子(nerve growth factor,NGF)的诱导下分化成神经元样细胞,是当前广泛用于研究神经细胞功能、分化和凋亡的一种细胞系[6],但胞外高浓度ATP对PC12细胞的影响及其机制却罕有研究报道。本文将探讨高浓度ATP诱导PC12细胞膜孔形成及关键蛋白,为以后神经保护的研究奠定基础。
材料和方法
1 材料
1.1 主要试剂 高糖DMEM培养基和胎牛血清(HyClone);不含酚红Hanks缓冲液(杭州吉诺生物医药技术有限公司);ATP、亮蓝G(brilliant blue G,BBG)和生胃酮(carbenoxolone,CBX)(Sigma);P2X7受体抗体和pannexin 1(Panx1)抗体(Abcam);YOPRO-1 Iodide(Invitrogen);GAPDH、P2X7受体和Panx1引物及PCR试剂盒(Vazyme);蛋白印迹试剂盒(中国碧云天公司);其它试剂均为国产分析纯。
1.2 细胞系 大鼠肾上腺嗜铬细胞瘤PC12细胞(高分化)来自上海中科院典型细胞培养库。
2 方法
2.1 细胞培养与实验分组 PC12细胞置于内含10%胎牛血清的高糖DMEM培养基,37℃、5%CO2培养箱内常规培养,选取对数生长期细胞进行实验。每次每组设3个平行复孔,实验重复3次。
选取生长状态良好及诱导分化均一的细胞悬液接种于96孔板中培养,YO-PRO-1摄取实验的细胞密度约1×109cells/L,CKK-8实验的细胞密度约1×108cells/L。接种24 h后随机分组,每组3个复孔。本实验分组为:0 mmol/L ATP组、1 mmol/L ATP组、3 mmol/L ATP组、5 mmol/L ATP组、BBG组、CBX组、BBG预孵育组和CBX预孵育组。
2.2 形态学观察 把PC12细胞接种于24孔板内按实验分组要求给予不同的处理因素作用一定时间后,倒置相差显微镜下观察各组细胞形态变化。
2.3 CCK-8检测细胞存活率 把PC12细胞接种于96孔板内按实验分组要求给以不同的处理因素,作用一定时间后,CCK-8检测时每孔加入预温37℃的10 μL CCK-8溶液,避光孵育2 h,然后用酶标仪在波长450 nm处检测各孔吸光度(A),计算公式如下:细胞活力(%)=实验组A/对照组A×100%。本实验将对照组细胞存活率定为100%。
2.4 YO-PRO-1摄入实验检测膜孔形成[7]YOPRO-1是一种对正常细胞不渗透的阳离子荧光染料(分子量629 D)。细胞膜孔形成时YO-PRO-1可进入细胞与核酸结合发出绿光。用含ATP和YO-PRO-1的溶液加入各组细胞中,并使ATP终浓度为相应浓度,YO-PRO-1终浓度为2 μmol/L,37 ℃孵育1 h,而后在荧光显微镜下观察或用多功能酶标仪检测(激发波长485 nm,发射波长516 nm)。YO-PRO-1荧光强度(%)=实验组A/对照组A×100%。本实验将对照组细胞摄取的荧光强度定为100%。
2.5 Real-time PCR检测P2X7受体和Panx1 mRNA的表达 用0.25%胰蛋白酶消化、收集细胞后提取细胞总RNA,测260和280 nm处的A值,A260/A280比值为2.0左右。RNA琼脂糖凝胶电泳28S、18S和5S条带清晰可见,表明抽提的RNA较完整,未见明显降解。提取的总RNA经逆转录合成cDNA第1链,并以合成的cDNA为模板,以P2X7受体和Panx1引物进行PCR反应。PCR循环条件:95℃ 10 min;95℃ 10 s,60 ℃ 30 s,50 个循环;95 ℃ 15 s,60 ℃ 600 s,95 ℃ 10 s,结束扩增。
2.6 Western blotting检测P2X7受体和Panx1蛋白的表达 用0.25%胰蛋白酶消化收集贴壁细胞,细胞裂解液160 μL裂解细胞,收集总蛋白经10%SDSPAGE分离,电转移至硝酸纤维素膜膜上;5%脱脂牛奶(TBST 配制,TBST:20 mmol/L Tris-HCl pH 8.0,150 mmol/L NaCl,0.05%Tween20,pH 7.4),室温封闭2 h;加入兔抗大鼠P2X7受体抗体(1∶2 500稀释)或兔抗大鼠Panx1抗体(1∶1 000稀释),4℃摇床过夜;加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 500稀释),室温作用1 h;ECL显色,X光片曝光并记录结果。该实验中以GAPDH为内参照蛋白。
3 统计学处理
采用Prism统计软件进行分析,数据以均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 ATP对PC12细胞形态和活力的影响
ATP作用3 h后倒置相差显微镜下观察PC12细胞形态的变化发现,随着ATP浓度的增加,细胞逐渐变为圆形,体积皱缩,折光性减弱,贴壁细胞数量减少,脱壁细胞增加,见图1。这表明ATP对PC12细胞的损伤作用有浓度依赖性。
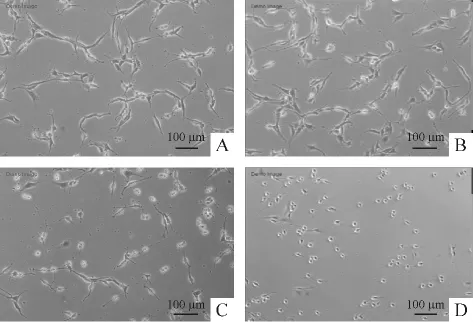
Figure 1.The effect of different concentrations of ATP on the morphological changes of PC12 cells.A:control;B:ATP(1 mmol/L);C:ATP(3 mmol/L);D:ATP(5 mmol/L).图1 不同浓度ATP对PC12细胞形态的影响
采用CCK-8法检测细胞存活率,以空白对照组细胞存活率为100%,则1 mmol/L、3 mmol/L和5 mmol/L ATP组存活率分别为100.94%、87.29%和71.96%,其中3 mmol/L和5 mmol/L ATP显著低于对照组,差异均有统计学意义(P<0.05),且随着ATP浓度的增加,细胞存活率降低呈剂量依赖性趋势,见图2A。由图2B中可知,5 mmol/L ATP作用2 h组细胞存活率显著下降(P<0.05),3 h组差异更显著(P<0.01),表明细胞存活率在 ATP作用3 h内,随着时间的延长而细胞活力逐渐下降。
2 ATP介导PC12细胞的膜孔形成
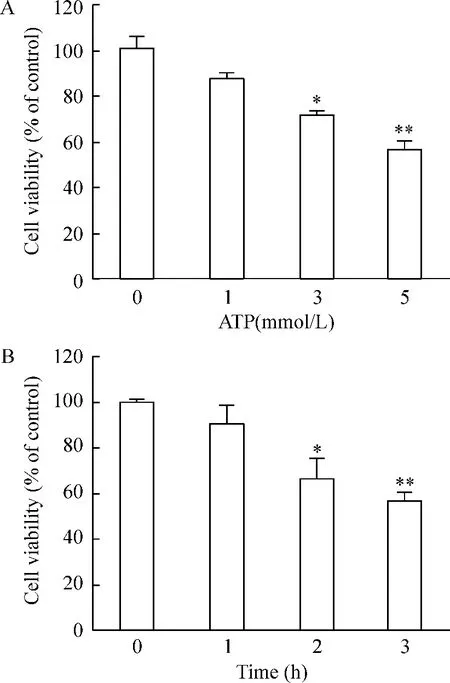
Figure 2.The effect of different concentrations of ATP(A)or 5 mmol/L ATP for different time periods(B)on the viability of the PC12 cells.Mean ± SD.n=3.*P <0.05,**P < 0.01 vs control group(0 mmol/L or 0 h).图2 不同浓度ATP对PC12细胞存活率的影响
荧光物质YO-PRO-1摄入作为膜孔形成的指标,在荧光显微镜下观察不同浓度ATP对细胞摄入YOPRO-1的影响。0、1、3和5 mmol/L ATP作用PC12细胞15、30和60 min发现,同一浓度的ATP作用,随着时间的增加胞内荧光强度逐渐增加;同一作用时间,则随着ATP浓度的升高,胞内的荧光强度亦增加,表明PC12细胞膜孔激活与施加的ATP浓度和作用时间都有依赖性,见图3A。0 mmol/L、1 mmol/L、3 mmol/L和5 mmol/L ATP刺激 PC12细胞后1 h,YO-PRO-1的荧光强度分别是 1.00 ±0.04、1.08 ±0.04、1.11 ±0.07 和1.15 ±0.06。其中3 mmol/L 和5 mmol/L ATP处理组的细胞荧光强度均明显高于对照组细胞(P <0.05),见图3B。
3 ATP对P2X7受体和Panx1 mRNA表达的影响
实时荧光定量PCR检测结果显示,1 mmol/L ATP对细胞的P2X7受体mRNA表达未见明显影响(P >0.05),3 mmol/L和5 mmol/L ATP组 P2X7受体mRNA表达均明显增加(P<0.05)。但各浓度ATP作用PC12细胞后,Panx1 mRNA的表达没有显著变化(P >0.05),见图4。

Figure 3.The effect of extracellular ATP on uptake of YO-PRO-1 in the PC12 cells.A:the cells were imaged at different time points;B:the cells were quantified with plate-reader assay at 60 min.Mean ±SD.n=3.**P <0.01 vs 0 mmol/L.图3 不同浓度ATP对YO-PRO-1摄入的影响
4 ATP对P2X7受体和Panx1蛋白的表达
蛋白印迹结果表明,1 mmol/L ATP作用3 h后P2X7受体蛋白的表达与对照组无显著差异(P>0.05),3 mmol/L和5 mmol/L ATP组的P2X7受体蛋白表达均明显增加(P<0.05)。但不同浓度ATP作用PC12细胞后,Panx1蛋白表达均未见显著变化(P >0.05),见图 5。
5 BBG和CBX对ATP诱导的细胞损伤的影响
采用CCK-8法检测细胞存活率,以空白对照组细胞存活率为100%。BBG、CBX、BBG+CBX和YOPRO-1处理细胞,细胞活性与对照组比均无明显差异,见图6A。ATP(5 mmol/L)组的细胞活性则明显低于对照组(P<0.01),BBG预孵育后再用ATP处理,则细胞活性明显高于ATP组(P<0.01),CBX预孵育则未见阻断 ATP效应(P>0.05),见图6B。BBG+CBX同时预孵育与BBG预孵育的细胞活性也明显高于ATP组,与单用BBG预孵育组的结果无明显差异,表明BBG+CBX并未进一步增强BBG对ATP的阻断效应。
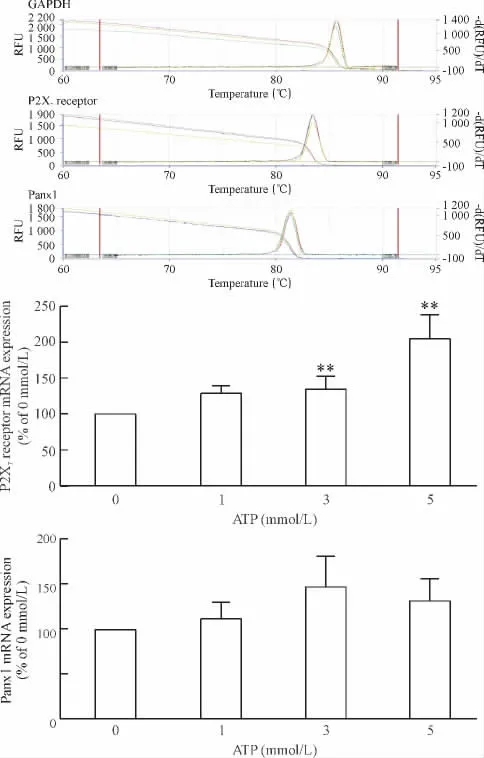
Figure 4.The effect of different concentrations of ATP on the mRNA expression of P2X7receptor and Panx1 in the cultured PC12 cells.Mean ± SD.n=3.**P < 0.01 vs 0 mmol/L.图4 ATP对P2X7受体和Panx1 mRNA表达的影响
6B BGCBXATP
和对介导的膜孔形成的影响
BBG或CBX处理细胞,摄入YO-PRO-1的荧光强度与对照组比均无明显差异,见图7A。ATP(5 mmol/L)组的荧光强度则明显高于对照组(P<0.01),BBG预孵育后再用ATP处理,则荧光强度明显低于ATP组(P<0.01),CBX预孵育则未见阻断ATP效应(P>0.05),见图7B。BBG+CBX同时预孵育与BBG预孵育的荧光强度无明显差异,表明BBG+CBX并未进一步增强BBG对ATP的阻断效应。

Figure 5.The effect of ATP on the protein expression of P2X7receptor(A)and Panx1(B)in the cultured PC12 cells.Mean ±SD.n=3.**P <0.01 vs 0 mmol/L.图5 ATP对P2X7受体和Panx1蛋白表达的影响
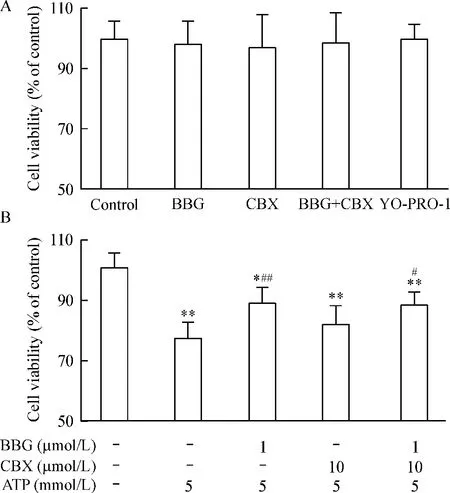
Figure 6.The effects of BBG,CBX and YO-PRO-1 on the viability of PC12 cells induced by ATP(B)or not(A).Mean ±SD.n=3.*P < 0.05,**P <0.01 vs control no treatment;#P <0.05,##P <0.01 vs ATP alone.图6 BBG和CBX对ATP诱导的细胞损伤的影响
讨 论
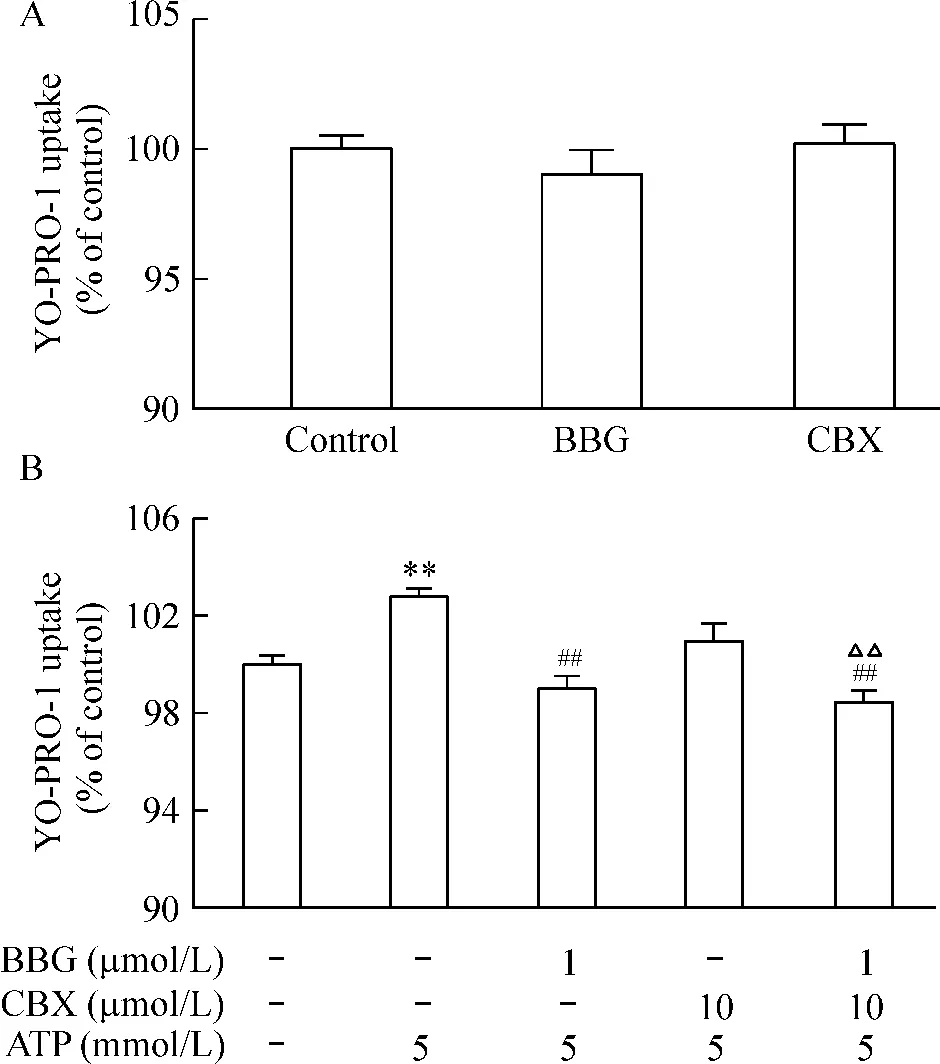
Figure 7.The effects of BBG and CBX on the YO-PRO-1 uptakeof PC12 cells induced by ATP(B)or not(A).Mean± SD.n=3.**P < 0.01 vs control(no treatment);##P <0.01 vs ATP alone;△△P <0.01 vs CBX+ATP.图7BBG和CBX对胞外高浓度ATP诱导细胞摄入YOPRO-1的影响
近年来越来越多的实验结果显示,细胞损伤或死亡时大量ATP释放到胞外。脑外伤后损伤周围区ATP浓度、P2X7受体表达上调,继而引起神经元继发性损伤。在体脑缺氧缺血或离体糖氧剥夺模型都观察到细胞外ATP明显升高,Franke等[8]将大脑皮质脑片在低氧条件(95%N2、5%CO2)下培养30 min就可引起细胞形态学的变化,若用ATP-P2X7受体阻断剂磷酸吡哆醛预处理,则可阻止细胞死亡,表明ATP-P2受体在缺氧缺血脑损伤中有重要作用。新近美国生理学杂志“编辑聚焦”栏目发表评论文章[2]指出:越来越多的证据提示“ATP是一种死亡因子”,“P2X7受体是凋亡和坏死的主要介导者”。
PC12细胞常常用作研究缺氧缺血神经元的模型细胞,本实验室已经积累了较多的经验[9]。P2X7受体在神经胶质细胞的表达有较多的报道[10],但神经元表达P2X7受体则研究较少[11],PC12细胞是否分布有P2X7受体尚需更多证据[12]。本文结果表明PC12细胞表达有一定量的P2X7受体mRNA和蛋白。这一结果与近期南昌大学的报道相符合[12],为PC12细胞用于研究ATP的毒性效应及其机制奠定了基础。
在许多组织和细胞的实验中观察到,P2X7受体长时间或高浓度激动剂激活后可形成膜孔,诱导炎症介质的释放,这种特性与多种炎症性疾病密切相关[13]。本文以荧光物质YO-PRO-1摄入为指标,观察到ATP诱导了PC12细胞的膜孔形成。发现随着3 mmol/L ATP作用时间的延长,细胞摄取YO-PRO-1增加,明显高于对照组,具有时间依赖性。随着胞外ATP浓度的升高,细胞摄取YO-PRO-1也逐渐增加,具有浓度依赖性。CCK-8检测细胞活性的结果显示,随着胞外ATP浓度增高,细胞存活率降低,呈剂量依赖性,与YO-PRO-1摄入实验的结果相符合,彼此印证了外源性ATP高剂量、长时程作用会导致细胞越来越严重的损伤。
目前有学者认为P2X7受体-Panx1复合物是膜孔形成的基础[14]。研究发现急性分离的海马锥体神经元在氧和葡萄糖剥夺(oxygen and glucose deprivation,OGD)早期,打开一种大电导通道,该通道开放时其电导高达550 pS,允许大分子染料指示剂calcein和SR101通过,且可被半通道抑制剂CBX阻断。根据其电生理特点可以判断其为缝隙连接半通道,并推测这种通道由Panx1组成[15]。既往研究发现,P2X受体长时间被高浓度ATP激活(其中P2X7受体最为显著)可允许低于900 D的分子和离子通过,导致细胞水肿、空泡形成、凋亡和坏死[5]。该现象一直未得以解释。也有文献报道,P2X7受体通道的某些性质与连接蛋白Panx1相似[16]。有较多研究显示,P2X7受体与Panx1是偶联的。
近年来研究发现ATP对神经细胞的作用存在双重性:既能够促进神经元的生长发育,促进神经突起的生长,也能够诱导神经细胞凋亡或死亡[17]。那么胞外高浓度的ATP长时间作用细胞,损伤细胞,是否影响了细胞膜通透性,如果影响了,那么主要由P2X7受体介导,还是主要由Panx1介导呢?本文用BBG或CBX预孵育处理后,发现BBG预孵育组可以有效减少YO-PRO-1的摄入,CBX预孵育组没有明显阻断效应,且BBG预孵育组与BBG+CBX共同预孵育组没有明显差异,提示ATP引起的细胞通透性的改变可能主要与P2X7R激活有关,与细胞活力的实验结果相符合。进一步通过real-time PCR和蛋白印迹实验对P2X7受体和Panx1 mRNA和蛋白进行检测,结果显示随着ATP的浓度增加,P2X7受体的表达逐渐增加,具有浓度依赖性,但Panx1的表达没有明显变化。实验结果进一步表明ATP诱导的细胞损伤与P2X7受体的表达上调相一致。根据上述结果,我们设想ATP与P2X7受体作用后可能通过调节Panx1蛋白形成膜孔,大量胞内溶质透出而引起细胞死亡。
综上所述,胞外高浓度ATP可使PC12细胞形成膜孔,增加细胞通透性,造成细胞的损伤,降低细胞活力。ATP引起PC12细胞膜孔形成的关键靶点是P2X7受体蛋白,而Panx1半通道蛋白在膜孔形成中的作用及其与P2X7受体之间的关系,ATP上调P2X7受体后,如何激活Panx1所涉及的具体细节尚需更多的研究予以证实。
[1] 王国红,郭直岳,尹雅玲,等.三磷酸腺苷对N9小胶质细胞的损伤作用及其机制[J].中国病理生理杂志,2012,28(9):1597-1604.
[2] Zarjou A,Agarwal A.ATP as a death factor:purinergic signaling in renal epithelial-fibroblast cross talk[J].Am J Physiol Renal Physiol,2011,300(1):F60-F61.
[3] Lajdova I,Oksa A,Chorvat D,et al.Purinergic P2X7receptors participate in disturbed intracellular calcium homeostasis in peripheral blood mononuclear cells of patients with chronic kidney disease[J].Kidney Blood Press Res,2012,35(1):48-57.
[4] Pelegrin P,Surprenant A.The P2X7receptor-pannexin connection to dye uptake and IL-1beta release[J].Purinergic Signal,2009,5(2):129-137.
[5] 张秀军.白血病细胞的核苷酸受体P2X7[D].北京:中国协和医科大学,2004.
[6] 侯志慧,王国红,吴春平,等.孕酮对氧糖剥夺损伤的PC12细胞的保护作用[J].中国病理生理杂志,2012,28(2):269-273.
[7] Li H,Wang S,Chuang AY,et al.Activity-dependent tar-geting of TRPV1 with a pore-permeating capsaicin analog[J].Proc Natl Acad Sci U S A,2011,108(20):8497-8502.
[8] Franke H,Krugel U,Illes P.P2 receptors and neuronal injury[J].Pflugers Arch,2006,452(5):622-644.
[9] 吴春平,王国红,张 勇,等.米非司酮对孕酮防护PC12细胞氧糖剥夺损伤的影响[J].中国应用生理学杂志,2013,29(2):132-134.
[10] Zhang H,Liu L,Yang Z,et al.P2X7receptor mediates activation of microglial cells in prostate of chemically irritated rats[J].Int Braz J Urol,2013,39(2):276-285.
[11] Innocenti B,Pfeiffer S,Zrenner E,et al.ATP-induced non-neuronal cell permeabilization in the rat inner retina[J].J Neurosci,2004,24(39):8577-8583.
[12] Xu H,Wu B,Jiang F,et al.High fatty acids modulate P2X7expression and IL-6 release via the p38 MAPK pathway in PC12 cells[J].Brain Res Bull,2013,94:63-70.
[13]徐 宏,梁尚栋.P2X7受体在炎症性疾病中的作用及其机制[J].生理学报,2013,65(2):244-252.
[14] Wicki-Stordeur LE,Swayne LA.Large pore ion and metabolite-permeable channel regulation of postnatal ventricular zone neural stem and progenitor cells:interplay between aquaporins,connexins,and pannexins?[J].Stem Cells Int,2012,2012:454180.
[15]孙丽娜.Pannexin蛋白在大鼠全脑缺血/再灌注损伤中的作用研究[D].浙江:浙江大学,2010.
[16]汪敬业,孙丽娜,夏 强,等.Pannexin通道蛋白功能研究概述[J].生命科学,2010,22(6):561-566.
[17]毕爱玲.三磷酸腺苷诱导凋亡及其作用机制的研究[D].山东:山东大学,2007.

