富血小板血浆修复牙周骨缺损的临床疗效
钱文慧,徐 艳,孙 颖,陈 武,顾 宁
(江苏南京210029:1.南京医科大学口腔医学研究所;2.南京医科大学附属口腔医院牙周科;3.南京医科大学附属口腔医院检验科)
牙周骨缺损的修复是临床牙周治疗的难点,常规牙周翻瓣术可彻底清除炎性组织、改善牙周临床状态,但对骨缺损修复的促进作用有限。因此,很多骨移植材料被应用于临床研究中。此外,利用生长因子来促进、增强牙周前体细胞的活性,使其迁移并占据病损部位,增殖、分化,从而形成新的牙周组织,也是目前研究的热点之一。
富血小板血浆(platelet-rich plasma,PRP)是从人血浆中提取的自体血小板浓缩液,由Assoian[1]1984年提出。目前已证实PRP中含有大量高浓度的生长因子,但其中发挥促进细胞增殖作用的因子主要为PDGF和TGF-β,且主要存在于血小板中的α颗粒内,当PRP与激活剂混合后这些因子即释放出来,促进软硬组织的再生和修复[2]。因此,可通过PRP技术制备自体的高浓度血小板制品[3],借助其中大量的生长因子促进骨的整合与修复,以达到骨再生和重建的目的[4]。
本研究通过运用PRP和羟基磷灰石(hydroxyapatite,HA)治疗牙周骨缺损,评价其修复效果,为PRP技术在牙周临床中的应用提供参考。
1 临床资料和方法
1.1 主要材料和仪器
天博齿固羟基磷灰石生物陶瓷(北京意华健科贸有限公司),离心机(BEJLJ,DT5-2,上海安亭科学仪器),血常规分析仪(SYSMEX,xs-1000i,SYSMEX CORPORATION,日本)。
1.2 临床资料
选择就诊于我院牙周科的中、重度慢性牙周炎患者为研究对象。纳入标准:患牙邻面有骨下袋,经牙周基础治疗4周以上探诊深度仍>5 mm,需进行翻瓣骨移植术者(有牙髓炎症状者均常规行根管治疗术);无全身性疾病,女性非妊娠、哺乳期。共纳入20例患者的20个患牙,病变部位骨下袋(二壁或三壁袋)共20处。20例患者随机分成2组(n=10):HA/PRP 组(43.70 ±11.54)岁,HA组(40.20 ±8.66)岁,两组患者在性别、年龄、吸烟以及牙髓状况方面差异均无统计学意义(P >0.05)。
1.3 方法
1.3.1 PRP 凝胶的制备
采用二次梯度离心法进行PRP制备[3],经计数血小板浓度为全血的4倍以上。使用前将PRP与激活剂(生理盐水0.9 mL和100 U/mL凝血酶0.1 mL混合制成)按1∶1比例在空气中混合、摇匀,经6~10 s后即制成PRP凝胶。制备过程中严格无菌操作。
1.3.2 手术方法
局麻下患牙及其近、远中各1~2个邻牙以内斜切口翻开全厚瓣暴露骨缺损区并清创后,HA/PRP组植入PRP凝胶与HA的混合物,HA组植入HA与血液的混合物,用中等压力将混合物充填入骨缺损区,使之与骨袋口平齐,充满根分叉,适当压紧,确保植入材料不得暴露于口腔中后缝合。术后口服罗红霉素胶囊3 d,西吡氯铵漱口水含漱4周,以防感染。于术后3、6个月观察牙龈退缩(GR)、探诊深度(PD)、临床附着水平(CAL)等临床指标,并进行骨高度、骨密度分析。骨密度以平均光密度(MOD)值的变化作为参考。
1.4 统计学分析
用SPSS 17.0软件进行统计学处理,统计变量以均数±标准差表示。配对t检验比较组间手术前后各项临床参数的差异;协方差分析比较组间骨高度及骨密度的变化以排除基线时各因素的干扰;组内比较时数值校正后采用方差分析。检验水准α =0.05。
2 结果
20例患者伤口愈合良好,无炎症及感染,未见明显骨粉暴露。
2.1 临床指标变化
术后3、6个月两组PD、CAL较术前相比均明显降低(P <0.05),GR 无显著性改变(P>0.05)。术后3、6个月相比,两组GR、PD、CAL无显著性差异。临床牙周再附着,HA/PRP组术后3个月显著优于HA组(P<0.05),6个月与3个月相比无统计学差异(P>0.05)(表1)。
2.2 X线片影像的变化
术后3、6个月牙槽骨垂直或角形吸收处均可见新骨生长,骨量增加,有正常牙周膜间隙存在,周围正常骨组织的界线已变模糊,但骨小梁密度稍低于周围骨密度。
2.3 骨缺损区牙槽骨高度及密度变化
与术前比较,两组术后3、6个月牙槽骨高度及骨密度均略有增加(P>0.05);3、6个月时间点相比,两组牙槽骨高度及骨密度亦无统计学差异(P>0.05);术后3、6个月HA/PRP组的MOD值均明显高于HA组(P<0.05)(表2)。附典型病例。
表1 临床指标的改变()

表1 临床指标的改变()
同一组别,与术前相比不同字母为P<0.05;不同组别相比,相同字母为P>0.05,不同字母为P<0.05
临床指标(mm)术前HA/PRP组 HA组术后6术后3个月HA/PRP组 HA组个月HA/PRP组 HA组GR 1.70 ±0.63 1.10 ±0.35 2.20 ±0.39 1.30 ±0.371.70 ±0.37 1.05 ±0.34 PD 9.30 ±0.52a 8.40 ±0.54a 3.60 ±0.31b 4.05 ±0.41b 3.10 ±0.34b 4.00 ±0.37b CAL 10.70 ±0.90a 9.10 ±0.91a 5.60 ±0.62b 5.05 ±0.76b 4.50 ±0.62b 4.55 ±0.70b牙周再附着 4.05 ±0.64c 5.10 ±0.53d 4.55 ±0.82 6.20 ±0.47
表2 骨高度及骨密度的变化()

表2 骨高度及骨密度的变化()
*与术前相比P<0.05
项目 术前HA/PRP组 HA组术后6术后3个月HA/PRP组 HA组个月HA/PRP组 HA组骨高度(mm) 374.50 ±67.06 321.77 ±51.02 192.44 ±42.44* 185.75 ±52.96* 184.47 ±41.61* 180.99 ±52.53*骨密度值 74.42 ±10.70 89.58 ±14.12 107.50 ±31.05* 100.49 ±15.48* 114.57 ±10.68* 104.02 ±15.77*
患者男,30岁。检查:25牙周骨缺损,一、二壁骨袋。治疗:25骨缺损区植入HA/PRP。术后3个月骨缺损修复,牙槽骨高度明显增加,植骨区与周围正常骨组织的界线已变模糊,有新骨再生,骨小梁密度明显增加(图1)。
患者女,32岁。检查:33近中牙周骨缺损,二、三壁骨袋;治疗:33骨缺损区植入HA,术后3个月骨缺损修复,牙槽骨高度增加,但植骨区与周围正常骨组织的界线仍明显,新骨再生情况欠佳(图2)。

图1 牙25 X线片(植入HA/PRP)
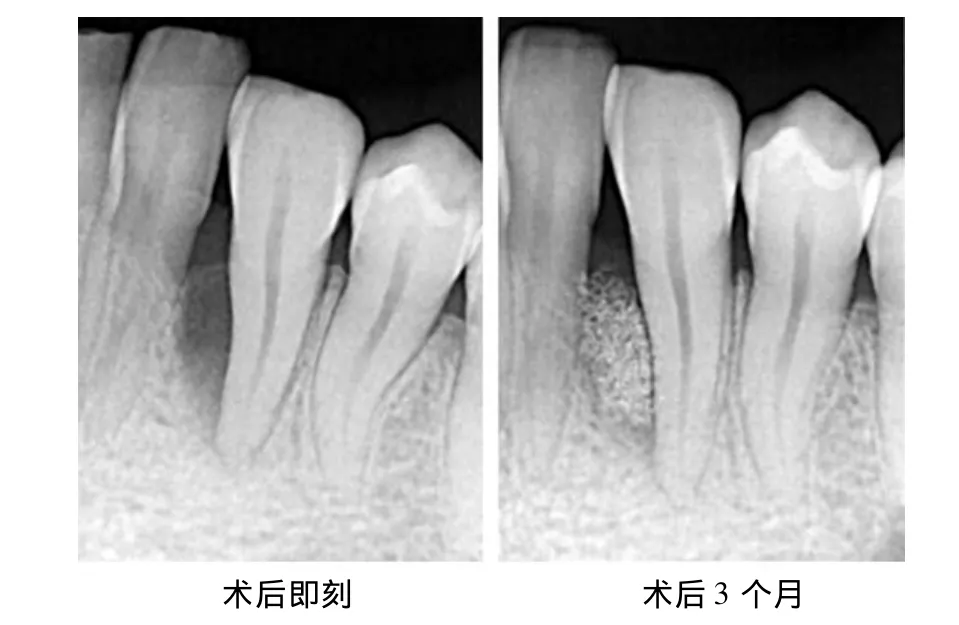
图2 牙33 X线片(植入HA)
3 讨论
现今,再生性手术被广泛应用于修复牙周炎造成的组织缺损,其目的在于促进新的牙骨质和牙槽骨形成,获得牙周组织结构和功能的重建,但手术所能达到的骨缺损区修复并不完善。生长因子因其可参与调节组织修复再生过程中的一系列细胞活动,如增殖、趋化、分化和胞外基质的生物合成而成为牙周组织再生研究的热点[5],PRP作为一种自体来源的生长因子,克服了外源性生长因子的不足而备受关注。
有研究证实PRP是血小板浓度为全血4倍以上的血浆,内含多种能促进组织修复和再生的生长因子,各种生长因子之间会相互影响和作用,调节牙周膜或附近骨组织血管区域细胞的趋化、迁移、增殖和分化[6]。目前PRP的临床应用已相对成熟,但其对牙周骨缺损修复的真实效应仍存在着一定的争议[7],因此需要积累更多的临床研究数据来指导其用于临床治疗。
HA属于骨替代品的非骨移植材料,是脊椎动物骨骼及牙齿中的主要无机成分,具有骨引导性。在骨质中其周围规则地排列着骨胶原纤维,牙槽骨中HA的含量高达97%。目前已证实,作为一种临床应用研究使用较多的骨移植材料,HA对牙周骨再生具有促进作用[8]。
本研究使用PRP结合HA生物陶瓷材料治疗慢性牙周炎导致的牙周骨缺损。结果显示无论是否应用PRP,HA都能显著降低牙周探诊深度与临床附着丧失水平。但在牙周再附着方面,PRP的作用得到了体现,通过与HA联合作用,显著促进了牙周软组织再生[9-10],且该促进作用与治疗时间存在一定的关系。术后3、6个月有牙槽骨的修复和再生,虽然两组骨高度的增加无统计学差异,但HA/PRP组的MOD值明显高于HA组,推测PRP的骨再生作用在本研究中主要反映在唇/颊-舌/腭向骨量及骨密度的增加。
在骨移植术后1年内都可能存在牙周组织的继续重建,但由于PRP对毛细血管的再生作用主要发生在组织愈合的早期,观察期过长反而可能不能反映出PRP的早期作用。本结果表明术后3个月的各项牙周指标与术前均有显著差异,证实了骨移植术后牙周组织持续存在着再生与重建,但随观察时间的延长,术后6个月时仍有进一步的改善,但与3个月相比无显著差异,推测骨移植术后3个月时各项指标已基本稳定。
可能有以下因素影响手术治疗效果:① 牙髓感染:本研究纳入已行根管治疗术的死髓牙,虽然目前没有明确的研究证实牙髓感染对牙周组织的修复再生具有影响,但并不能排除其可能性;②术后感染和菌斑控制:复查时发现多数患者有牙周探诊出血,可见患者未能长期保持较高水准的口腔卫生。术后早期使用广谱抗生素,并用抗菌含漱液预防,均未发生炎症及感染现象,但随着时间的推移,患者口腔卫生自我维护不足将导致菌斑的再度堆积以及慢性炎症;③PRP的激活:PRP促进骨再生效果欠佳的主要原因是高浓度凝血酶的加入导致丝裂原的快速释放,而此时成骨细胞的增殖与分化尚未开始,因此错过了最佳的作用时机。激活时机的差异可能影响置入骨缺损区的PRP所发挥的效能,进而影响到手术效果[11]。因此有学者提出-80℃冻存的PRP不会影响其中生长因子的生物学功能,故临床应用中可冻存PRP,可在一定程度上减少误差[3]。
本结果表明联合HA及PRP技术治疗中、重度慢性牙周炎导致的牙周骨缺损,在术后3、6个月均显示出了在促进牙周再附着及骨密度增加的优越性,继续配合术后定期复诊复治和严格口腔卫生控制,将取得更好的远期临床效果。
[1]Assoian RK,Grotendorst GR,Miller DM,et al.Cellular transformation by coor-dinated action of three peptide growth factors from human platelets[J].Nature,1984,309(5971):804 -806.
[2]Carlson NE,Roach JRRB.Platelet-rich plasma:Clinical applications in dentistry[J].J Am Dent Assoc,2002,133:1383 -1386.
[3]王悦,朱喆,刘昕鸣,等.富血小板血浆提取方法的探讨[J].实用口腔医学杂志,2011,27(5):643-648.
[4]Griffin XL,Smith CM,Costa ML.The clinical use of plateletrich plasma in the promotion of bone healing:A systematic review[J].Injury,2009,40(2):158-162.
[5]Oates TW,Rouse CA,Coehran DL,et al.Mitogenic effects of growth factors on human periodontal ligament cells in vitro[J].J Periodontol,1993,64(2):142 -148.
[6]Schmitz JP,Hollinger JO.The biology of platelet-rich plasma[J].J Oral Maxillofac surg,2001,59(10):1119-1125.
[7]Becen D,Dilek S,Atilla B,et al.Clinical evaluation of platelet-rich plasma and bioactive glass in the treatment of intra-bony defects[J].J Clin Periodontol,2007,34(8):709 -715.
[8]Trombelli L,Simonelli A,Pramstraller M,et al.Single flap approach with and without guided tissue regeneration and a hydroxyapatite biomaterial in the management of intraosseous periodontal defects[J].J Periodontol,2010,81(9):1256 -1263.
[9]施六霞,狄昌萍,徐艳,等.富血小板血浆对牙周膜成纤维细胞的增殖、迁移和分化的影响[J].实用口腔医学杂志,2010,26(2):194- 197.
[10]Jerome AL,Keshen RM,Irene HA,et al.Influence of the application of platelet-enriched plasma in oral mucosal wound healing[J].Clin Oral Implants Res,2007,18(1):133- 139.
[11]Lacoste E,Gagnon G,Martineau I.Platelet concentrates:effects of calcium and thrombin on endothelial cell proliferation and growth factor release[J].J Periodontol,2003,74(10):1498- 1507.

