肥胖复合牙周炎大鼠血清及牙龈中TNF-α、IL-1β水平与胰岛素抵抗的关系
徐 喆,倪 佳,谢宝仪,轩东英,章锦才
(南方医科大学附属口腔医院·广东省口腔医院,广东广州 510280)
据世界卫生组织2008年公布,每年至少有280万的成年人死于肥胖或者超重,是导致死亡的重要因素[1]。另据报道,牙周炎是成年人失牙的首要因素,并已成为影响我国成年人口腔健康的第一口腔疾病[2]。
有研究发现,代谢综合症可导致更加严重、迅速的牙周破坏,而牙周炎又会对全身性疾病产生一定的影响;因此,关于两者之间的关系越来越受到人们的重视[3-4]。Hotamisligil等[5](1993)首次提出了肥胖与炎症联系。此后许多研究也指出,脂肪组织不仅是能量的储存器官,还是活跃的内分泌器官[6];脂肪的炎症因子可能是连接肥胖、糖尿病、胰岛素抵抗、动脉粥样硬化以及代谢综合征的纽带[7-8]。胰岛素抵抗是 T2DM 的特征,有研究发现,TNF-α、白细胞介素 -1β(Interleukin,IL-1β)可通过介导胰岛β细胞的破坏导致胰岛素抵抗[9-10];而 IL-1β 受体拮抗剂及 IL-1β 抗体均可治疗 T2DM[11-13]。牙周炎,是以牙周支持组织破坏为特征的慢性炎症性疾病。牙周炎部位龈沟液中的IL-1β和TNF-α浓度均高于牙周正常部位,而治疗后其浓度则有所下降;提示牙周炎的炎症程度增加以及预后与 IL-1β的浓度增加有关[4,12.14-15]。牙周炎与肥胖相关性研究认为,牙周炎的发展除了与糖尿病患者的糖化血红蛋白、血糖水平控制不良有关外,还与体质量指数(Body Mass Index,简称BMI,体质量公斤除以身高米的平方)的增加密切相关;而且肥胖还有可能影响牙周炎的治疗效果,并导致更加严重的牙槽骨丧失[16-19]。牙周炎与全身疾病相关性研究指出,过高表达的炎症因子可能会影响全身性疾病及其并发症的发生发展[11]。本实验通过观察肥胖复合牙周炎大鼠牙龈组织和血清中的TNF-α及IL-1β表达水平,及其与胰岛素抵抗的关系,探讨牙周炎对肥胖机体胰岛素抵抗影响的可能机制。
1 .材料和方法
1.1 主要材料、试剂和仪器
SPF级新生SD大鼠[中山大学实验动物中心提供,合格证号:SYXK(粤)2007-0081];0.01 mol/L PBS 缓 冲 液 (pH7.2 ~ 7.4)、0.01 mol/L枸橼酸盐缓冲液(pH 6.0)、水溶性封片剂 clearmount、固红、AP-red(北京中杉金桥生物技术有限公司);多聚赖氨酸防脱片载玻片(北京世泰有限公司);两步法鼠兔通用免疫组化染色二抗试剂盒、浓缩型DAB显色试剂盒(DAKO生物技术有限公司);生物素化SABC抗鼠三步法试剂盒、白细胞介素-1β抗体、肿瘤坏死因子-α抗体(武汉博士德生物工程有限公司);pH测试仪(PHSJ-3F,上海精科);磁力恒温搅拌器(IKA,德国);电子天平0.0001g(BP110S,Sartorius,德国);恒温孵箱(Heraeus,德国);可调移液器(Eppendorf,德国);超低温冰箱(Sanyo,日本);倒置显微镜(Olypus,日本);低温离心机(Thermo,美国);超纯水机(Milli-QUltra-Pure,Millipore,Billerica,MA,德国)。
1.2 方法
1.2.1 肥胖复合牙周炎动物模型的建立
取健康新生SD大鼠32只(均为雄性),随机分为正常对照(C)组、牙周炎(CP)组、肥胖(OB)组、肥胖复合牙周炎(OB+CP)组,共4组,每组8只。C组各大鼠不施加任何干预措施用于对照。CP组各大鼠于12周龄时分别在100 g/L水合氯醛腹腔注射(0.3 mL/100 g)麻醉下,用0~3号丝线(泰丝)结扎其左、右上颌第一、二磨牙颈部(结扎丝尽量置于龈沟内);同时在龈沟内涂布牙龈卟啉单 胞 菌 (Porphyromonas gingivalis,Pg)ATCC33277、伴放线嗜血杆菌(Hctinobacillus actinomycetemcomitans,Ha)ATCC29523、中间普氏菌(Prevotella intermedia,Pi)ATCC25611、具核梭杆菌(Fusobacterium nucleatum,Fn)ATCC255864种主要牙周致病菌的混合菌悬液(109CFU/mL),建立牙周炎模型。OB组各大鼠分别于出生后第2、4、6、8、10 天,皮下注射谷氨酸钠(sigma,3 mg/kg)建立肥胖模型。OB+CP组各大鼠按OB组的方法建立肥胖模型后,再于12周时按CP组的方法结扎左右上颌第一、二磨牙颈部,建立肥胖复合牙周炎模型。各组所有大鼠均于出生后21 d断乳,单笼普通饲料(无菌真空包装,广东省实验动物中心提供)饲养;自由摄食和饮水。
建模期间,每天观察大鼠活动、摄食、排泄等情况;并分别于实验第0天及处死前由2名实验人员用电子秤分别称量各组动物体质量2次,取平均值。
1.2.2 ELISA法检测各组大鼠血清中 TNF-α、IL-1β的水平
建模结束后取各大鼠的血清,用免疫酶联吸附反应(ELISA)法检测血清中TNF-α及IL-1β的水平。ELISA具体步骤:取出酶标板分别将标准品和标记有编号的各样品各100 μL依次加入空白微孔中;然后在标准品孔和样品孔中各加入50 μL的酶标记溶液,(36±2)℃条件进行孵育;60 min后用PBS清洗5次(每次静置10~20 s),并分别于每孔加入底物 A、B 液各 50 μL,(36±2)℃避光孵育15 min;每孔加入50 μL终止液终止反应后,用酶标仪分别测各孔450 nm波长处的吸光度值(OD值)。以标准品OD值/标准品0点OD值为纵坐标,以标准品浓度为横坐标绘制标准曲线;然后根据各样品OD值即可在曲线上查到对应的TNF-α和IL-1β浓度值。
1.2.3 免疫组化检测各大鼠牙周组织中TNF-α、IL-1β 的表达
建模结束后处死所有大鼠,分别取其上颌第一、二磨牙牙龈组织,并常规制备石蜡切片;然后采用免疫组化 Envision二步法检测 TNF-α以及IL-1β的蛋白表达水平。具体方法:切片置60°C恒温箱中烤片2 h后,常规脱蜡至水;30 mL/L过氧化氢孵育10 min,以消除内源性过氧化物酶活性;PBS洗5 min×3次,滴加枸椽酸盐溶液微波修复抗原(高火 6 min,中低火 7 min);PBS洗5 min×3次,滴加稀释的一抗,4°C过夜;PBS洗5 min×3次,滴加二抗工作液,37℃孵育20 min;PBS洗5 min×3次,显色剂DAB显色;自来水充分漂洗终止显色后,透明、苏木精复染、封片,显微镜下观察。阴性对照组以PBS液代替一抗,其余步骤相同。结果判定:TNF-α以及IL-1β阳性染色为棕褐色、定位于细胞质内。采集各组图像,并用图像分析系统计算其光密度值作为TNF-α和IL-1β蛋白的相对表达量。
1.2.4 计算胰岛素抵抗指数HOMA-IR
于大鼠处死前,禁食12 h,剪尾法取血,检测大鼠空腹血糖(强生豪稳微量血糖仪)值;取血清,免疫酶联吸附反应法(ELISA法)检测并记录空腹血清胰岛素表达水平,计算方法如下。
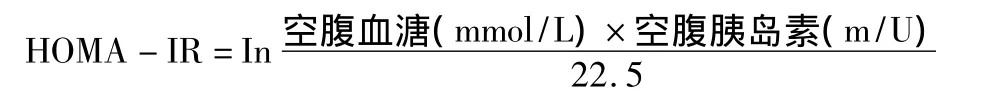
1.3 统计学分析
2 结果
2.1 各组血清TNF-α水平比较及其与胰岛素抵抗的相关性
各组大鼠血清 TNF-α水平以正常对照组(C组)最低,OB+CP组最高,由低到高依次为:C 组(33.952±6.990)<CP 组(42.800±7.452)<OB组(49.356±3.159)<OB+CP组(85.036±9.532),各组间两两相比,除OB组与CP组无统计学差异(P>0.05)外,其余各组间差异均有统计学意义(P<0.05);干预主效应及其相互作用分析显示:牙周炎(F=77.275,P=0.000)与肥胖(F=129.489,P=0.000)两处理因素对于机体血清TNF-α水平的升高具有协同交互作用(F=28.061,P=0.000)(表 1)。
各组HOMA-IR评分以OB+CP组最高,依次为:OB+CP组>OB组>CP组>C组;相关性分析显示,血清 TNF-α水平与胰岛素抵抗指数(HOMA-IR)呈正相关(r=0.854)(图1)。
表1 各组血清TNF-α水平(ng/mL)比较(n=8,)

表1 各组血清TNF-α水平(ng/mL)比较(n=8,)
*主效应的F统计量和P值;#交互效应的F统计量和P值
项目 CP(+) CP(-) Sum F/t P OB(+)85.036 ± 9.53249.356 ±3.15967.196 ±19.660 10.049 0.000 OB(- )42.800 ± 7.45233.952 ±6.99038.376 ± 8.342 2.449 0.028 Sum 63.918 ±23.32441.654 ±9.52552.786 ±20.858 77.275* 0.000*F/t P 9.8730.0005.6800.000129.489*0.000* (F=28.061,P=0.000)#
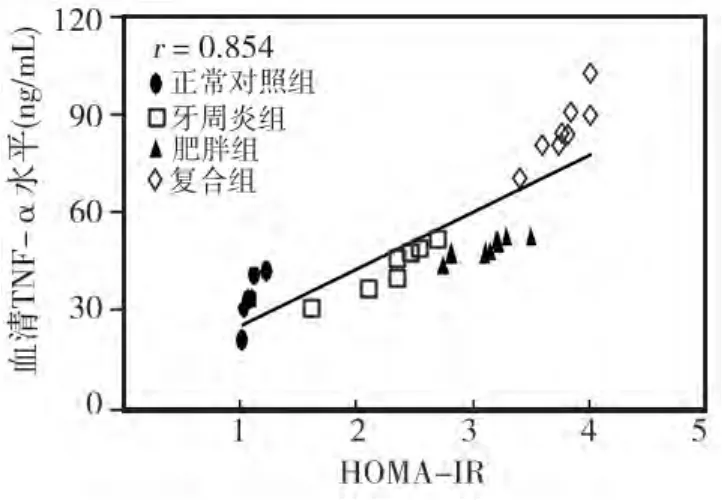
图1 血清TNF-α水平与HOMA-IR相关性分析
2.2 各组血清IL-1β水平比较及其与胰岛素抵抗的相关性
各组大鼠血清IL-1β水平以正常对照组(C组)最低,OB+CP组最高,由低到高依次为:C组(55.733±7.585)<OB 组(65.238 ±5.959)< CP 组(68.245 ±7.060)< OB+CP 组(108.512 ±8.732),各组间相比,除OB组与CP组无统计学差异(P>0.05)外,其余各组间均有显著差异(P<0.05);干预主效应及相互作用分析显示:牙周炎(F=113.630,P=0.000)与肥胖(F=90.460,P=0.000)两处理因素对于机体血清IL-1β水平的升高具有协同交互作用(F=34.519,P=0.000)(表2)。各组 HOMA-IR 评分显示以OB+CP组最高,依次为:OB+CP组>OB组>CP组>C组;血清IL-1β水平与胰岛素抵抗指数(HOMA-IR)呈正相关(r=0.730)(图2)。
表2 各组血清IL-1β水平(ng/mL)比较(n=8,)
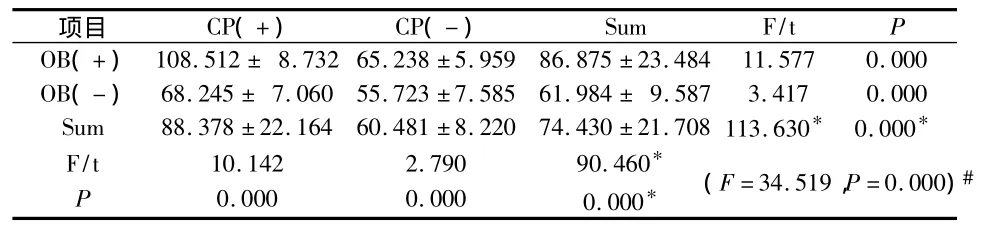
表2 各组血清IL-1β水平(ng/mL)比较(n=8,)
*主效应的F统计量和P值;#交互效应的F统计量和P值
项目 CP(+) CP(-) Sum F/t P OB(+)108.512 ± 8.73265.238 ±5.959 86.875 ±23.484 11.577 0.000 OB(-) 68.245 ± 7.060 55.723 ±7.585 61.984 ± 9.587 3.417 0.000 Sum 88.378 ±22.164 60.481 ± 8.220 74.430 ±21.708113.630* 0.000*F/t P 10.1420.0002.7900.00090.460*0.000* (F=34.519,P=0.000)#
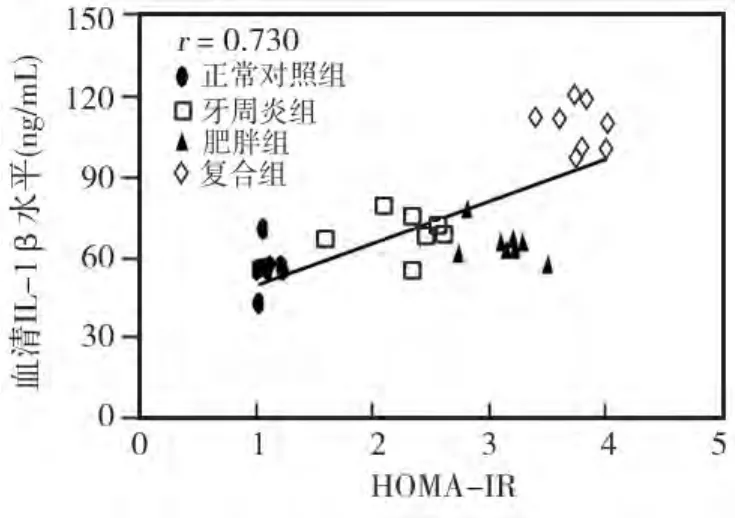
图2 血清IL-1β水平与HOMA-IR相关性分析
2.3 各组牙龈组织中TNF-α和IL-1β的表达水平
与正常对照组相比,CP组和OB+CP复合组牙龈组织中的 TNF-α、IL-1β水平均显著升高(P<0.05),其中以CP组升高最明显,与OB+CP组相比,差异亦有统计学意义(P<0.05);OB组牙龈组织中的TNF-α和IL-1β水平均较正常对照组略有下降(P>0.05),分别与单纯CP组,OB+CP复合组相比差异均有统计学意义(P<0.05)(图3~4)。
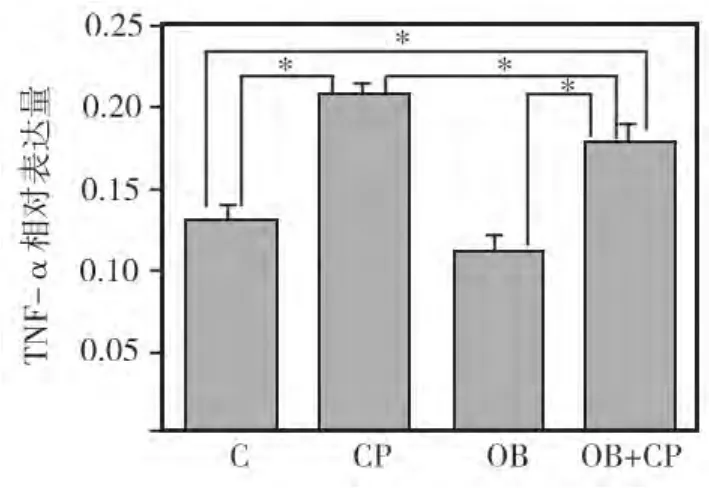
图3 各组大鼠牙龈组织中TNF-α相对表达量比较
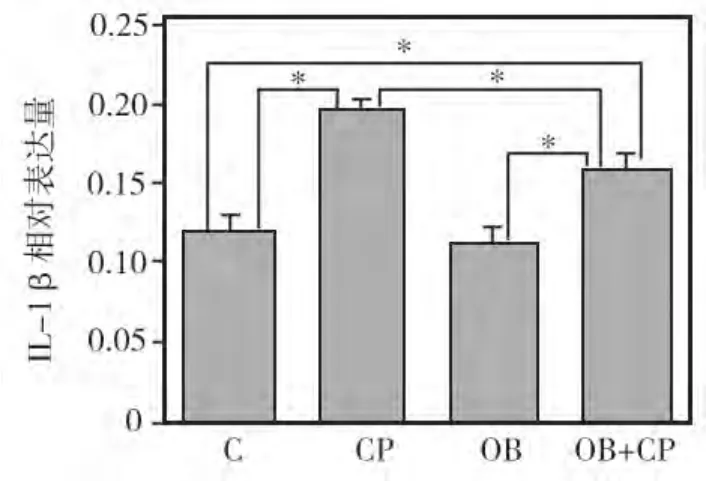
图4 各组大鼠牙龈组织中IL-1β相对表达量比较
3 讨论
近20年间,肥胖在全球各发达国家以及发展中国家的发病率均在逐年上升,加之其有可能导致糖尿病、心血管疾病以及胰岛素抵抗等多种影响全身健康的并发症,而越来越受到人们的广泛关注。此外,肥胖还与多种口腔疾病尤其是牙周病有关;而牙周炎和肥胖又均与多种炎症相关因子的慢性分泌有关,两者有着共同的病理机制[20-24]。
本实验中发现,CP组、OB组以及OB+CP组血清中的TNF-α、IL-1β的表达水平均较正常对照组显著升高。其中以OB+CP组升高的幅度最大,与其他模型组相比均有统计学差异(P<0.05)。析因方差分析显示,牙周炎和肥胖两处理因素对大鼠血清的TNF-α、IL-1β升高有协同效应作用;而TNF-α、IL-1β水平又与抵抗指数呈正相关。提示,牙周炎可能通过促进相关炎症因子分泌而影响肥胖机体胰岛素抵抗的发生发展,分析可能机制如下:①肥胖状态下,脂肪组织分泌的炎症因子可导致机体发生一系列的“瀑布级联反应”,从而使相应的炎症反应增强,本课题组前期的研究曾发现,牙周炎能促进肥胖机体脂肪组织中巨噬细胞的集聚[24];②牙周炎相关致病微生物及其产物可刺激牙周组织产生高浓度的炎症因子,并通过破溃的牙龈上皮进入血循环,从而提高了血清中炎症因子的水平;③细菌相关产物进入血液循环后,可通过与巨噬细胞表面的TLR4结合而激活NF-κB信号通路,然后再进一步激活相关炎症基因的表达,并通过复杂的相关机制促进炎症反应以及IR的发生[25-26]。
本结果显示:OB组牙龈组织中的 TNF-α、IL-1β水平均较正常对照组有所下降,但无显著差异;OB+CP组牙龈组织中的 TNF-α、IL-1β水平虽较正常对照组显著升高,但明显低于CP组。提示,可能与肥胖状态下机体的固有免疫机制受损,从而使得局部组织对炎症反应水平降低有关。TNF-α是目前已知且公认的参与胰岛素抵抗的重要炎症因子[27],也是牙周炎发生发展的重要炎症指标。肥胖时,脂肪组织分泌的大量TNF-α不仅能降低胰岛素的敏感性,而局部组织中升高的TNF-α还可通过激活破骨细胞而导致骨吸收[28],从而加快了牙周炎的进程。IL-1β是胰岛素抵抗中的关键因子,与胰岛素抵抗、细胞因子产生以及炎症信号通路激活等密切相关。有研究显示,牙周炎状态时,局部组织和血清的IL-1β浓度均高于健康对照者;升高的IL-1β不仅含影响代谢综合症的进程,还可能影响远处的重要器官、组织,并使其产生相应的病理、生理学变化[29-30]。
本结果提示,在肥胖机体中,牙周炎可能通过促进其血清中TNF-α及IL-1β的分泌而加剧胰岛素抵抗的发生、发展;在不肥胖机体中,牙周炎虽可在一定程度上增加了牙龈局部组织以及血清中炎症因子的表达,但尚不足以引发机体发生胰岛素抵抗。因而,牙周健康的维护对于伴随有肥胖且有慢性炎症状态的人群更具有重要的意义。
[1]Zheng H,Tumin D,Qian Z.Obesity and mortality risk:new findings from body mass index trajectories[J].Am J Epidemiol,2013,178(11):1591 -1599.
[2]Deng T,Wang L,Lv J,et al.Association of three bacterial species and periodontal status in Chinese adults:an epidemiological approach[J].J Clin Microbiol,2011,49(1):184 -188.
[3]Saxlin T,Ylostalo P,Suominen-Taipale L,et al.Association between periodontal infection and obesity:results of the Health 2000 Survey[J].J Clin Periodontol,2011,38(3):236 -242.
[4]刘芳,陈蕾,轩东英,等.口腔卫生指导对2型糖尿病伴慢性牙周炎患者牙周炎症控制及血糖代谢水平的影响[J].广东牙病防治,2012,20(6):298-301.
[5]Hotamisligil GS,Shargill NS,Spiegelman BM.Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance[J].Science,1993.259(5091):87 -91.
[6]Wells JC.The evolution of human adiposity and obesity:where did it all go wrong[J].Dis Model Mech,2012,5(5):595 -607.
[7]Rech RL,Nurkin N,da Cruz I,et al.Association between periodontal disease and acute coronary syndrome[J].Arq Bras Cardiol,2007,88(2):185 -190.
[8]Vinciguerra F,Baratta R,Farina MG,et al.Very severely obese patients have a high prevalence of type 2 diabetes mellitus and cardiovascular disease[J].Acta Diabetol,2013,50(3):443-449.
[9]Jager J,Gremeaux T,Cormont M,et al.Interleukin-1beta-induced insulin resistance in adipocytes through down-regulation of insulin receptor substrate-1 expression[J].Endocrinology,2007(148):241-251.
[10]Luo N,Liu J,Chung BH,et al.Macrophage adiponectin expression improves insulin sensitivity and protects against inflammation and atherosclerosis[J].Diabetes,201059(4):791 -799.
[11]Rose-Hill S,Ford PJ,Leishman SJ,et al.Improved periodontal health and cardiovascular risk[J].Aust Dent J,2011,56(4):352-357.
[12]Kataria NG,Bartold PM,Dharmapatni AA,et al.Expression of tumor necrosis factor-like weak inducer of apoptosis(TWEAK)and its receptor,fibroblast growth factor-inducible 14 protein(Fn14),in healthy tissues and in tissues affected by periodontitis[J].J Periodontal Res,2010.45(4):564 -573.
[13]Akash MS,Shen Q,Rehman K,et al.Interleukin-1 receptor antagonist:A new therapy for type 2 diabetes mellitus[J].J Pharm Sci,2012.101(5):1647 -1658.
[14]Pacios S,Kang J,Galicia J,et al.Diabetes aggravates periodontitis by limiting repair through enhanced inflammation[J].FASEB J,2012,26(4):1423 -1430.
[15]üstün K,Erciyas K,Ksac kB,et al.Host modulation in rheumatoid arthritis patients with TNF blockers significantly decreases biochemical parameters in periodontitis[J].Inflammation,2013,36(5):1171 -1177.
[16]Engebreston S,Chertoq R,Nichols A,et al.Plasma levels of tumour necrosis factor-alpha in patients with chronic periodontitis and type 2 diabetes[J].J Clin Periodontol,2007,34(1):18-24.
[17]Costa FO,Miranda Cota LO,Pereira Lages EJ,et al.Progression of periodontitis and tooth loss associated with glycemic control in individuals undergoing periodontal maintenance therapy:a 5-year follow-up study[J].J Periodontol,2013,84(5):595-605.
[18]Jiang ZL,Cui YQ,Gao R,et al.Study of TNF-α,IL-1β and LPS levels in the gingival crevicular fluid of a rat model of diabetes and periodontitis[J].Dis Markers,2013,34(5):295 -304.
[19]Chen L,Luo G,Xuan D,et al.Effects of Non-surgical periodontal treatment on clinical response,serum inflammatory parameters,and metabolic control in type 2 diabetic patients:A randomized study[J].J Periodontol,2012,83(4):435 -443.
[20]Saito T,Shimazaki Y,Koga T,et al.Relationship between upper body obesity and periodontitis[J].J Dent Res,2001.80(7):1631-1636.
[21]Gorman A,Kaye EK,Apovian C,et al.Overweight and obesity predict time to periodontal disease progression in men[J].J Clin Periodontol,2012,39(2):107 -114.
[22]Morita I,Okamoto Y,Yoshii S,et al.Five-year incidence of periodontal disease is related to body mass index[J].J Dent Res,2011,90(2):199 -202.
[23]Lalla E,Papapanou PN.Diabetes mellitus and periodontitis:a tale of two common interrelated diseases[J].Nat Rev Endocrinol,2011,7(12):738 -748.
[24]Su Y,Wang D,Xuan D,et al.Periodontitis as a novel contributor of adipose tissue inflammation promotes insulin resistance in a rat model[J].J Periodontol,2013,84(11):1617 - 1626.
[25]Watanabe K,Petro BJ,Shlimon AE,et al.Effect of periodontitis on insulin resistance and the onset of type 2 diabetes mellitus in Zucker diabetic fatty rats[J].J Periodontol,2008,79(7):1208-1216.
[26]Han Ms,Jung DY,Morel C et al.JNK expression by macrophages promotes obesity-induced insulin resistance and inflammation[J].Science,2013,339(6116):218 -222.
[27]Zhang J,Gao Z,Yin J,et al.S6K directly phosphorylates IRS-1 on Ser-270 to promote insulin resistance in response to TNF-(alpha)signaling through IKK2[J].J Biol Chem,2008,283(51):35375-35382.
[28]Repeke CE,Cardoso CR,Claudino M,et al.Non-inflammatory destructive periodontal disease:a clinical,microbiological,immunological and genetic investigation[J].J Appl Oral Sci,2012,20(1):113-121.
[29]Engebretson SP,Hyman LG,Michalowicz BS et al.The effect of nonsurgical periodontal therapy on hemoglobin A1c levels in persons with type 2 diabetes and chronic periodontitis:a randomized clinical trial[J].JAMA,2013,310(23):2523 -2532.
[30]Gorska R,Gregorek H,Kowalski J,et al.Relationship between clinical parameters and cytokine profiles in inflamed gingival tissue and serum samples from patients with chronic periodontitis[J].J Clin Periodontol,2003,30(12):1046-1052.

