奥硝唑羧甲基壳聚糖配合基础治疗对牙周炎疗效的影响
唐 涛,李若萱,李 敏,谢 彤,张美凤
(1.清华大学医院口腔科,北京 100084;2.安贞医院口腔科,北京 100029)
慢性牙周炎的发生发展与龈下菌斑中微生物的含量、种类、构成都密切相关[1]。传统的洁治、龈下刮治等方法虽能清除龈下菌斑,但对牙周袋内的炎症控制有其局限性,不能终止菌斑内致病微生物及其毒性产物的作用。由于全身使用抗生素易出现耐药和药物不良反应,现代牙周病治疗推崇牙周袋局部用药的给药方式。羧甲基壳聚糖作为药物载体注入到牙周袋内,药物从羧甲基壳聚糖载体中完全释放的时间应接近于羧甲基壳聚糖载体在牙周袋内降解的时间[2],从而发挥缓释作用,具有开发前景。本试验将奥硝唑羧甲基壳聚糖溶胶注入牙周袋后观察主要牙周临床指标及龈下菌斑微生物学指标的变化,评价奥硝唑羧甲基壳聚糖溶胶在牙周炎辅助治疗中作用。
1 临床资料和方法
1.1 奥硝唑羧甲基壳聚糖溶胶的制备
在净化台中称取羧甲基壳聚糖600 mg经Co60消毒后完全溶于30 mL灭菌蒸馏水中,再将奥硝唑450 mg充分溶解处理后,即得含15 g/L奥硝唑与20 g/L羧甲基壳聚糖的奥硝唑羧甲基壳聚糖溶胶。该溶胶呈淡黄透明胶状,置于棕色容器密闭,4℃保存。
1.2 临床资料
选择2011-03—2012-03收治的慢性牙周炎患者65例,纳入标准:①3个月内未经牙周治疗且无应用抗生素及避孕药物史;②无全身性疾病,妇女无妊娠;③口腔存留牙>20个,且至少有2个重度牙周袋并独立分布于2个不同的象限作为受检位点,牙周袋深度(PD)≥4 mm,探诊出血(BOP)为阳性。最终纳入35~55岁慢性牙周炎患者59例,随机分为两组,试验组28例,受检位点共56个;其中男18人,女10人,采用奥硝唑羧甲基壳聚糖加基础治疗。对照组31例,受检位点共62个;其中男19人,女12人,采用牙周基础治疗。
1.3 方法
59例患者治疗前用牙周探针采用6点法分别检查颊或舌侧近中、正中、远中6个位点。基础治疗(龈上洁治和龈下刮治根面平整)后,对照组牙周袋内不放药;试验组牙周袋注入奥硝唑羧甲基壳聚糖溶胶,每次从袋底开始注入,以注满牙周袋为准(0.1~0.3 mL),每7 d复诊放药1次,共4次。分别在治疗基线(0 d)后,于7、14、2128 d分别进行4次复诊注药。
1.4 临床检查和评价
0、7、14、21、28 d 时进行临床指标检查,采集各受检位点龈下菌斑,记录菌斑指数(PLI)、出血指数(BI)、探诊深度(PD)、附着丧失(AL)。为防止临床检查对标本采集的影响,临床指标的检测与处理均在龈下菌斑采集后完成。
1.5 实验室指标
1.5.1 龈下菌斑胰蛋白酶样酶(OD)测定
龈下菌斑标本充分溶于200 μL生理盐水中,置于震荡器震荡30 s备用。为避免菌斑标本之间的相互干扰,每个牙周位点更换一个无菌小环采集标本。用苯甲酰精氨酸萘酰胺水解试验(BANA试验)检测龈下菌斑胰蛋白酶样酶,BANA工作液的配制∶44 mg BANA(批号:31K1145,Sigma公司)溶于1 mL二甲亚砜中,配置成100 mmol/L贮存液,4℃保存。使用前用pH 8.5,15 mmol/L TBS缓冲液1∶100稀释成1 mmol/L的BANA工作液。取1 mmol的BANA 100 μL加入酶联反应板孔内,然后加入100 μL待检菌斑标本,37℃孵育过夜。次日酶联反应板孔内加入0.25%坚牢黑K盐(Fast Black K,批号:61K2512,Sigma公司)50 μL 呈色,37℃,5 min后观测结果。各孔内的反应结果经ELISA酶联免疫检测仪测定600 nm波长下的光密度值(OD)。
1.5.2 螺旋体数目(S%)
临床所取龈下菌斑立即在滴有2%刚果红液的干净载玻片上混合均匀,并涂布成薄层,自然干燥,在盛有浓盐酸的广口瓶上熏涂片约1 mm至深蓝色后,在光学显微镜油镜(×10000)下观察,随机记数200个微生物,按形态记数螺旋体数目(S%)。
1.6 临床疗效
①痊愈:症状基本消失,检测指标恢复正常;②显效:症状基本消失,BI减少>2级,PD减少>1 mm;牙齿松动度明显改善;③有效:BI减少>l级,PD减少>0.5 mm;牙齿松动度稍有改善;④无效:临床各项指标均无改善,症状无任何缓解。
1.7 统计分析
使用SPSS 11.0统计软件进行统计分析。两组实验前后的临床指标用方差分析。计量数据用()表示,经成组资料的t检验;等级资料(PLI、BI)选用M(QR)方式进行描述(M为中位数,QR表示四分位数间距),组间疗效比较均应用秩和检验。检验水准α=0.05。
2 结果(表1~2)
表1 治疗前后各时间点受检位点(共118个)临床指标()

表1 治疗前后各时间点受检位点(共118个)临床指标()
a.与0 d试验组比较P<0.05;b.与0 d对照组比较P<0.05;c.28 d时与对照组比较P<0.05
0 d 试验组 4.48 ±0.360 4.14 ±0.930 5.80 ±0.830 6.23 ±1.490 25.20 ±7.951 0.411 ±0.246对照组 4.20 ±0.380 4.48 ±0.380 5.74 ±0.930 6.52 ±1.010 23.72 ±8.033 0.465 ±0.4367 d 试验组 1.88 ±0.130a 2.21 ±0.204a 5.81 ±0.503 6.25 ±0.135 10.02 ±8.325a 0.204 ±0.324a对照组 2.54 ±0.520b 2.54 ±0.371b 5.76 ±0.431 6.54 ±0.108 14.56 ±5.897b 0.295 ±0.265b 14d 试验组 1.24 ±8.650a 1.52 ±0.871a 5.80 ±0.421 6.23 ±0.253 6.82 ±2.467a 0.175 ±0.116a对照组 1.24 ±9.033b 1.72 ±0.561b 5.74 ±0.123 6.51 ±0.114 12.08 ±3.981b 0.271 ±0.323b 21 d 试验组 0.76 ±9.071a 0.82 ±4.389a 5.83 ±3.162 6.00 ±0.012 4.59 ±4.768a 0.121 ±0.052a对照组 0.92 ±6.490b 1.12 ±5.980b 5.61 ±6.421 6.50 ±0.109 8.34 ±2.324b 0.209 ±0.125b 28 d 试验组 0.00 ±0.000a 0.08 ±0.020ac 5.78 ±0.863 5.99 ±1.529 2.27 ±1.920ac 0.032 ±0.040ac对照组 0.00 ±0.000b 0.96 ±0.040b 5.52 ±0.740 6.50 ±0.991 4.86 ±1.875b 0.182 ±0.037b
治疗前两组指标(PLI、BI、PD、AL、OD、S%)差异无统计学意义(P>0.05),说明各观测指标均具有较好的均衡性。
在7、14、21 d时间点,与基线相比,两组除PD、AL指标差异无统计学意义外(P>0.05),其他各项指标较基线有显著差异(P<0.05);28 d时两组相比,PLI、PD和AL差异无统计学意义(P>0.05)。两组相比BI、S%和OD值差异有统计学意义(P<0.05)。奥硝唑羧甲基壳聚糖组在降低PLI、BI的程度、减少龈下菌斑螺旋体数量S%和OD值方面均明显优于对照组(P<0.05)(图1~4)。

表2 两组术后28 d疗效评定 (n,%)
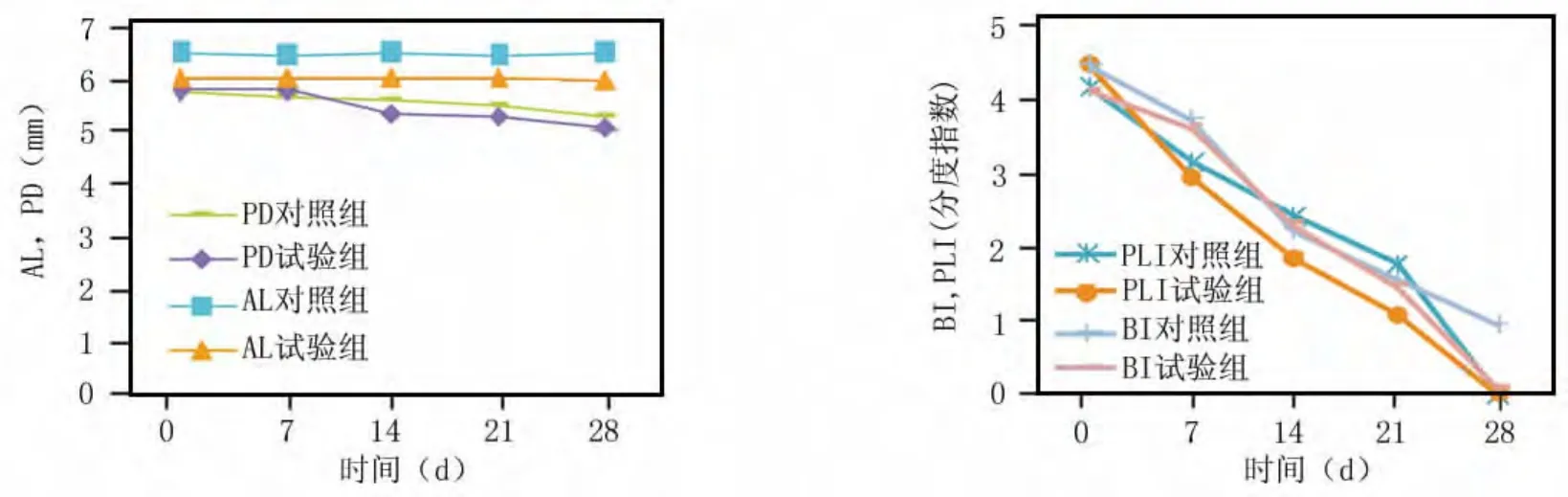
图1 两组临床指标AL,PD,BI,PLI在0~28 d的变化
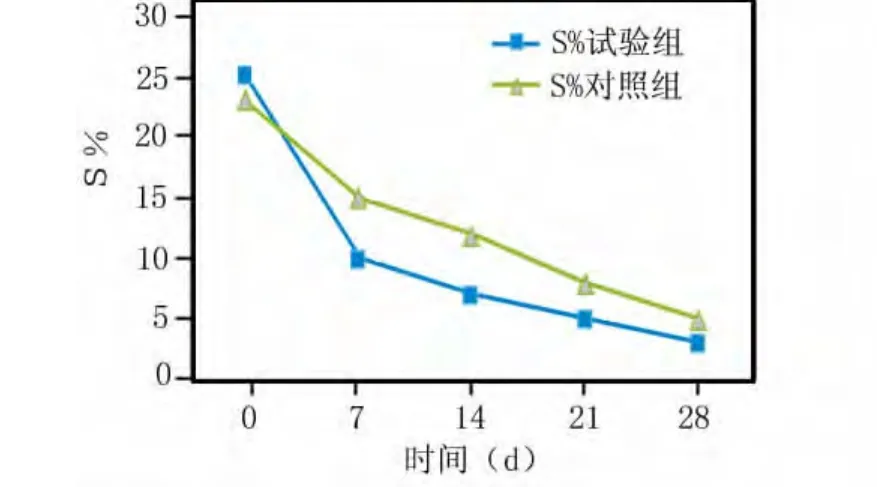
图2 两组S%在0~28 d的变化
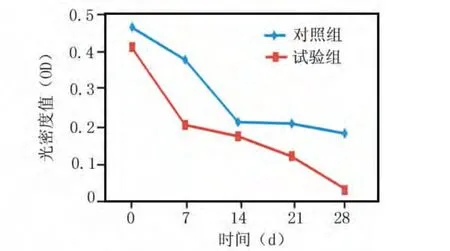
图3 两组OD值在0~28 d的变化
3 讨论
龈下菌斑中细菌及其产物与牙周组织的破坏关系密切,牙周炎的单纯机械治疗协同抗菌药物能有效抑制和杀灭牙周病原菌。与全身应用抗生素相比,局部用药治疗牙周炎效果更好,为使抗菌药物在牙周袋内保持适宜浓度,并维持足够长的时间,有必要采用局部缓释系统,以控制药物浓度的降低[3]。羧甲基壳聚糖具有良好的生物相容性、降解性和细胞黏附性,且无毒、无免疫原性、高安全性,是良好的药物载体,对临床上一些特殊牙周炎的治疗起到很好的辅助作用[4]。Tarsi等[5]发现,壳聚糖在口腔黏膜的附着时间可大于4 d。奥硝唑是一种窄谱抗菌素[6],有效杀灭专性厌氧菌,而专性厌氧菌是慢性牙周炎发病初期和进展期中主要病原体。本药物治疗方案与耿素芳等研究“盐酸米诺四环素软膏对龈沟液中胶原酶的影响”[7]相一致,即用药方法注满受试牙牙周袋,1次/周,共4次。奥硝唑用药时间较长可能引致菌群失调,本实验未做设置监测耐药菌株的指标,有待进一步研究。
有研究表明,慢性牙周炎患者的绝大部分位点,通过机械治疗和定期维护可处于静止状态,因为牙周机械治疗后牙周炎位点和健康位点龈上、龈下菌群中各种细菌的数量都明显下降[8],临床症状明显好转,牙周临床指标均有不同程度下降。本结果显示,试验组和对照组除 PD、AL外,PLI、BI、S%、OD 值均在治疗后的 7、14、21、28 d 比牙周基础治疗(0 d)降低,差异有统计学意义(P <0.05)。与周婷等报道基本一致[9]。
大量试验表明,牙周洁治和龈下刮治后数分钟到数10 d牙周袋内即有残余细菌的再定植和繁殖,所以如不继续干预,在治疗后数周内细菌又可达到治疗前的有害水平[10]。Loesche的研究表明健康龈下螺旋体不超过1.8%,在深牙周袋中螺旋体和G-杆菌比例增加,螺旋体可高达近40%。螺旋体为G-菌,常与牙龈卟啉单胞菌、梭形杆菌等厌氧菌呈现混合感染,多在深牙周袋检出[11]。奥硝唑羧甲基壳聚糖联合应用抑菌性能增强并有缓释作用,对口腔重要厌氧菌具有较明显的抑菌作用和良好的生物相容性[12]。刮治后牙周袋内注入奥硝唑羧甲基壳聚糖溶胶,维持袋内有效药物浓度,发挥其较强的杀灭厌氧菌的功效[13]。本结果显示,S%在7 d试验组与对照组均下降最快,之后平稳下降。在7、14、21 d试验组和对照组各项牙周指标比较差异无显著性(P>0.05);而在28 d,BI、S%和OD值差异有显著性(P<0.05),表明随着细菌的继续定殖,奥硝唑的优势显现出来。
BANA试验OD值作为牙周炎辅助诊治的客观指标之一[14],具有简便、快捷、敏感、特异性强等优点,在确立牙周炎的严重程度和疗效观察,指导临床用药上有其重要意义。BANA试验是利用与牙周炎密切相关的病源微生物[牙龈卟啉单胞菌、齿密螺旋体、福塞氏类杆菌等能产生胰蛋白酶样酶(TLE),可使人工合成的酶底物—苯甲酰精氨酸萘酰胺(BANA)水解]建立的快速检测这些细菌的方法。TLE的监测有助于了解牙周病变的程度[15],随着牙周龈下病源微生物量的增加,TLE活性的增强,临床检查的各指数均呈明显的上升趋势[16]。TLE具有蛋白水解酶和对成纤维细胞的抑制作用,对局部组织不断溶解、破坏导致血管通透性的增加,影响牙周袋上皮的完整性、连续性,是牙周组织破坏的重要因素之一[17]。本结果显示,在牙周上药14 d前OD值两组下降一致,28 d时试验组OD值下降较对照组快,说明奥硝唑羧甲基壳聚糖溶胶配合基础治疗,OD值明显减少龈下菌斑TLE水平优先于对照组。
PD、AL可客观反映牙周组织破坏程度,本试验PD、AL在均值上略有改变,但无显著性,可能是由于牙周袋和附着水平在28 d短时间内变化不大所导致。
本结果证实了慢性牙周炎是一种由多种致病菌引起的慢性感染性疾病,用药后28 d试验组较对照组牙周临床指标有明显改善,但龈下菌斑中牙周致病菌却有反弹,用药后BANA试验OD值改变显著,因此,龈下致病菌TLE水平量的变化早于临床指标的变化。提示BANA试验OD值可以作为反映牙周治疗效果的指标,刮治后注入奥硝唑羧甲基壳聚糖溶胶较基础治疗在控制龈下菌斑有害微生物的作用更具优势。
[1]Pérez-Chaparro PJ,Gracieux P,Lafaurie GI,et al.Genotypic characterization of Porphyromonas gingivalis isolated from subgingival plaque and blood sample inpositive bacteremia subjects with periodontitis[J].J Clin Periodontol,2008,35(9):748 -753.
[2]曹文帅,邓婧,徐全臣.几种常见牙周致病菌对羧甲基壳聚糖的降解效应[J].中国组织工程研究,2013,17(34):6152-6158.
[3]王聃,邓嘉胤.牙周局部缓释型制剂的研究现状及应用进展[J].中国组织工程研究与临床康复,2010,(14)8:1437-1441.
[4]Yilmaz S,Kut B,Gursoy H,et al.Er:YAG laser versus systemic met-ronidazole as an adjunct to nonsurgical periodontal therapy:a clini- cal and microbiological study[J].Photomed Laser Surg,2012,30(6):325-330.
[5]Tarsi R,Corbin B,Pruzzo C,et al.Effect of low - molcμlarweight chitosans on the adhesive properties of oral streptococci[J].Oral Microbiol Immunol,1998 ,13(4)217 -222.
[6]Silva MP,Feres M,Sirotto TA,et al.Clinical and microbiological benefits of metronidazole alone or with amoxicillin as adjuncts in the treatment of chronic periodontitis:a randomized placebocontrolled clinical trial[J].J Clin Periodontol,2011,38(9):828-837.
[7]耿素芳,曹采方,陈智滨,等.盐酸米诺四环素软膏对龈沟液中胶原酶的影响[J].中华口腔医学杂志,2000,35(5):336-339.
[8]Dougudomdacha S,Rawlinson A,Walsh TF,et al.Effect of non2s urgical periodontal treatment on clinical parameters and the num2b ers of Porphyrom onas gingivalis,Prevotella interm edia,Actinoba2c illus actinom ycetem com itans at adult periodontitis sites[J].J Clin Periodontol,2001,28(5):437 -445.
[9]周婷,谢萍,徐屹,等.牙周基础治疗对慢性牙周炎患者临床指标及5种牙周可疑致病微生物的影响[J].口腔医学研究,2012,28(1):39-42.
[10]孟焕新.牙周病学[M].北京:人民出版社,2001:213-218.
[11]Loesche WJ,Grossman N,Giordno J,et al.Meriodontitis(IV).The effect of patient compliance on treatment parameters[J].J Clin Periodontol,1993,20(2):96 -104.
[12]徐全臣,王志国,邓婧,等.奥硝唑缓释生物学性能的初步观察[J].中国海洋生物学,2009,12,(6):451 -452.
[13]张国栋,刘鲁川,刘娜,等.复方奥硝唑甲磺酸培氟沙星缓释牙栓对大鼠龈沟液中天冬氨酸转氨酶水平的影响[J].口腔医学研究,2008,24(1):36-38.
[14]闫文娟,薛毅,李向飞,等.改良固相BANA试验方法的建立[J].牙体牙髓牙周病学杂志,2007,17(7):394-397.
[15]Morita M,Wang HL.Relationship between sulcular sulfide level and oral malodor in subjects with periodontal disease[J].J Periodontol,2001,72(1):79 -84.
[16]王丽,吴亚菲,杨禾,等.不同采样方法对龈下牙周致病菌检出的比较研究[J].牙体牙髓牙周病学杂志,2009,19(1):29 -31.
[17]Eckley B,Thomas J,Crout R,et al.Periodontal and microbiological status of patients undergoing orthodontic therapy[J].J Hong Kong Dent,2012,9:11 -20.

