芹菜素对变异链球菌致龋力影响的实验研究
李蓓蕾,岳阳丽,刘 瑶,刘学军
(郑州大学口腔医学院,河南郑州 450052)
芹菜素(apigenin)又称 5,7,4'- 三羟基黄酮,分子式为C15Hl0O6,不溶于水,易溶于乙醇、二甲基亚砜,是一种广泛存在于蔬菜和水果中的天然黄酮类化合物;芹菜素具有抗肿瘤、抗炎、抗氧化、降血压、抗动脉硬化、抗焦虑、保护中枢神经系统等药理作用[1-2]。近年来关于芹菜素在龋病预防方面的作用也逐渐引起了人们的关注。Koo H等[3]研究发现,芹菜素可显著抑制变异链球菌(Streptococcus mutans,S.mutans)gtfB 和 gtfC mRNA 的表达,同时还能抑制GTF B、GTF C的活性和胞外多糖的生成。本实验通过观察芹菜素对S.mutans的生长、粘附、产酸以及葡聚糖转移酶(GTF)的活性和水不溶性胞外多糖的生成等多个致龋毒力因子的影响,进一步探讨其抗龋机制,为芹菜素这一天然化合物用于龋病预防提供实验室依据。
1 材料和方法
1.1 实验菌株和主要试剂
变异链球菌ATCC 25175(血清型C,购自四川大学口腔生物医学实验室);芹菜素(西安飞达生物技术有限公司);TPY琼脂培养基、TPY液体培养基(北京陆桥技术有限责任公司);无菌脱纤维蛋白血(郑州宝赛生物技术公司);无水乙醇、蒽酮、固体硫酸铵、EDTA、葡聚糖(天津科密欧化学试剂开发中心)。
1.2 方法
1.2.1 细菌培养和菌悬液制备
取S.mutans ATCC25175菌株,常规复苏48 h后接种于TPY液体培养基,并置于37℃培养箱中厌氧(800 mL/L N2、100 mL/L H2、100 mL/L CO2)条件下进行培养。培养24 h后离心收集细菌,并用无菌生理盐水重悬制成菌悬液;然后用紫外分光光度计调整540 nm波长处的吸光度值(OD)为1.0,用于以下实验。
1.2.2 含不同浓度芹菜素培养基的制备
取一定量的芹菜素溶解于无水乙醇中,然后再用含20 g/L蔗糖的TPY液体培养基以二倍稀释法制成含芹菜素浓度分别为 400、200、100、50、25、12.5 μg/mL的含药培养基;同时配制含相同体积无水乙醇而不含芹菜素的培养基用于溶剂对照。
1.2.3 芹菜素对S.mutans生长影响的观察
取S.mutans菌悬液均匀涂布于TPY琼脂培养板,并在其表面分别放置浸有不同浓度芹菜素的含药培养基(实验组)、1.6 mg/mL氯已定溶液(阳性对照组)、含无水乙醇不含芹菜素的TPY培养基(溶剂对照组)、单纯TPY培养基(空白对照组)的圆形纸片;然后一并置于37℃培养箱中厌氧培养,24 h后取出,分别测量各组抑菌环的直径。每组重复3次取均值。
1.2.4 芹菜素对S.mutans产酸能力影响的观察
取S.mutans菌悬液0.1 mL分别接种于1 mL含药培养基、溶剂对照培养基、单纯TPY培养基(空白对照);充分混匀并调整pH值为7.0后,置37℃培养箱中厌氧培养。培养48 h后,收集各组培养液并离心取上清;然后用数字酸度计测定各组上清液的pH值,并计算培养前后pH值的变化量(ΔpH),ΔpH=初始pH值-终末pH值。每组重复测量3次,取均值。
1.2.5 芹菜素对S.mutans粘附能力影响的观察取S.mutans菌悬液按1.2.4相同的方法分别接种于各含药培养基和对照培养基;然后将各组试管与地平面呈30°置于37℃培养箱中,厌氧培养48 h后,收集各组粘附于试管壁上的细菌,测OD450nm,并按以下公式计算粘附抑制率。

1.2.6 芹菜素对S.mutans GTF活性影响的观察
取S.mutans菌悬液按1.2.4相同的方法分别接种于各含药培养基和对照培养基;37℃厌氧培养24 h后,收集各组培养液并离心取上清;然后参照文献[4]报道的方法提取GTF粗酶,采用考马斯亮蓝法测定其总蛋白含量后,再用Somogyi法测定各组酶-底物反应液中的还原糖量,并计算GTF的活力单位(IU)及其比活力。
1.2.7 芹菜素对S.mutans生成水不溶性胞外多糖影响的观察
取1.2.6离心后保留的各组细菌沉淀物,用5 mL蒸馏水洗涤、离心2次后加入0.5 mol/L氢氧化钠溶液洗涤、离心3次;合并上清液并用蒽酮法测定各组胞外水不溶性葡聚糖的含量[4]。
1.3 统计学分析
2 结果
2.1 不同浓度芹菜素对S.mutans生长的影响
12.5~400 μg/mL 不同浓度芹菜素对 S.mutans的生长均无抑制作用,与空白对照组相比无显著性差异(P>0.05);而阳性对照组(氯已定组)则有明显的抑菌环产生,其直径达16.7 mm(表1)。
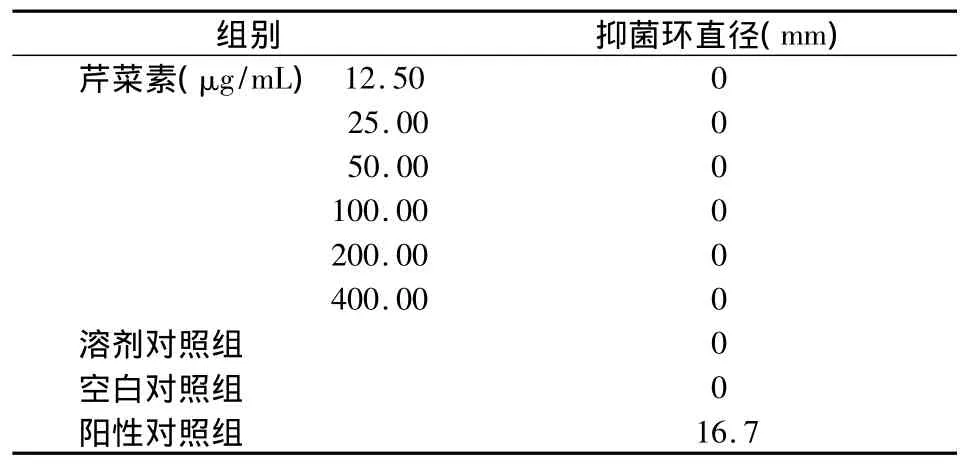
表1 各组抑菌环直径比较
2.2 不同浓度芹菜素对S.mutans产酸能力的影响
12.5~400 μg/mL 不同浓度芹菜素与 S.mutans共同培养48 h后,其培养上清液的pH值均较初始pH值明显下降;各实验组的△pH下降量,与空白对照组和溶剂对照组相比,差异均无统计学意义(P>0.05),两对照组间也无统计学差异(P >0.05)(表2)。
表2 培养前后各组培养上清△pH比较()
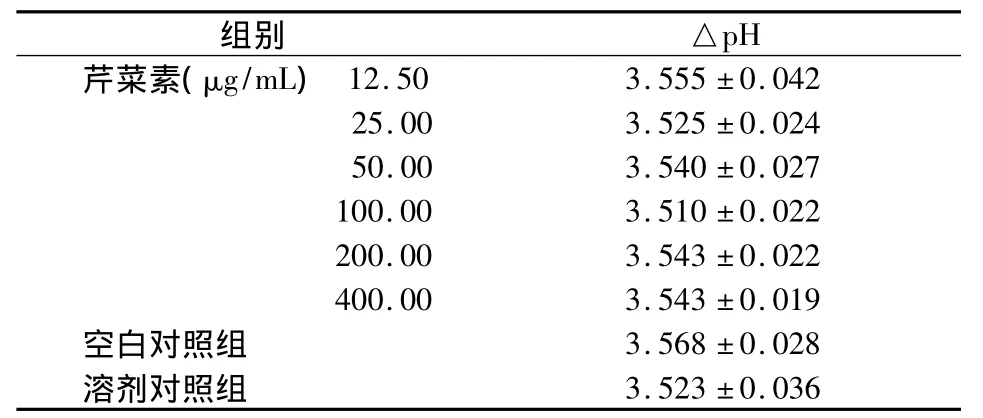
表2 培养前后各组培养上清△pH比较()
各组间两两相比均无统计学差异(P>0.05)
pH芹菜素(μg/mL)组别 △12.50 3.555 ±0.04225.00 3.525 ±0.02450.00 3.540 ±0.027100.00 3.510 ±0.022200.00 3.543 ±0.022400.00 3.543 ±0.019空白对照组 3.568 ±0.028溶剂对照组3.523 ±0.036
2.3 不同浓度芹菜素对S.mutans粘附能力的影响
12.5~400 μg/mL 芹菜素与 S.mutans共同培养48 h后,与空白对照组和溶剂对照组相比,除12.5 μg/mL组无统计学差异(P >0.05)外,其他各浓度组的细菌粘附量均明显下降(P<0.05),且随着芹菜素浓度的升高,其粘附量越来越少,各浓度芹菜素组间两两相比,差异均有统计学意义(P<0.05);而两对照组间差异无统计学意义(P >0.05)(表3)。
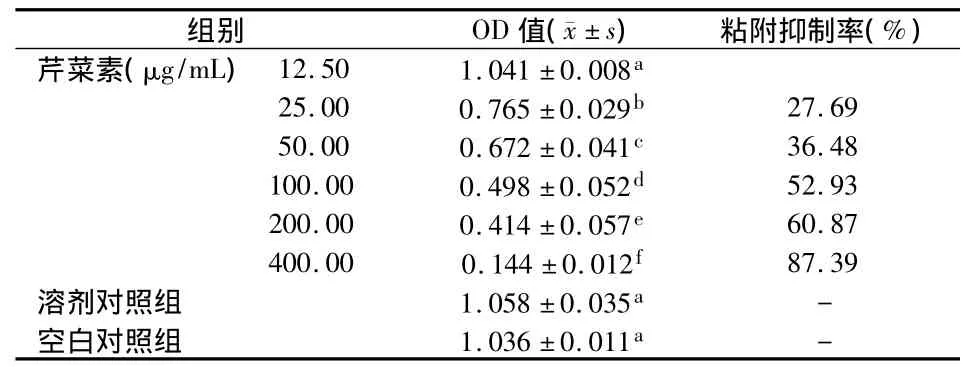
表3 各组细菌粘附量(OD值)及其粘附抑制率比较
2.4 不同浓度芹菜素对S.mutans GTF活性的影响
12.5~400 μg/mL 不同浓度芹菜素与 S.mutans共同培养24 h后,Somogyi法检测结果显示:各浓度芹菜素组的还原糖量、GTG酶活力以及酶比活力均明显低于溶剂对照组和空白对照组(P<0.05),且随着芹菜素浓度的增加,其还原糖量、酶活力以及酶的比活力均逐渐降低;各浓度芹菜素组间各指标两两相比,除200 μg/mL组与400 μg/mL组无统计学差异(P >0.05)外,其他各浓度组间差异均有统计学意义(P<0.05)(表4)。
表4 不同浓度芹菜素对S.mutans GTF活性的影响()
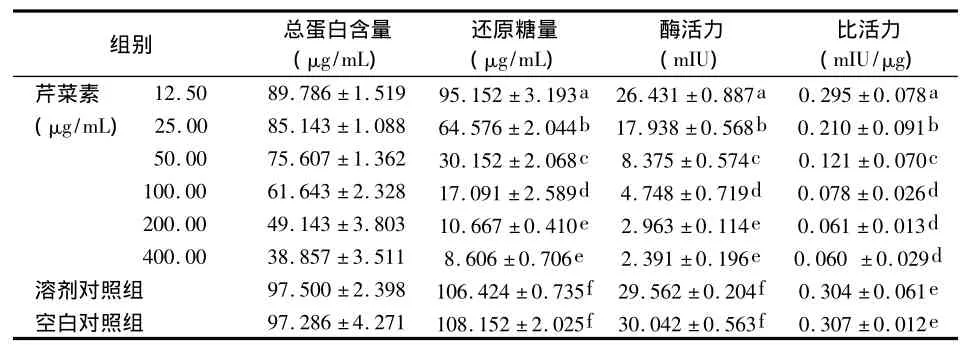
表4 不同浓度芹菜素对S.mutans GTF活性的影响()
不同字母组间P<0.05
组别 总蛋白含量(μg/mL)还原糖量(μg/mL)酶活力(mIU)比活力(mIU/μg)芹菜素 12.50 89.786 ±1.519 95.152 ±3.193a 26.431 ±0.887a 0.295 ±0.078a(μg/mL) 25.00 85.143 ±1.088 64.576 ±2.044b 17.938 ±0.568b 0.210 ±0.091b 50.00 75.607 ±1.362 30.152 ±2.068c 8.375 ±0.574c 0.121 ±0.070c 100.00 61.643 ±2.328 17.091 ±2.589d 4.748 ±0.719d 0.078 ±0.026d 200.00 49.143 ±3.803 10.667 ±0.410e 2.963 ±0.114e 0.061 ±0.013d 400.00 38.857 ±3.511 8.606 ±0.706e 2.391 ±0.196e 0.060 ±0.029d溶剂对照组 97.500 ±2.398 106.424 ±0.735f 29.562 ±0.204f 0.304 ±0.061e空白对照组 97.286 ±4.271 108.152 ±2.025f 30.042 ±0.563f 0.307 ±0.012e
2.5 不同浓度芹菜素对S.mutans生成水不溶性胞外多糖含量的影响
12.5~400 μg/mL 芹菜素与 S.mutans共同培养24 h后,与空白对照组和溶剂对照组相比,除12.5 g/mL组无统计学差异(P >0.05)外,其他各浓度组的水不溶性多糖的含量均明显降低(P<0.05),且随着芹菜素浓度降低的程度越来越大;各浓度组间两两相比,除 200 μg/mL组与400 μg/mL组间无统计学差异(P >0.05)外,其他各浓度组间水不溶性胞外多糖含量的差异均有统计学意义(P<0.05);空白对照组与溶剂对照组相比,差异无统计学意义(P>0.05)。不同浓度芹菜素组的GTF酶活性与水不溶性胞外多糖含量之间呈显著正相关(r=0.935,P <0.05)(表5)。
表5 各组水不溶性胞外多糖含量的比较()
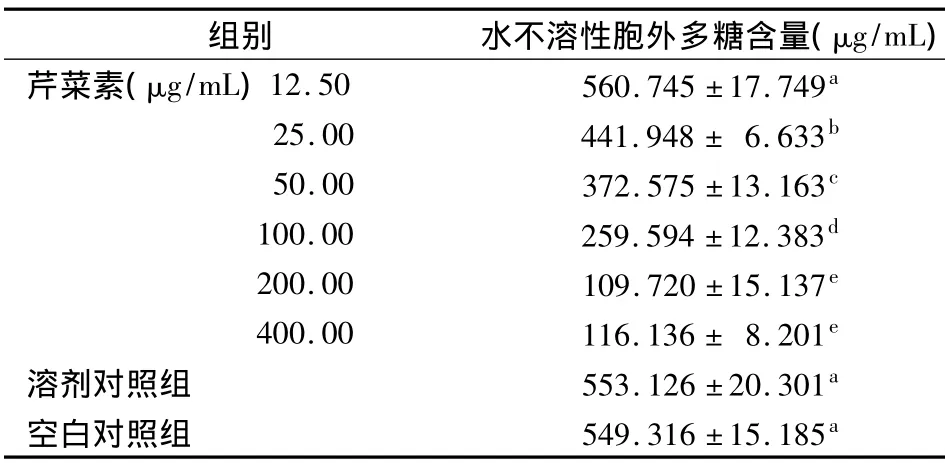
表5 各组水不溶性胞外多糖含量的比较()
不同字母组间P<0.05
组别 水不溶性胞外多糖含量(μg/mL芹菜素(μg/mL)12.50 560.745 ±17.749a 25.00 441.948 ± 6.633b 50.00 372.575 ±13.163c 100.00 259.594 ±12.383d 200.00 109.720 ±15.137e 400.00 116.136 ± 8.201e溶剂对照组 553.126 ±20.301a空白对照组 549.316 ±15.185a
3 讨论
芹菜素是天然存在的一种黄酮类化合物,化学结构式如图1所示:其中5、7、4'位的3个羟基及C2C3双键决定了其独特的理化性质和生物学作用。
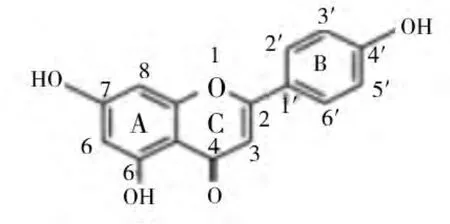
图1 芹菜素的化学结构式
本结果显示,12.5 ~400 μg/mL 浓度范围的芹菜素对变链菌在TPY琼脂平板上的生长均无抑菌作用,说明芹菜素作为防龋药物不会因为抑制菌斑中S.mutans的生长而破坏微生物的平衡。
S.mutans的致龋毒力因子主要包括对牙面的粘附、产酸、生成 GTF和水不溶性胞外多糖。S.mutans在成熟菌斑深层的缺氧环境中主要通过糖酵解途径分解糖而代谢产酸,从而使局部pH值下降,造成牙体硬组织酸蚀脱矿、有机物分解,最终导致龋病的形成和进一步发展。本实验使用数字酸度计测定芹菜素与S.mutans共同培养后的pH值变化发现,12.5~400 μg/mL不同浓度的芹菜素对S.mutans培养上清液的pH下降均无明显影响,提示芹菜素不能抑制S.mutans的产酸。
S.mutans在牙面上粘附和定植是致龋的始动因子。本结果显示,除12.50 μg/mL浓度的芹菜素对S.mutans的粘附无抑制作用外,其他各浓度组均能明显抑制S.mutans的粘附能力;且其抑制作用随着芹菜素浓度的增加而明显增强,400 μg/mL组的粘附抑制率可达87.39%,提示芹菜素能有效抑制S.mutans的粘附能力。进一步实验还发现,随着芹菜素浓度的升高,S.mutans的GTF活性及其所生成的水不溶性胞外多糖含量均呈下降的趋势;Pearson相关性分析显示,不同浓度芹菜素组的GTF酶活性与水不溶性胞外多糖含量之间呈显著正相关(r=0.935,P <0.05)。提示,芹菜素不仅能有效抑制S.mutansGTF的活性,同时还可有效抑制S.mutans合成水不溶性胞外多糖的能力。但是,当芹菜素浓度达到200 μg/mL时,其对GTF和水不溶性胞外多糖的抑制作用不再随着芹菜素浓度的进一步升高而显著增强。
S.mutans的粘附经历两个阶段。首先是非蔗糖依赖的初始粘附,该阶段中S.mutans对牙面的粘附具有选择性;且与其胞壁中的磷脂壁酸和表面蛋白密切相关。脂磷壁酸是GTF在S.mutans细胞表面的受体,能促进GTF结合到细胞表面,从而调节其对牙面的粘附;表面蛋白P1是较肯定的S.mutans黏结素,能与获得性膜中受体成分发生特异性结合。推测芹菜素抑制S.mutans粘附能力的机制可能是其与S.mutans竞争性结合胞壁表面的受体和获得性膜中受体成分,从而抑制S.mutans的初始粘附。S.mutans粘附的第二阶段是蔗糖依赖性粘附,即S.mutans生成的GTF利用蔗糖合成水不溶性胞外多糖来介导该菌的蔗糖依赖性粘附、集聚。水不溶性胞外多糖具有很强的粘性和抗水解能力,并且参与菌斑基质的组成;其不仅能构成菌斑的基本骨架结构,同时还能限制菌斑中有机酸的扩散,使菌斑局部pH值下降,从而导致牙釉质脱矿,形成龋损[5]。有研究认为,芹菜素可通过抑制S.mutansgtfs基因的表达、抑制GTF和水不溶性胞外多糖的合成,而影响 S.mutans的粘附[3]。因此,芹菜素对GTF活性的抑制作用有可能是其防龋的主要机制。另外,天冬氨酸(CH2COOH)是GTF上的糖结合活性位点[6],芹菜素可通过其C2C3双键与天冬氨酸(CH2COOH)发生反应,而影响GTF的活性。
综上所述,芹菜素可抑制S.mutans的粘附、GTF活性和水不溶性胞外多糖的产生,具有抗菌斑、预防龋病的潜力;而且不影响S.mutans的生长及其产酸活动,有利于维持牙菌斑中的微生态平衡,有望开发为一种有效的防龋药物。
[1]王海娣,刘艾林,杜冠华.芹菜素药理作用研究进展[J].中国新药杂志,2008,17(18):1561-1565.
[2]Shukla S,Gupta S.Apigenin:a promising molecule for cancer prevention[J].Pharm Res,2010,27(6):962 -978.
[3]Koo H,Seils J,Abranches J,et al.Influence of apigenin on gtf gene expression in Streptococcus mutans UA159[J].Antimicrob Agents Chemother,2006,50(2):542 -546.
[4]程睿波,陈旭,刘淑杰,等.白屈菜红碱对变异链球菌葡糖基转移酶和细胞外水不溶性多糖的影响[J].上海口腔医学,2007,16(3):324-327.
[5]Katsura H,Tsukiyama RI,Suzuki A,et al.In vitro antimicrobial activities of bakuchiol against oral microorganisms[J].Antimicrob Agents Chemother,2001,45(11):3009 -3013.
[6]Devulapalle KS,Mooser G.Glucosyltransferase inactivation reduces dental caries[J].J Dent Res,2001,80(2):466 -469.

