巯基蛋白酶水解对残余蛋白质膜再吸附色素能力的影响
左起亮,张 怡,姚江武
(厦门市口腔医院修复科,福建厦门 361003)
饮茶可导致牙齿表面色素沉积并形成色渍,严重影响牙齿美观。目前对于牙面色渍的清除主要以机械和化学方法为主,但这两种方法均可不同程度地导致牙面受损。因此,探索生物酶技术清除牙面污垢的方法日益受到人们的关注。有研究显示,巯基蛋白酶(cysteine proteases,CPs)能降解唾液膜和蛋白质色渍[1],但其对蛋白质色渍的形成是否有预防作用,目前尚未见相关报道。本实验采用与唾液富脯蛋白(proline-rich proteins,PRPs)结构相近似的去磷酸化牛β-酪蛋白(dephosphorylated bovine β-casein,D β-CN)作为蛋白质模型,以来自茶汤中的茶黄素(theaflavin,TF)作为色素模型[2],并将Dβ-CN/TF复合膜构筑在消散因子石英微天平(quartz crystal microbalance with dissipation,QCM-D)的芯片表面[3];分别用3种 CPs对其进行水解后,测量残余膜厚度及其再吸附TF的质量,考察CPs水解对残余蛋白质/色素复合膜再吸附色素能力的影响。
1 材料和方法
1.1 仪器和试剂
QCM-D、5MHz金石英晶体芯片(Z500,KSV,芬兰);纯度≥98%的TF(Woko,日本);λ-pp蛋白磷酸酶(NEB,英国);Dβ-CN、木瓜蛋白酶、菠萝蛋白酶、无花果蛋白酶(Sigma Aldrich,美国);蛋白磷酸化水平试剂盒和蛋白金属磷酸酶(Thermo,美国);其他试剂如无特别说明均为分析纯。实验用水为Milli-Q超纯水(电阻值18.2 Ω)。
1.2 方法
1.2.1 酶的激活及其活力测定
参照 Vasconcellos等[4]的方法,用5 mmol/L半胱氨酸盐酸盐和2 mmol/L EDTA分别对木瓜、菠萝、无花果蛋白酶进行激活,并测量其酶活性。
1.2.2 Dβ-CN 的制备
30℃条件下,于每10 μmol/L的 Dβ-CN)中加入 50 units λ-PPase、1 × 1 mmol/L MnCl2、1 × 蛋白金属磷酸酶(PMP)反应缓冲液,水浴30 min后即制得 Dβ-CN[5]。
1.2.3 Dβ-CN 单层膜和 Dβ-CN/TF 复合膜的水解以及TF再吸附的观察
通过自组装将Dβ-CN固定到QCM-D金芯片表面(步骤详见参考文献[6]),建立Dβ-CN单层膜;并在此基础上,将12 μmol/L TF溶液以5 μL/s的流速注入QCM-D样品池,建立Dβ-CN/TF复合膜。待吸附曲线平稳后,将木瓜、菠萝、无花果3种CPs溶液分别注入Dβ-CN单层膜和Dβ-CN/TF复合膜的表面,对其进行水解;待频率波动达稳态后,注入12 μmol/L TF溶液;当频率再次达稳定时,采用3倍频归一化法和分析软件(KSV instruments version 3.11)分别记录和计算Dβ-CN单层膜和残余膜的厚度值及其吸附的TF质量。实验重复3次,结果取均数。实验温度为30℃,缓冲体系为离子强度0.01 mol/L、pH 7.0的磷酸钠盐缓冲液。
1.3 统计学分析
2 结果
2.1 3 种 CPs酶活力
木瓜蛋白酶、菠萝蛋白酶和无花果蛋白酶经激活后,其酶活力单位分别为(118.6 ±4.4)unit/mg、(67.3 ±3.6)unit/mg、(139.9 ±5.0)unit/mg。
2.2 水解前后膜厚度和质量的变化曲线
在QCM-D芯片表面注入Dβ-CN后,吸附曲线迅速上升,120 min时达到稳态,表明已形成Dβ-CN单层膜,设其厚度为h0;当在此基础上注入TF时,吸附曲线再次上升,约80 min趋于平稳,注入PBS后曲线走势亦无明显变化,表明已成功建立了稳定的Dβ-CN/TF复合膜,并得出该膜吸附的TF质量(m0)(图1a)。在Dβ-CN/TF复合膜表面分别注入木瓜、菠萝、无花果3种CPs后,其质量和厚度均在20 min内迅速下降;计算达到稳态时的残余复合膜的厚度(h1)后,注入TF溶液,曲线又有所上升,表明吸附有少量TF(m1)(图1b)。在Dβ-CN单模表面注入CPs上述3种CPs后,其质量和厚度的变化趋势与Dβ-CN/TF复合膜相似;计算残余单层膜的厚度并将其设为h2,然后注入TF溶液,并得到TF吸附质量(m2)(图1c)。
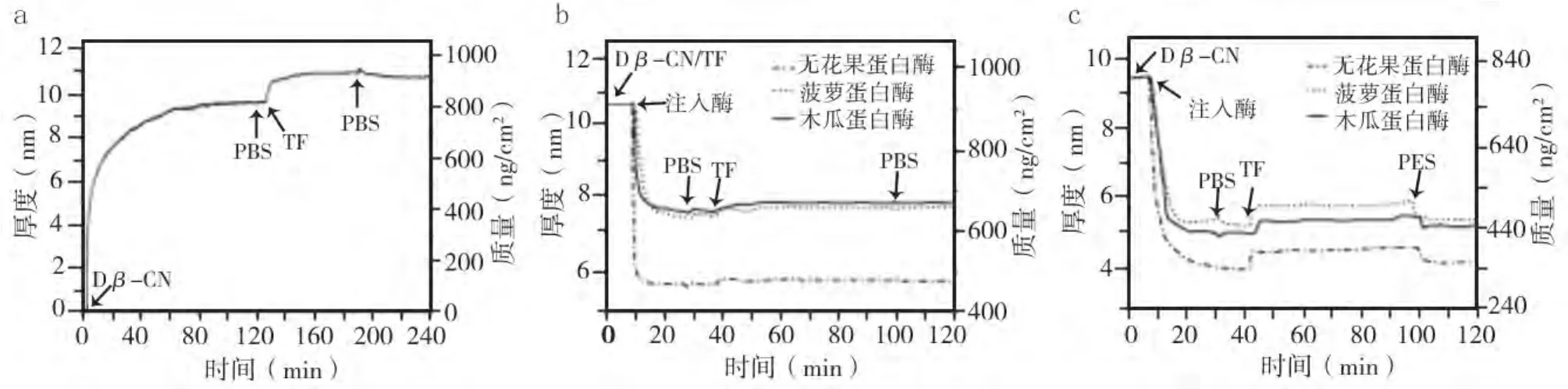
图1 TF吸附于Dβ-CN)单层膜(a)、残余复合膜(b)和残余单层膜(c)的质量与厚度伴随时间变化曲线
2.3 3种CPs水解后膜厚度及其吸附TF质量的比较
Dβ-CN)单膜和Dβ-CN)/TF复合膜经木瓜、菠萝、无花果3种CPs水解后,其厚度均明显下降,其中以Dβ-CN单模下降最明显,即:ho>h1>h2,两两相比差异均有统计学意义(P<0.05);水解后残余膜吸附TF的质量随着膜厚度的下降而减少,即:m0>m1>m2,两两相比均有统计学差异(P<0.05);3种酶水解引起的β-CN/TF复合膜和残余单层膜厚度及TF吸附质量变化均为无花果蛋白酶>木瓜蛋白酶和菠萝蛋白酶(P<0.05);而木瓜蛋白酶与菠萝蛋白酶相比无统计学差异(P >0.05)(表 1)。
表1 CPs水解前后膜的厚度及其吸附TF质量的比较()

表1 CPs水解前后膜的厚度及其吸附TF质量的比较()
字母(横向比)和星号(纵向比)相同者P >0.05,不同者 P <0.05
酶膜厚度(nm)吸附TF质量(ng/cm2)h0 h1 h2m0 m1 m2木瓜蛋白酶 9.4±0.1a 7.2 ±0.0b* 4.9±0.1c* 99±3a 26±1b* 17±1c*菠萝蛋白酶 9.4±0.1a 7.2 ±0.1b* 5.1±0.1c* 99±3a 27±1b* 18±2c*无花果蛋白酶 9.4±0.1a 6.0±0.0b** 4.0±0.1c** 99±3a 17±1b** 11±1c**
2.4 膜厚度与其吸附TF质量的关系
根据最小二乘法原理,采用非线性回归法[7]对数据进行拟合并得拟合曲线(图2)。由图可见膜的厚度与其吸附TF的质量呈非浅性正相关。膜的厚度在4~7 nm时,TF的吸附质量随着膜厚度的增加而缓慢增长;当膜厚度>7 nm时,TF吸附质量的升幅明显加大。
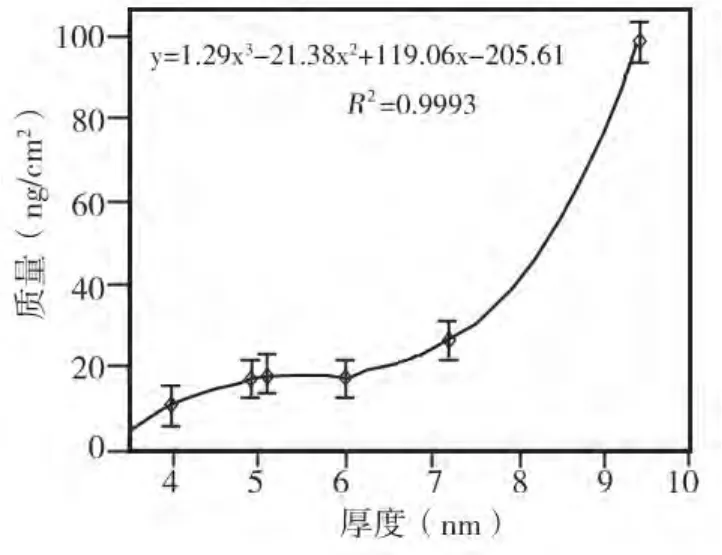
图2 TF吸附质量与膜厚度关系的拟合曲线
3 讨论
唾液富含富脯蛋白(PRPs),在其形成唾液膜后仍保留有能与多酚类物质发生强力结合的特性,从而易导致牙面形成蛋白质色渍。由于唾液中的PRPs纯化困难,而 Dβ-CN与PRPs在结构上有较多的相似点(高含量的脯氨酸、无规卷曲为主体的二级结构以及通过聚乙烯–聚吡咯烷酮环结合多酚色素等)[2],故本实验以来源广泛且纯度较高的Dβ-CN)替代PRPs用于建立体外蛋白质/色素复合模型。
有研究认为,当Dβ-CN固定于芯片表面后,N端位于基底层,富含脯氨酸的C端位于表层[8],蛋白质中大量无规卷曲的二级结构可使较多脯氨酸中的酚式结构充分暴露于溶液环境中[9],并形成疏水袋,从而有利于分子间氢键的形成。当注入TF时,TF中的9个酚式羟基以及苯环结构能促使TF与Dβ-CN发生氢键结合和疏水性结合,从而形成稳定的Dβ-CN/TF复合膜。其中,Dβ-CN的亲水性N端可能具有酶降解的作用,而疏水性C端则拥有大量酶水解位点[3];因此,当CPs作用于Dβ-CN/TF复合膜或Dβ-CN单层膜时,C端中富含的非极性氨基酸和芳香L-氨基酸的肽段就会被酶降解,从而导致疏水腔崩解,并使结合于C端的TF脱落,膜的质量和厚度也会随之下降。此时,由于肽链上可形成氢键的位点明显减少,TF只能依靠彼此间的堆垛来增加质量,并再附着于残余膜表面;但这种结合力较弱,极易被冲洗掉,故残余膜表面TF的吸附质量明显低于水解前的Dβ-CN单层膜。另外,在Dβ-CN)中,由于脯氨酸的数量分布从C端到N端逐渐减少,经CPs水解后,会使大量脯氨酸散失而导致TF吸附量骤减[10];此时的Dβ-CN/TF复合膜和Dβ-CN单层膜表面则会从疏水性转化成亲水性,不仅减少了Dβ-CN上的TF结合位点,还限制了TF吸附的疏水驱动力作用[11]。在本实验所用的3种CPs中,以无花果蛋白酶水解后的残余复合膜和残余单层膜最薄,其再吸附TF的量也最少。此外,Dβ-CN/TF复合膜经3种CPs水解后形成的残余膜厚度值均较Dβ-CN单层膜大,再吸附TF的量也较大;这可能是由于TF在一定程度上抑制了CPs的活性,从而使与TF紧密结合的脯氨酸避开了酶的降解,并成为TF再次吸附的重要位点。
采用非线性回归法拟合曲线对膜厚度与TF吸附质量之间的关系进行分析显示,当膜厚度小于7 nm时,TF的吸附质量随着膜的厚度增加而缓慢增加;当膜厚度大于7 nm时,TF的吸附质量与膜厚度关系曲线呈陡峭上升趋势。提示TF的结合位点和特有的松散结构主要集中于大于7 nm的膜的表层[9],即 Dβ-CN 的 C 端。
综上所述,Dβ-CN/TF复合膜和Dβ-CN)单层膜经巯基蛋白酶水解后,其残余膜再吸附TF的能力明显下降,提示巯基蛋白酶水解具有抑制色素再吸附的作用。
[1]Yao JW,Xiao Y,Lin F,et al.The effect of various pH,ionic strength and temperature on papain hydrolysis of salivary film[J].Eur J Oral Sci,2012,120(2):140-146.
[2]Jöbstl E,O'connell J,Fairclough JPA,et al.Molecular model for astringency produced by polyphenol/protein interactions[J].Biomacromolecules,2004,5(3):942-949.
[3]Yao JW,Lin CJ,Tao T,et al.The effect of various concentrations of papain on the properties and hydrolytic rates of β-casein layers[J].Colloids Surf B Biointerfaces,2013,101(1):272-279.
[4]Vasconcellos FC,Goulart GAS,Beppu MM.Production and characterization of chitosan microparticles containing papain for controlled release applications[J].Powder Technology,2011,205(1-3):65-70.
[5]Zhuo S,Clemens JC,Hakes DJ,et al.Expression,purification,crystallization,and biochemical characterization of a recombinant protein phosphate[J].J Biol Chem,1993:17754-17761.
[6]林锋,姚江武.pH值、温度和离子强度对色素与人类唾液相互作用的影响[J].牙体牙髓牙周病学杂志,2012,22(2):99-102.
[7]Machado JAT,Baleanu D,Luo ACJ.Nonlinear and complex dynamics applications in physical,biological,and financial systems[M].Berlin:Springer,2011:97-106.
[8]Huenerbein A,Schmelzer CE,Neubert RH.Real-time monitoring of peptic and tryptic digestions of bovine β-casein using quartz crystal microbalance[J].Anal Chim Acta,2007,584(1):72-77.
[9]Farrell HM Jr,Qi PX,Wickham ED,et al.Secondary structural studies of bovine caseins:structure and temperature dependence of β-casein phosphopeptide(1-25)as analyzed by Circular Dichroism,FTIR Spectroscopy,and Analytical Ultracentrifugation[J].J Protein Chem,2002,21(5):307-321.
[10]Gosalia DN,Salisbury CM,Ellman JA,et al.High throughput substrate specificity profiling of serine and cysteine proteases using solution-phase fluorogenic peptide microarrays[J].Mol Cell Proteomics,2005,4(5):626-636.
[11]姚江武,左起亮,林锋.木瓜蛋白酶水解对β-酪蛋白膜的润湿性和构象的影响[J].口腔医学研究,2012,28(7):694-697.

